Антибактериальные лекарственные средства настолько прочно вошли в современную терапевтическую практику, что она немыслима без их применения. Однако к назначению антибиотиков необходимо подходить обдуманно, помня о возможности развития нежелательных явлений, одним из которых может быть антибиотик-ассоциированная диарея (ААД). ААД – это как минимум 3 или более эпизодов неоформленного стула, развившихся на фоне применения антибактериальных препаратов в сроки до 4–8 нед после их отмены, если не выявлена другая причина диареи [1]. В литературе частота диагностики ААД варьируется в достаточно широких пределах: от 5 до 39% у взрослых [2, 3] и от 11 до 40% у детей [4–6].
Современная классификация ААД подразумевает ее разделение на два основных вида:
- Идиопатическая ААД, являющаяся причиной 80% всех случаев диарей, ассоциированных с приемом антибактериальных средств. Согласно используемому статистическому рубрификатору МКБ-10 данный вид ААД классифицируется как К52.9 – неинфекционный гастроэнтерит и колит неуточненный.
- Диарея, обусловленная инфекцией Clostridium difficile (псевдомембранозный колит). Согласно МКБ-10 клинический диагноз: А04.7 – энтероколит, вызванный C. difficile. Он относится к тяжелым инфекционным заболеваниям, приводящим к летальным исходам.
Данная классификация очень важна в терапевтической практике, т.к. отсутствие маркеров инфекции C. difficile у пациента не исключает у него антибиотик-ассоциированный характер диареи.
Патогенез развития идиопатической ААД и диареи, ассоциированной с инфекцией C. difficile, имеет схожий характер. Можно выделить три основных его компонента:
- побочные эффекты собственно антибиотиков (аллергические, токсические, фармакологические);
- осмотическая диарея в результате нарушения метаболизма желчных кислот и углеводов в кишечнике, в основном характерная для цефалоспоринов;
- избыточный микробный рост условно-патогенной флоры в результате подавления облигатной интестинальной микрофлоры желудочно-кишечного тракта (ЖКТ).
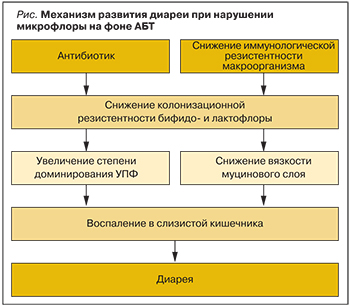 Механизм развития антибиотик-ассоциированной диареи представлен на рисунке.
Механизм развития антибиотик-ассоциированной диареи представлен на рисунке.
При этом для развития диареи, ассоциированной с инфекцией C. difficile, вышеуказанные факторы должны сочетаться с наличием собственно возбудителя, продуцирующего экзотоксины, оказывающие цитопатогенное и энтеротоксическое действие [7]. Следует подчеркнуть, что нарушение микробиоценоза ЖКТ является одним из ведущих факторов, т.к. приводит к изменению структуры доминирования видов нормальной микрофлоры [8], нарушению жизненно важных функций микробиоты, таких как обеспечение короткоцепочечными жирными кислотами колоноцитов и участие в метаболизме желчных кислот [9, 10], что создает предпосылки для роста условно-патогенной флоры, в т.ч. Staphylococcus aureus и C. difficile инфекции [11–13].
В ряде зарубежных исследований было установлено, что риск ААД и C. difficile-ассоциированной диареи зависит от ряда факторов. В частности, проспективное исследование, проведенное в 5 шведских больницах в когорте из 2462 пациентов (в исследовании были учтены данные из разных отделений – инфекционных болезней, ортопедии, хирургии, гериатрии, нефрологии и внутренних болезней), показало, что самая высокая частота ААД регистрировалась в отделениях нефрологии и гериатрии (6,7 и 7,1% соответственно). При этом не было установлено влияние пола или возраста на риск развития ААД. Однако у коморбидных пациентов (сахарный диабет, злокачественные опухоли, хроническая почечная недостаточность и воспалительные заболевания кишечника), имеющих ≥2 из данных патологий, риск развития ААД значительно возрастал. При этом риск развития ААД у пациентов, получавших антибиотики в течение 3-х дней, был значительно ниже, чем у больных, получавших их в течение более длительного периода времени [3].
Также факторами риска развития ААД являются: возраст старше 70 лет, большая длительность пребывания в стационаре, наличие инвазивных вмешательств (в частности, проведение эндоскопических исследований, зондовое кормление), применение антацидов [2].
Если говорить о рисках развития ААД применительно к виду антибактериальной терапии (АБТ), то следует подчеркнуть, что практически все антибактериальные препараты, особенно активные в отношении анаэробов, способны вызывать это заболевание. Так, в приведенном выше исследовании было установлено, что терапия цефалоспоринами, клиндамицином или пенициллинами широкого спектра действия была ассоциирована с повышенным риском развития ААД [3].
Аналогичные данные были получены при применении ампициллина: развитие ААД было установлено в 5–10% случаев его применения; для цефалоспоринов данный показатель составил 10–25%. При этом лишь в 2–5% случаев была диагностирована ААД, связанная с использованием других антибиотиков, таких как тетрациклин, макролиды (эритромицин), нитрофурантоин, ко-тримоксазол, фторхинолоны, аминогликозиды (канамицин, гентамицин) [14].
По данным В.Т. Ивашкина и соавт., развитие ААД наблюдалось у 20–30% больных, получавших клиндамицин. При этом способ введения антибиотиков не играет особой роли. При пероральном приеме, помимо влияния на кишечную микрофлору, происходит их местное воздействие непосредственно на слизистую оболочку тонкой кишки; при парентеральном введении антибиотики воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишки. Существенно повышают риск ААД увеличение длительности АБТ и проведение повторных ее курсов, комбинации нескольких препаратов, а также использовании антибиотиков, выводящихся с желчью [15].
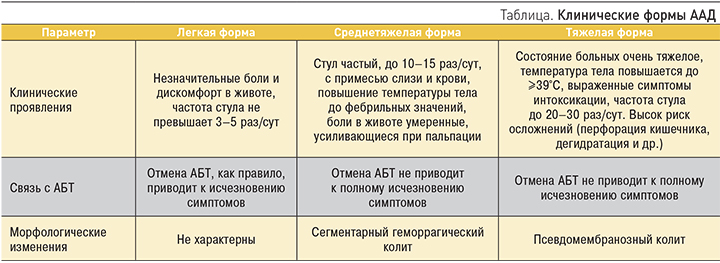
Клиническая картина ААД может варьироваться от незначительного быстро купирующегося интестинального дискомфорта до тяжелых форм диареи и колита, заканчивающихся летальным исходом. Основными клиническими симптомами ААД являются водянистая диарея, боли в животе, нередко носящие схваткообразный характер и уменьшающиеся после дефекации; в ряде случаев возможно повышение температуры тела, числа лейкоцитов. В копрограмме могут определяться лейкоциты, слизь, эритроциты. Развитие эксикоза сопровождается гипопротеинемией и вторичной экссудативной энтеропатией. Клинические формы ААД представлены в таблице.
В настоящее время в плане профилактики и терапии ААД, по данным большинства специалистов, ведущая роль принадлежит пробиотикам, уровень рекомендаций в отношении которых с позиций доказательной медицины самый высокий – А [16]. Проведенный за рубежом мета-анализ 25 рандомизированных контролируемых исследований с участием 2810 пациентов показал, что пробиотики значительно – на 57% – снижаются относительный риск ААД [17]. Эти данные были подтверждены и в других работах [18–21].
Клинические эффекты пробиотиков при ААД обусловлены целым рядом механизмов: продукция антимикробных субстанций (бактериоцинов, лизоцима, проглютамата, пероксида); конкурентное взаимодействие с патогенными и условно-патогенными микроорганизмами; синтез цитопротективных веществ (аргинин, глютамин, полиамины); снижение рН толстокишечного содержимого; стимуляция иммунного ответа (синтез sIgA, IgG, повышение синтеза цитокинов [интерлейкины 4 и 10], усиление фагоцитоза); стимуляция секреции муцина; подавление эпителиальной адгезии и транслокации патогенов; стимуляция апоптоза [1].
Ключевым в терапевтической тактике при лечении больных, нуждающихся в АБТ, является раннее, с начала применения антибиотиков, назначение пробиотиков. При этом руководствоваться необходимо знаниями о свойствах штаммов, входящих в пробиотический препарат, и назначать его в достаточной терапевтической дозировке в течение не менее 2–3 нед после окончания АБТ.
Bifidobacterium animalis, подвид lactis BB-12, и Lactobacillus acidophilus (LA-5) относятся к числу пробиотиков, которые показали свою эффективность в профилактике и терапии ААД. Данные штаммы бактерий являются частью нормальной кишечной микрофлоры человека, работают во всех отделах кишечника. Так, входе двойного слепого плацебо-контролируемого рандомизированного исследования была показана эффективность комплекса пробиотиков B. animalis subsp. lactis (BB-12) и L. acidophilus (LA-5) в профилактике ААД у 343 пациентов в течение 7 дней лечения антибиотиками и при последующем наблюдении: частота ААД в основной группе (пациенты, получавшие комплекс пробиотических штаммов) была достоверно ниже (10,8%) по сравнению с группой плацебо (15,56%). При этом в случае развития ААД у пациентов, в терапии которых использовались пробиотики, длительность диареи была достоверно меньше (2,32 сут) по сравнению с группой плацебо (4,58 сут). Также в группе плацебо частота тяжелой диареи была выше (96%), чем в основной группе (31,6%) [22].
В другом многоцентровом двойном слепом рандомизированном плацебо-контролируемом исследовании у взрослых пациентов, получавших в 7-дневный курс пероральной АБТ (цефадроксил, амоксициллин) и находившихся под наблюдением врача в течение 7 дней после окончания приема антибиотиков, применение пробиотических штаммов L. acidophilus (LA-5) и B. lactis (BB- 12) сопровождалось снижением относительного риска ААД, продолжительности и выраженности диареи. В данном исследовании показан благоприятный профиль безопасности этого пробиотического комплекса: не было зарегистрировано ни одного серьезного нежелательного явления, в 2% случае в основной группе были диагностированы несерьезные побочные эффекты [23].
Данный пробиотический комплекс представлен в современном пробитическом препарате Линекс® Форте, каждая капсула которого содержит не менее 2×109 КОЕ живых лиофилизированных бактерий L. acidophilus (LA-5) и B. animalis subsp. lactis (BB-12). Линекс® Форте может быть назначен как с целью защиты микрофлоры кишечника от негативного влияния антибиотиков и профилактики ААД, так и для коррекции микробиоценоза и лечения ААД. Для профилактики ААД прием препарата нужно начинать с первого дня приема антибиотиков по 1 капсуле 1 раз в день независимо от возраста пациента. Для лечения ААД препарат назначают в следующих дозах: детям с рождения до 2 лет – по 1 капсуле 1 раз в день, детям от 2 до 12 лет – по 1 капсуле 1–2 раза в день, детям старше 12 лет и взрослым – по 1 капсуле 2–3 раза в день в зависимости от выраженности симптомов. Нужно обращать внимание пациента на то, что необходимо соблюдать 3-часовой интервал между приемом антибиотика и пробиотика.
Таким образом, необходимость использования антибактериальных препаратов в клинической практике и сопряженный с ней риск негативного влияния на микроэкологическую среду организма человека диктуют необходимость включения в состав комплексной терапии пробиотических лекарственных средств, эффективность которых подтверждается научными данными. Ключевым в тактике ведения пациентов, получающих АБТ, является раннее, с момента назначения антибиотика, применение пробиотиков с изученным штаммовым составом в достаточной терапевтической дозе продолжительным (до 2–3 нед после окончания терапии) курсом.


