История метформина может быть прослежена от насчитывающего несколько веков использования в традиционной медицине растения Galega officinalis. G. officinalis (син. – козлятник, французская сирень) – первое описанное лекарственное растение с четким антидиабетическим действием [1]. Попытки клинического применения гуанидина (1918), которым богато растение, позже – изоамилена гуанидина (галегин), дигуанидина (синтолин А, синтолин Б) (1920-е гг.) оказались неудачными из-за сочетания очевидного сахароснижающего эффекта с выраженной токсичностью. С конца 20-х гг. вплоть до 50-х гг. прошлого века независимыми исследователями Германии и Франции синтезировались и активно изучались первые бигуаниды. В 1957–1958 гг. впервые были опубликованы результаты исследования эффектов метформина, буформина и фенформина. Фенформин и буформин, войдя в клиническую практику, обнаружили наиболее мощное сахароснижающее действие, но с конца 1970-х гг. их применение было прекращено в связи с очевидным риском развития лактацидоза [2]. С этого времени единственным клинически применяемым бигуанидом стал метформин (диметилбигуанид).
ПРИМЕНЕНИЕ МЕТФОРМИНА ПРИ САХАРНОМ ДИАБЕТЕ 2 ТИПА
Во всем мире метформин уже более 50 лет широко используется в качестве препарата первой линии для лечения пациентов с сахарным диабетом (СД) 2 типа [3, 4]. Это эффективный пероральный антидиабетический препарат с эффектом снижения инсулинорезистентности (ИР) в печени и скелетных мышцах, угнетающий продукцию глюкозы печенью, повышающий периферический захват глюкозы, корректирующий гиперинсулинемию. Оптимально эффективная доза метформина составляет ≥1500 мг. Метформин адсорбируется в основном в 12-перстной и тощей кишке, его биодоступность при пероральном приеме составляет 50–60%. Метформин накапливается в печени в концентрации, примерно в 10 раз превышающей плазменную. Выводиться метформин через почки, не метаболизируясь; период полужизни препарата составляет около 5 ч.
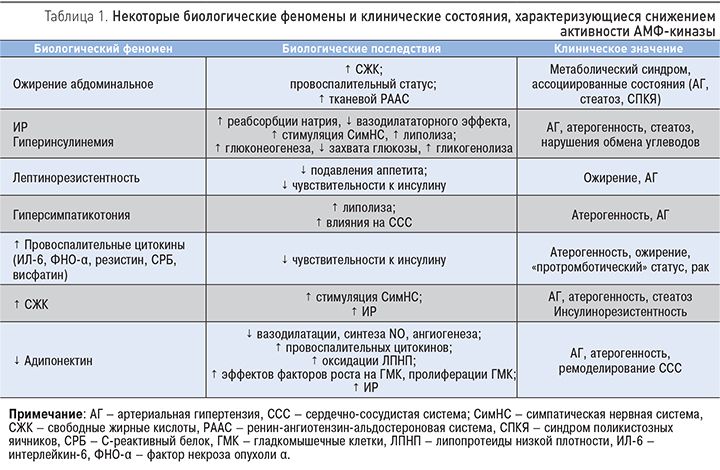
Помимо антидиабетического, метформин имеет множество биологических эффектов: антиагрегационный, антиоксидативный, гиполипидемический (влияние на общий холестерин, холестерин липопротеидов высокой и низкой плотности, триглицериды), противовоспалительный, анорексигенный, антиатеросклеротический, эффект снижения уровня конечных продуктов гликирования, антипролиферативный и др. Механизм его действия до сих пор не вполне ясен. Общепризнано, что антигипергликемическое действие метформина – комплексное и многофакторное и, вероятно, в основном связано с преходящим ингибированием комплекса I митохондриальной дыхательной цепи, что ведет к повышению коэффициента АМФ/АТФ и активации АМФ-киназы. Последнее сопровождается множеством эффектов на уровне клетки, ткани, органа и организма в целом, учитывая биологические последствия снижения активности АМФ-киназы (табл. 1).
Метформин-ассоциированная активация АМФ-киназы переводит клетку из анаболического в катаболическое состояние с угнетением синтеза глюкозы, липидов и белка, увеличением окисления жирных кислот и глюкозы [5]. Хотя АМФ-киназа на сегодняшний день – основная мишень клеточного действия метформина, метаболические эффекты препарата могут быть независимы от АМФ-киназного механизма [6].
Традиционно печень рассматривается как ключевой орган в противодиабетическом действии метформина. Вместе с тем последнее время все больше обсуждаются кишечные эффекты препарата, именно им, возможно, принадлежит главенствующая роль в реализации его гипогликемического действия, тем более что основным «резервуаром» метформина является именно кишечник, где концентрация препарата в 300 раз выше, чем в плазме крови [7]. Установлено, что метформин опосредованно повышает глюкозозависимую секрецию инсулина через повышение секреции глюкагоноподобного пептида 1 (ГПП-1) L-клетками кишечника и, возможно, также путем снижения деградации ГПП-1 [7–9]. Кроме того, в экспериментах на животных было показано, что метформин снижает абсорбцию глюкозы в кишечнике, увеличивает продукцию лактата энтероцитами, усиливает метаболизм желчных кислот и влияет на состав кишечной микробиоты [10, 11].
Выраженность сахароснижающего эффекта метформина сопоставима с таковой препаратов сульфонилмочевины, но в отличие от последних применение метформина характеризуется низким риском гипогликемии, снижения функции почек, развития неалкогольной жировой болезни печени (НАЖБП) и гепатоцеллюлярной карциномы [12–14].
Сердечно-сосудистые плейотропные эффекты метформина в группе пациентов с СД 2 типа впервые были обнаружены при анализе результатов исследования UKPDS (n=342): у пациентов с СД 2 типа и ожирением метформин достоверно снижал частоту случаев инфаркта миокарда на 39%, коронарной смерти на 50% и смерти от всех причин на 36%. Десятилетний период наблюдения после завершения исследования показал, что среди пациентов, получавших метформин, частота инфаркта миокарда и смерти от всех причин была достоверно ниже (на 33%). В исследовании PRESTO также было показано, что метформин достоверно снижает частоту любых клинически значимых неблагоприятных событий (на 28%), инфаркта миокарда (на 69%) и смертность от всех причин (на 61%). В дальнейшем множество рестроспективных анализов баз данных, как и некоторые небольшие проспективные исследования, подтвердили потенциал метформина в отношении снижения неблагоприятных сердечно-сосудистых событий у пациентов с СД 2 типа с различным (низким или высоким) сердечно-сосудистым риском, ишемической болезнью сердца, сердечной недостаточностью [15, 16]. Недавно опубликованный мета-анализ также продемонстрировал, что лечение метформином пациентов с СД 2 типа ассоциировано со снижением сердечно-сосудистой смертности в сравнении с любыми другими антидиабетическими средствами и плацебо [17]. Метформин показал способность достоверно снижать риск развития фибрилляции предсердий у пациентов с СД 2 типа [18].
 На сегодняшний день широко обсуждаемые потенциальные плейотропные (не связанные со снижением уровня глюкозы крови) механизмы кардиопротективных эффектов метформина включают: снижение уровня метилглиоксаля (гликирующий реагент), секреции липопротеидов очень низкой плотности, уровня триглицеридов и постпрандиальной липемии; коррекцию эндотелиальной дисфункции; снижение уровня ингибитора активатора плазминогена I; улучшение фибринолиза; снижение массы тела (на 2–3 кг); уменьшение продукции моноцитами ФНО-α и тканевого фактора, ингибирование дифференцировки моноцитов в макрофаги (компонент противовоспалительного и антиатеросклеротического эффекта); обратимое снижение агрегации тромбоцитов; снижение продукции активных форм кислорода вследствие ингибирования протеинкиназы С; повышение активности супероксиддисмутазы [15, 19–21].
На сегодняшний день широко обсуждаемые потенциальные плейотропные (не связанные со снижением уровня глюкозы крови) механизмы кардиопротективных эффектов метформина включают: снижение уровня метилглиоксаля (гликирующий реагент), секреции липопротеидов очень низкой плотности, уровня триглицеридов и постпрандиальной липемии; коррекцию эндотелиальной дисфункции; снижение уровня ингибитора активатора плазминогена I; улучшение фибринолиза; снижение массы тела (на 2–3 кг); уменьшение продукции моноцитами ФНО-α и тканевого фактора, ингибирование дифференцировки моноцитов в макрофаги (компонент противовоспалительного и антиатеросклеротического эффекта); обратимое снижение агрегации тромбоцитов; снижение продукции активных форм кислорода вследствие ингибирования протеинкиназы С; повышение активности супероксиддисмутазы [15, 19–21].
Таким образом, можно уверенно говорить о том, что метформин не имеет неблагоприятных сердечно-сосудистых эффектов у пациентов с СД 2 типа, может позитивно влиять на некоторые факторы риска сердечно-сосудистых заболеваний и способен снижать сердечно-сосудистую заболеваемость и смертность [15].
Согласно результатам недавних исследований, помимо кардиопротективных эффектов у пациентов с СД 2 типа, метформин может оказывать долгосрочный защитный эффект против нейродегенеративных заболеваний, включая болезнь Альцгеймера и болезнь Паркинсона [22], снижать риск развития глаукомы [23] и некоторых форм рака [20].
ПЕРЕНОСИМОСТЬ, БЕЗОПАСНОСТЬ, ОГРАНИЧЕНИЯ И ПРОТИВОПОКАЗАНИЯ ПРИ ИСПОЛЬЗОВАНИИ МЕТФОРМИНА
Наиболее распространенными побочными эффектами метформина являются гастроинтестинальные – диарея, тошнота, рвота, металлический привкус во рту, вздутие живота, метеоризм и анорексия. Длительная терапия метформином дозозависимо ассоциирована с развитием дефицита витамина В12 у 5,6–36% пациентов [24]. Предположительные механизмы развития метформин-ассоциированного дефицита В12: индуцированное препаратом снижение секреции желчных кислот, приводящее к избыточному бактериальному росту в тонкой кишке, что в свою очередь ведет к увеличению связывания бактериями комплекса «внутренний фактор–В12» и снижению кишечной абсорбции В12; уменьшение секреции внутреннего фактора; снижение кишечной абсорбции В12 вследствие антагонизма метформина и кальций-зависимых рецепторов к комплексу «внутренний фактор–В12» на клетках подвздошной кишки [25].
Наиболее серьезным побочным эффектом метформина считается молочнокислый ацидоз (лактацидоз). Ранее, учитывая риск лактацидоза, применение метформина значительно ограничивалось у пациентов со снижением функции почек, сердечной недостаточностью, при применении контрастных веществ. Сегодня взгляд на эту проблему существенно изменился. В актуальном систематическом обзоре 347 исследований не было выявлено различий в частоте развития фатального и нефатального лактацидоза на фоне приема метформина и препаратов сравнения с компараторами [26]. Более того, в наиболее «угрожаемых» подгруппах больных СД 2 типа (пациенты палат интенсивной терапии, с хронической болезнью почек) не было обнаружено участия метформина в развитии лактцидоза [27, 28]. Также метформин продемонстрировал значимое снижение смертности среди пациентов с расчетной скоростью клубочковой фильтрации (рСКФ) 30–60 мл/мин/1,73 м2 без повышения уровня лактата [29]. В итоге совокупность имеющихся на сегодняшний день данных касательно метаболической безопасности метформина существенном образом изменила тактику его назначения. В частности, Американская диабетическая ассоциация, Европейская ассоциация по изучения диабета, как и FDA, имеют единую обновленную позицию относительно применения метформина у пациентов с хронической болезнью почек:
- перед началом терапии оценить рСКФ (допустимый нижний порог для старта терапии метформином – 45 мл/мин/1,73 м2);
- не рекомендуется начинать применение метформина у пациентов с рСКФ 30–45 мл/мин/1,73 м2;
- метформин противопоказан при рСКФ <30 мл/мин/1,73 м2;
- метформин надо отменить, если на фоне терапии рСКФ снизилось <30 мл/ мин/1,73 м2;
- при снижении рСКФ <45 мл/мин/1,73 м2 на фоне приема метформина необходимо оценить преимущества и риск продолжения лечения [30].
Установлено также, что частота контраст-индуцированной нефропатии у пациентов с СД, получающих метформин, достаточно низкая: от 0% у лиц без предшествующей почечной недостаточности до 4,7% у пациентов с почечной недостаточностью [31]. В этой связи с 2015 г. Американский колледж радиологии рекомендует новые подходы к применению метформина на фоне процедур с использованием контрастных веществ (табл. 2).
Вне контекста безопасности метформина следует отметить, что при осуществлении визуализирующих процедур препарат интенсивно увеличивает поглощение фтордезоксиглюкозы (ФДГ) в толстой и, в меньшей степени, тонкой кишке, что ограничивает диагностические возможности позитронно-эмиссионной и компьютерной томографии с применением ФДГ и может маскировать первичные или метастатические желудочно-кишечные злокачественные опухоли. В связи с этим у онкологических больных рекомендуется прекращать прием метформина за 48 ч до начала сканирования (ФДГ-ПЭТ/КТ) с целью оптимизации чувствительности метода для обнаружения злокачественных новообразований [33].
Очевидно, что у пациентов с сердечной недостаточностью применение метформина также безопасно и может предоставлять дополнительные преимущества в виде снижения смертности и риска повторных госпитализаций [16]. Данные о повышении риска лактацидоза на фоне приема метформина не подтверждаются, он безопасен в т.ч. у пациентов со сниженной фракцией выброса и должен быть препаратом первого выбора при условии сохраненных функций почек и печени [34, 35].
На сегодняшний день метформин по-прежнему противопоказан кормящим и беременным женщинам, при кетоацидозе, печеночной недостаточности или злоупотреблении алкоголем, в условиях тяжелой тканевой гипоксии (например, при инфаркте миокарда или сепсисе).
ПРИМЕНЕНИЕ МЕТФОРМИНА У ПАЦИЕНТОВ БЕЗ Сахарного диабета
Клинические применение метформина у пациентов без СД наиболее обсуждаемо при ожирении, СПКЯ, НАЖБП и раке.
Ожирение. Общеизвестно, что у пациентов с СД 2 типа метформин может способствовать снижению массы тела на 2–3 кг за счет жировой ткани [36]. Несколько исследований было посвящено изучению эффекта снижения массы тела при использовании метформина у пациентов с избыточной массой тела без нарушений углеводного обмена. Результаты систематического анализа 5 нерандомизированных клинических исследований без плацебо-контроля (первичная конечная точка – снижение массы тела) показали ассоциацию терапии метформином со снижением массы тела на 2,9–9,0 кг [37]. В 6-месячном исследовании случай–контроль среди пациентов с индексом массы тела ≥27 кг/м2 и уровнем гликированного гемоглобина 5,6% снижение массы тела составило в среднем 5,8±7,0 кг при отсутствии развития случаев гипогликемии. При этом около 20% пациентов, получавших метформин, не отметили снижения массы тела [38]. Безусловно, необходимы дополнительные исследования, чтобы достоверно подтвердить влияние (умеренное) метформина на массу тела у пациентов без СД 2 типа.
Синдром поликистозных яичников. СПКЯ – наиболее распространенная эндокринная патология, имеющая репродуктивные, метаболические и психологические проявления и поражающая 6–21% женщин репродуктивного возраста [39]. Несмотря на фенотипическую гетерогенность СПКЯ, большинство женщин имеют ту или иную степень ИР, избыточную массу тела и, в части случаев, СД 2 типа. Точный патогенез СПКЯ до сих пор в точности не установлен, и, как следствие, нет единого долгосрочно эффективного метода лечения заболевания. Метформин используется в лечении СПКЯ с 1994 г. Позитивные эффекты метформина при СПКЯ (снижение продукции андрогенов яичниками, улучшение секреции лютеинизирующего гормона, метаболической функции эндометрия и репродуктивных исходов) связывают с его способностью повышать экспрессию мРНК белка транспортера глюкозы (GLUT 4), уровень которого, как показывают исследования, снижается при СПКЯ [40]. У пациенток с СПКЯ метформин уменьшает гирсутизм и акне [41], способствует снижению массы тела. По данным систематического обзора, включающего 12 рандомизированных клинических исследований женщин с СПКЯ, метформин достоверно снижает индекс массы тела в сравнении с плацебо [42]. По данным недавнего исследования, метформин в монотерапии или в сочетании с комбинированными оральными контрацептивами (КОК) снижает у пациенток с СПКЯ без СД 2 типа массу тела в отличие от монотерапии КОК: на фоне монотерапии метформином медиана снижения массы тела через 12 мес лечения составила 3 кг, при его сочетании с КОК – 1,9 кг, в то время как среди женщин, получавших монотерапию КОК, наблюдалось увеличение массы тела на 1,2 кг [43].
В соответствии с текущими рекомендациями, метформин должен применяться при СПКЯ в сочетании с СД или нарушением толерантности к глюкозе, в т.ч. у подростков. Кроме того, он может использоваться у женщин с нарушениями менструального цикла как препарат второго выбора при непереносимости гормональных контрацептивов, а также как адъювантная терапия бесплодия у женщин с СПКЯ, участвующих в процедурах экстракорпорального оплодотворения, для профилактики синдрома гиперстимуляции яичников [44].
Неалкогольная жировая болезнь печени. НАЖБП поражает около 30% взрослых людей в общей популяции и до 60–80% пациентов с СД и ожирением, в течение 10 лет она в 20–25% случаев прогрессирует с развитием цирроза печени, который, в свою очередь, в некоторых случаях может приводить к развитию гепатоцеллюлярной карциномы, повышает риск сердечно-сосудистых заболеваний и у пациентов без исходных нарушений углеводного обмена повышает риск СД. Четкая ассоциация НАЖБП и СД позволяет рекомендовать обязательный активный скрининг СД cреди пациентов с НАЖБП, а в группе пациентов с СД – обязательный мониторинг уровня ферментов печени для выявления прогрессирования заболевания [45]. Патогенез вирус-негативной НАЖБП мультифакториален, включает множество механизмов. Учитывая, что при этом ИР отдают ключевую роль как первому «удару» («hit»), приводящему к жировой инфильтрации печени (гипотеза «two hits»), применение инсулиносенситайзеров представляется вполне оправданным. В соответствии с текущими данными у пациентов с СД 2 типа метформин, в отличие от препаратов сульфонилмочевины и инсулина, не ассоциируется с развитием НАЖБП и/или риском ее прогрессирования [13]. Тем не менее результаты мета-анализов рандомизированных клинических исследований продемонстрировали позитивные эффекты метформина у пациентов с НАЖБП в отношении массы тела, контроля гликемии, уровня липидов, артериального давления, С-реактивного белка, ИР, но не улучшение гистологической картины печени. В целом доказательств гистологической эффективности метформина при НАЖБП недостаточно, и на сегодняшний день он, в отличие от пиоглитазона, не рекомендуется для пациентов с НАЖБП [45, 46]. В соответствие с актуальными российскими рекомендациями метформин может применяться при неалкогольном стеатогепатите у детей в дозе 1000 мг/сут [46].
Вместе с тем следует отметить накапливающиеся в группе пациентов с циррозом печени данные о безопасности препарата, его эффекте снижения смертности и профилактическом потенциале в отношении развития гепатоцеллюлярной карциномы [14, 47].
Злокачественные новообразования. Нарастает количество исследований, демонстрирующих связь лечения метформином (относительно других антидиабетических средств) со снижением риска развития различных форм рака и ассоциированной смертности. Так, применение метформина коррелировало со снижением заболеваемости несколькими типами рака, включая рак молочной железы, простаты, поджелудочной железы и гепатоцеллюлярную карциному [51]. По современным представлениям, антипролиферативная, химиопрофилактическая и химиотерапевтическая активность метформина объясняется ослаблением инсулин/ИФР-1 (инсулиноподобный фактор роста 1) – опосредованного сигнального пути; ингибированием митохондриального комплекса I окислительного фосфорилирования; активированием митоген-активируемой протеинкиназы, что ведет к ингибированию mTOR (протеинкиназа, регулирующая клеточный рост и пролиферацию); уменьшением продукции эпидермального фактора роста; повышением противоопухолевого иммунитета [51, 52]. Безусловно, адъювантная роль метформина должна быть оценена в будущих рандомизированных клинических исследованиях II фазы в специфических группах больных, что позволит трансформировать новые данные об этом «старом» препарате в рекомендации для практического применения [26].
ЗАКЛЮЧЕНИЕ
Метформин – один из самых назначаемых противодиабетических препаратов с многокомпонентным органным и системным действием, эффективно и долгосрочно контролирующий уровень глюкозы крови и предоставляющий дополнительные преимущества пациентам с СД 2 типа в отношении контроля некоторых факторов риска сердечно-сосудистых заболеваний (избыточная масса тела, дислипидемия, ИР и состояния, ассоциированные с ней), снижения сердечно-сосудистой смертности, риска некоторых форм рака. Возможности применения метформина при СПКЯ у взрослых и подростков, при НАЖБП у детей закреплены в актуальных клинических рекомендациях. В остальном же значительный потенциал плейотропных эффектов препарата в области онкологии, неврологии, офтальмологии, антивозрастной медицины требует дальнейшего изучения.



