Сахарный диабет (СД) 2 типа является важнейшей медико-социальной проблемой, что обусловлено его широкой распространенностью, преждевременной инвалидизацией и смертью больных. Данное заболевание, вероятно, останется одним из наиболее сложных вопросов здравоохранения на протяжении всего XXI в. Согласно последним данным Всемирной федерации диабета, на сегодняшний день распространенность заболевания составляет 415 млн человек, а к 2040 г. эта цифра составит уже 642 млн [1]. Причем на данный момент 320,5 млн больных СД 2 типа относятся к группе трудоспособного населения (20–64 года). Несмотря на многообразие лекарственных средств, находящихся в настоящее время в арсенале врача, проблема выбора оптимальных схем сахароснижающей терапии (ССТ) остается очень актуальной и требует пристального внимания. Существует множество факторов, которые необходимо учитывать при выборе адекватной ССТ для каждого конкретного пациента, таких как возраст, пол, длительность СД, сопутствующие заболевания, уровень комплаентности пациента, доступность терапии и т.д. Одной из наиболее перспективных групп сахароснижающих препаратов (ССП) является средства инкретин-направленной терапии – ингибиторы дипептидилпептидазы-4 (ДПП-4) и агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1). За последние несколько лет ингибиторы ДПП-4, благодаря уникальному механизму действия, высокой эффективности и безопасности, доступности и простоте применения, получили широкое распространение как в мире, так и в России. Информационная база по эффективности и безопасности препаратов постоянно расширяется. Учитывая это, большой интерес представляет рассмотрение возможностей и преимуществ ингибиторов ДПП-4 у различных групп пациентов с СД 2 типа.
Как известно, СД является сложным, многогранным и многофакторным заболеванием, знания о котором постоянно расширяются. Если совсем недавно считалось, что основной вклад в развитие и прогрессирование СД 2 типа вносят 8 патофизиологических дефектов (дисфункция β-клеток, инсулинорезистентность клеток печени и тканей-мишеней, нарушения инкретинового эффекта, гиперпродукция глюкагона α-клетками поджелудочной железы, активация липолиза адипоцитами, усиление реабсорбции глюкозы почками, дисфункция нейротрансмиттерной передачи на уровне центральной нервной системы), то в 2016 году данная концепция была дополнена еще тремя дефектами: системным воспалением, патологическими изменениями микрофлоры кишечника и повышением скорости абсорбции глюкозы на уровне желудка и тонкого кишечника [2, 3]. Таким образом, в настоящее время достоверно известно уже о 11 звеньях патогенеза СД 2 типа. Глубокое понимание патофизиологических процессов, лежащих в основе СД 2 типа, имеет важнейшую практическую ценность и необходимо в первую очередь для успешной терапии заболевания [4]. Оптимальная стратегия выбора ССТ состоит в применении минимально возможного количества препаратов, воздействующих при этом на максимальное число патогенетических звеньев СД 2 типа, для достижения своевременного и долгосрочного контроля заболевания [3]. В связи с этим в научном сообществе все чаще и активнее идут дебаты по возможному пересмотру последовательных схем терапии в пользу более раннего назначения комбинированной терапии ССП, оказывающими влияние на большинство звеньев патогенеза СД 2 типа [3, 5, 6]. Российские алгоритмы специализированной медицинской помощи больным СД рекомендуют назначение стартовой двойной комбинированной терапии пациентам с уровнем гликированного гемоглобина (HbA1c) >7,5% при постановке диагноза [7]. В связи с тенденциями современной диабетологии ингибиторы ДПП-4, воздействуя на большинство вышеуказанных патогенетических дефектов, представляют собой вариант патофизиологически обоснованной терапии, а одной из наиболее перспективных комбинаций препаратов является их сочетание с метформином, оказывающее влияние практически на все звенья прогрессирования СД 2 типа. В данном контексте интересно рассмотреть эффективность стартовой комбинации препарата вилдаглиптин (Галвус) как одного из представителей группы ингибиторов ДПП-4 с метформином. Селективное и обратимое ингибирование фермента ДПП-4 на фоне терапии вилдаглиптином приводит к увеличению периода полужизни эндогенно секретируемых глюкозозависимого инсулинотропного полипептида и ГПП-1, повышая возможности глюкозозависимой секреции инсулина β-клетками и оказывая плейотропные внепанкреатические эффекты, а метформин остается препаратом выбора для коррекции инсулинорезистентности [8].
Клиническая эффективность и преимущества стартовой комбинированной терапии вилдаглиптин + метформин продемонстрированы в 24-недельном двойном слепом контролируемом исследовании Е. Bosi и соавт., в которое были включены 1179 пациентов с СД 2 типа, ранее не получавшие ССТ. Среднее изменение HbA1с через 24 нед терапии в группе вилдаглиптин 50 мг + метформин 1000 мг 2 р/сут составило -1,8%. На фоне терапии не отмечалось случаев гипогликемии, в том числе тяжелой; также не наблюдалось увеличения массы тела [9]. Таким образом, у пациентов, ранее не получавших ССТ, стартовая комбинация вилдаглиптин + метформин характеризуется высокой эффективностью, благоприятным профилем безопасности и низким риском развития гипогликемии. Вилдаглиптин продемонстрировал высокую эффективность и при его добавлении к терапии пациентов, не достигших компенсации СД на фоне монотерапии метформином. Согласно данным другого 24-недельного двойного слепого мультицентрового плацебо-контролируемого исследования, вилдаглиптин 50 мг 2 р/сут обеспечивал клинически значимое снижение уровня HbA1c на 1,1% при интенсификации терапии у пациентов с неадекватным контролем гликемии (HbA1с 7,5–11%) на фоне монотерапии метформином ≥1500 мг/сут [10]. При этом комбинация вилдаглиптин + метформин обладает весомыми преимуществами относительно комбинации метформин + препараты сульфонилмочевины (ПСМ). Так, при сравнении комбинированной терапии вилдаглиптин + метформин и глимепирид + метформин в течение как одного, так и двух лет исследования эффективность была аналогичной [11, 12], но при этом число эпизодов гипогликемии различалось в 14 раз, составляя 2,3% в группе вилдаглиптина против 18,2% в группе глимепирида. Кроме того, на фоне терапии вилдаглиптином не отмечено ни одного эпизода тяжелой гипогликемии по сравнению с 10 эпизодами в группе глимепирида (p<0,01). Это обусловлено уникальным глюкозозависимым механизмом действия ингибиторов ДПП-4, позволяющим достичь гликемических целей с минимальным риском развития гипогликемических состояний [8, 13]. Дополнительным благоприятным фактором, повышающим приверженность пациентов лечению, является наличие фиксированной комбинации вилдаглиптин + метформин [14].
Мы привыкли оценивать эффективность лечения СД, рассматривая уровень HbA1c как ключевой, если не сказать единственный показатель, «золотой стандарт», определяющий качество гликемического контроля. Однако существует необходимость четкого понимания того, что и другие показатели гликемии могут иметь важное значение в плане обеспечения достижения ряда необходимых дополнительных клинических целей [15]. В последние годы все большую актуальность получает феномен гликемический изменчивости или вариабельности гликемии (ВГ) как возможный самостоятельный предиктор осложнений СД. Вероятнее всего, неблагоприятное влияние ВГ на сосуды опосредуется через стимуляцию окислительного стресса и активацию системного воспаления [16, 17]. Появляется все больше данных, демонстрирующих важность минимизации ВГ для успешного контроля СД 2 типа. В проведенном систематическом обзоре, посвященном роли ВГ в формировании осложнений СД, отмечено, что если в отношении СД 1 типа она на сегодняшний день не столь очевидна, то при СД 2 типа – достаточно весома [18]. Так, только в 2 из 8 исследований была отмечена статистически значимая связь между ВГ и развитием микрососудистых осложнений при СД 1 типа, в то время как при СД 2 типа в 8 из 10 исследований выявлена отчетливая связь ВГ с развитием как микро-, так и макрососудистых осложнений [16, 18]. Несколько исследований позволили установить значимую взаимосвязь между ВГ и известными факторами риска атеросклероза (толщина комплекса интима-медиа каротидных артерий и эндотелий-зависимая вазодилатация плечевой артерии), и это позволило предположить, что высокая ВГ может способствовать развитию атеросклероза независимо от других факторов риска [19, 20]. В одном из исследований последних лет была продемонстрирована достоверная корреляция между ВГ и риском прогрессирования диабетической ретинопатии, а в другой работе обнаружена выраженная корреляция между нестабильным гликемическим профилем и экскрецией альбумина с мочой [21, 22]. Накопленные данные дают основания предполагать, что влияние на ВГ, наряду с контролем уровня НbA1с и других традиционных параметров риска, является наиболее перспективным подходом к достижению эффективного управления СД 2 типа.
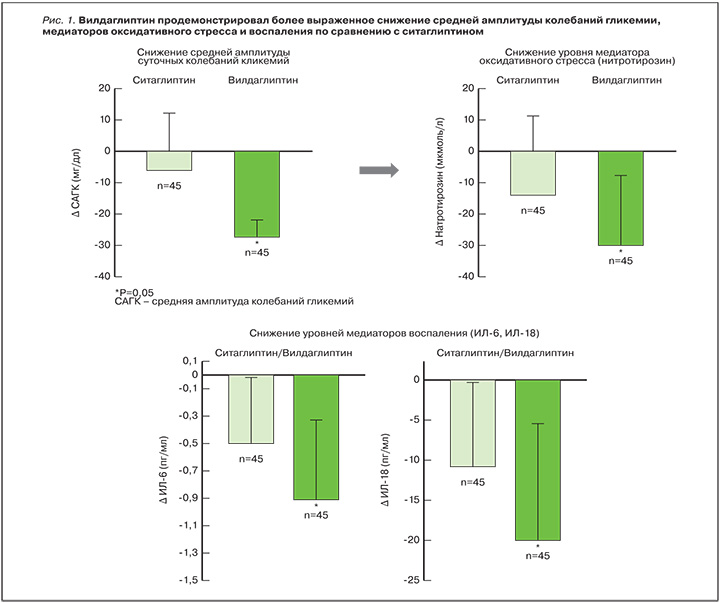
Оценка краткосрочной и долгосрочной стабильности параметров гликемии в течение суток за последнее время существенно расширилась, особенно после внедрения в рутинную практику глюкометров, обеспечивших возможность частого самоконтроля уровня глюкозы, и систем непрерывного мониторирования глюкозы, позволяющих наиболее точно проводить анализ ВГ на протяжении нескольких суток. Конечно, применение данного метода для сравнения различных схем терапии не всегда возможно в рутинной клинической практике, однако мы обладаем знаниями, позволяющими изначально отдавать предпочтение ССП, оказывающим наиболее благоприятное влияние на ВГ. В связи с этим пристального внимания заслуживают ингибиторы ДПП-4. В результате их глюкозозависимого влияния на функциональную активность β- и α-клеток поджелудочной железы осуществляется регуляция ключевых механизмов, которые лежат в основе феномена глюкозотоксичности и ВГ. В многочисленных исследованиях изучено влияние ингибиторов ДПП-4 не только на стандартные показатели, но и на ВГ у больных СД 2 типа. В сравнительном исследовании Y.L. He и соавт., изучавших влияние терапии вилдаглиптином и глимепиридом у больных СД 2 типа по данным непрерывного мониторинга гликемии, выявлено сравнимое уменьшение постпрандиальной гликемии, при этом терапия вилдаглиптином обеспечила более низкую ВГ, причем показатель MAGE (применяется для оценки выраженности нестабильности гликемии) был на 20% ниже [23]. Важная информация была получена в исследовании R. Marfella и соавт., в котором было проведено прямое сравнение двух наиболее изученных ингибиторов ДПП-4 – вилдаглиптина и ситаглиптина в комбинации с метформином [24]. Согласно опубликованным результатам, через 3 мес терапии отмечалось сравнимое снижение уровня HbA1c, но лечение вилдаглиптином способствовало более выраженной динамике параметра MAGE в сравнении с ситаглиптином. Особо следует отметить, что достоверно большая и постоянная суточная активность инкретина ГПП-1 также наблюдалась при добавлении к метформину вилдаглиптина [24]. Подобные различия между ингибиторами ДПП-4 могут быть связаны как с особенностями взаимодействия с молекулой ДПП-4 (крепкое связывание субстрат-специфичного ингибитора вилдаглиптина обеспечивает более длительное подавление фермента), так и с различной биодоступностью препаратов [24, 25]. Позже было опубликовано исследование, в котором не только проводилась оценка влияния терапии вилдаглиптином на показатели ВГ, но и изучалось влияние изменений суточных колебаний гликемии на показатели оксидативного стресса (уровень нитротирозина) и системного воспаления (интерлейкины 6 и 18) [26]. Через 12 нед исследования установлено, что вилдаглиптин обеспечил не только статистически более значимое снижение MAGE, но и ассоциированное с ним снижение маркеров окислительного стресса (нитротирозин -0,3±0,03 мкмоль/л) и воспаления (интерлейкин-6 -1,5±0,16 пг/мл) по сравнению с ситаглиптином [26]. Можно констатировать, что применение вилдаглиптина обеспечивает более стабильный уровень глюкозы крови в течение суток за счет стабильной концентрации препарата в плазме, что сопровождается позитивным влиянием на маркеры свободнорадикальных процессов и воспаления [26]. Данное исследование еще раз подтвердило, что устранение резких перепадов уровня глюкозы в течение суток в дополнение к нормализации уровня HbA1c эффективно снижает уровень маркеров атеросклероза, а контроль избыточной ВГ в течение суток может принести существенную клиническую пользу пациентам с СД 2 типа (рис. 1).
Таким образом, назначение комбинированной патофизиологически обоснованной терапии ингибитором ДПП-4 и метформином уже на самых ранних этапах СД 2 типа позволяет достичь своевременного эффективного, многогранного контроля гликемии, открывая новые перспективы в предотвращении или замедлении развития и прогрессирования фатальных осложнений заболевания. Терапия ингибиторами ДПП-4 обеспечивает дополнительные преимущества и у пациентов на более поздних стадиях СД 2 типа. Так, вилдаглиптин позволяет достичь адекватного гликемического контроля не только в составе двойной, но и тройной комбинированной терапии, а также в комбинации с инсулином у пациентов, ранее получавших инсулинотерапию в стабильной дозе без достижения адекватного контроля гликемии [27–29].

Безопасность ССТ является важным аспектом, который необходимо учитывать при выборе тактики лечения у всех пациентов с СД 2 типа, особенно с длительным стажем заболевания. Стоит отметить, что безопасность ССП подразумевает не только низкий риск гипогликемии и увеличения массы тела. Очень важным моментом является влияние на сердечно-сосудистые исходы. Кардиоваскулярная безопасность ингибиторов ДПП-4 подтверждена результатами масштабных клинических исследований и крупных метаанализов, свидетельствующих, что применение этих препаратов не ассоциируется с увеличением сердечно-сосудистого риска и частоты тяжелых сердечно-сосудистых исходов (нефатальный инфаркт, нефатальный инсульт, смерть по сердечно-сосудистым причинам) [30–33]. Кроме того, важные сведения были получены при анализе баз данных нескольких европейских регистров [34, 35].
Так, согласно данным национального регистра Швеции, терапия ингибитором ДПП-4 в сочетании с метформином значительно снижает частоту сердечно-сосудистых событий, тяжелых гипогликемий и смертности в сравнении с терапией ПСМ + метформин [34] (рис. 2).
Хроническая болезнь почек (ХБП) является еще одним фактором, который необходимо учитывать при выборе тактики терапии СД 2 типа. По некоторым данным, более трети больных СД 2 типа имеют нарушение функции почек (ХБП 2‒5 стадии), а выживаемость и качество жизни при СД, начиная с ранних стадий диабетической нефропатии и при ее прогрессировании до терминальной стадии, остаются низкими по сравнению с другими нозологическими группами. Снижение почечной функции у больных СД повышает и без того высокий риск кардиоваскулярной патологии ввиду активации таких факторов риска, как альбуминурия, системное воспаление, анемия, гиперпаратиреоз, дефицит витамина D и др. Компенсация углеводного обмена играет ключевую роль в профилактике развития и замедлении прогрессировании ХБП у больных СД, что убедительно доказано целым рядом исследований [36–38]. Однако компенсация углеводного обмена при ХБП крайне затруднена из-за высокого риска гипогликемий вследствие снижения ренального глюконеогенеза, кумуляции инсулина, CCП и их метаболитов, возможных ошибок в оценке уровня HbA1c при развивающейся анемии [39]. Вследствие этого при выборе и интенсификации ССТ у таких пациентов требуются большая осторожность и индивидуальный подход.
Несмотря на то, что иДПП-4 зарегистрированы относительно недавно, их эффекты у пациентов с нарушением функции почек изучены более тщательно, чем у зарегистрированных ранее препаратов. Они характеризуются доказанной клинической эффективностью и безопасностью у пациентов с почечной недостаточностью. Одно из наиболее крупных исследований по оценке терапии ингибиторами ДПП-4 у пациентов с ХБП было проведено V. Lukashevich и соавт. [40]. Целью исследования была оценка безопасности и переносимости вилдаглиптина 50 мг/сут при добавлении к текущей терапии в сравнении плацебо у пациентов с СД 2 типа и ХБП средней или тяжелой степени. По окончании 24-недельной терапии вилдаглиптином и последующего наблюдения в течение 28 нед не отмечалось ухудшения функции почек независимо от исходной степени ХБП. Вилдаглиптин обеспечивал значимое снижение уровня HbA1c с низким риском развития гипогликемий. Риск тяжелых гипогликемий был незначительным в обеих группах. Следует отметить, что пациенты с нарушением функции почек подвержены более высокому риску гипогликемических состояний вследствие сниженного клиренса креатинина, кроме того, большинство больных, включенных в исследование, находились на различных режимах инсулинотерапии. В целом безопасность и переносимость лечения вилдаглиптином в дозе 50 мг/сут были сравнимы с плацебо [40].
Естественно, что столь благоприятный профиль безопасности и простота применения делают ингибиторы ДПП-4 препаратами выбора и для когорты пациентов пожилого возраста. Вопросы терапии пожилых пациентов чрезвычайно важны, в связи с тем что заболеваемость СД 2 типа достигает максимальных значений в возрастных категориях ≥60 лет, для которых характерна сочетанная полиорганная патология. Еще одной важной клинической особенностью СД 2 типа в пожилом возрасте является нарушенное распознавание гипогликемических состояний, имеющее серьезные последствия. Терапия ингибиторами ДПП-4 у пожилых больных ассоциирована с минимальным риском гипогликемий, отсутствием увеличения массы тела и хорошей переносимостью. В проведенном рандомизированном двойном слепом плацебо-контролируемом исследовании 105 пациентов с СД 2 типа в возрасте старше 75 лет (средний возраст 78 лет, скорость клубочковой фильтрации 35,3 мл/мин/1,73 м2, большинство больных имели тяжелую кардиоваскулярную патологию в анамнезе) добавление вилдаглиптина к проводимой ССТ обеспечило значительную эффективность к концу исследования. Так, к 24 нед применения вилдаглиптина снижение уровня гликированного гемоглобина достигло -1%±0,2 против -0,2±0,2% (р<0,0001) в группе плацебо [41].
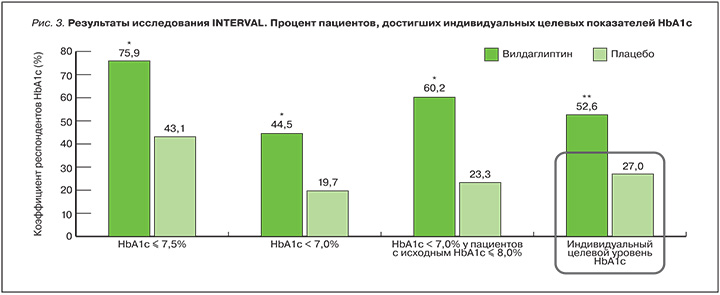
Отдельного внимания заслуживает INTERVAL – 24-недельное многоцентровое рандомизированное плацебо-контролируемое клиническое исследование с участием пациентов старше 70 лет из различных европейских стран [42]. INTERVAL является первым исследованием среди пожилых пациентов, демонстрирующим возможность использования индивидуализированных целей HbA1c в качестве конечной точки у данной популяции пациентов. Исследователи устанавливали индивидуальные целевые показатели для больных лечения согласно их возрасту, исходному уровню HbA1c, сопутствующим заболеваниям и общему состоянию, после чего все пациенты были рандомизированы в группу вилдаглиптина или плацебо. Индивидуализированные в зависимости от исходных характеристик пациентов уровни HbA1c были достигнуты на терапии вилдаглиптином без каких-либо проблем с переносимостью и безопасностью сравнимыми с таковыми плацебо (рис. 3).
Таким образом, эффективность и безопасность применения ингибиторов ДПП-4 на всех этапах СД 2 типа доказаны результатами крупных клинических исследований. Однако хорошо известно, что данные рандомизированных контролируемых исследований не всегда могут быть экстраполированы на популяцию пациентов в рутинной практике. По этой причине чрезвычайно важной является оценка различных режимов ССТ в пострегистрационных исследованиях. Несмотря на инновативность ингибиторов ДПП-4, к настоящему времени накоплено колоссальное количество данных, демонстрирующих высокую эффективность и безопасность их применения в реальной клинической практике [43–46].
EDGE – одно из самых масштабных наблюдательных исследований терапии СД 2 типа в реальной клинической практике. В нем принимали участие около 46 тыс. пациентов в 27 странах мира, в том числе 1650 – в России. Вилдаглиптин в условиях рутинной практики снижал уровень HbA1c в среднем на 1,3%; у 48,7% пациентов в группе вилдаглиптина он достигал целевых значений (<7,0% в данном исследовании) без гипогликемий и без набора массы тела (по сравнению с 19,1% в контрольной группе). Частота гипогликемий составила 1,1% в группе вилдаглиптина и 3,4% в контрольной группе, большинство гипогликемий в группе вилдаглиптина возникали при его комбинации с ПСМ [43]. В 2015 г. было опубликовано исследование GUARD, целью которого являлась оценка клинической эффективности и переносимости вилдаглиптина в монотерапии и комбинации с метформином у пациентов с СД 2 типа в рутинной клинической практике [46]. Полученные данные находятся в соответствии с основными выводами рандомизированных и других неинтервенционных исследований по изучению вилдаглиптина, но самым важным является то обстоятельство, что исследование GUARD позволило получить новые данные по клиническим эффектам ингибиторов ДПП-4 в различных условиях реальной практики. Это исследование включало 19 331 пациента в 4 географических регионах, многонациональное население, в основном из развивающихся стран и экономически нестабильных регионов, где неадекватный гликемический контроль является насущной проблемой [46].
Возвращаясь к сравнению вилдаглиптина с другими ССП, следует вспомнить о крупном многоцентровом исследовании PROVIL с участием 3881 пациента, посвященном изучению эффективности вилдаглиптина как в свободной, так и в фиксированной комбинации с метформином в сравнении с другими комбинациями метформина и ССП (иные ингибиторы ДПП-4 + метфомин, ПСМ + метформин, тиазолидиндионы + метформин) [45]. Исследование продемонстрировало преимущество вилдаглиптина в комбинации с метформином в реальной клинической практике перед другими схемами ССТ в снижении как HbA1c, так и уровней глюкозы плазмы натощак. В частности, через 6 мес наблюдения динамика среднего уровня HbA1c в группах Галвус + метформин и фиксированной комбинации Галвус Мет составила -0,9%, а в группе сравнения -0,6% (р<0,0001) [47]. Полученные в результате заполнения пациентами и врачами вопросников данные свидетельствуют о том, что большое количество принимаемых таблеток снижает комплаентность пациентов и неминуемо сказывается на результатах лечения. Назначение фиксированных комбинаций препаратов является лучшим вариантом снижения таких рисков.
Подводя итог, можно с полным основанием утверждать, что на сегодняшний день ингибиторы ДПП-4 представляют собой одну из наиболее перспективных групп ССП и обладают всеобъемлющей доказательной базой как по данным рандомизированных клинических исследований, так и исследований в реальной клинической практике. Препараты этой группы, воздействуя на большинство патофизиологических звеньев прогрессирования СД 2 типа и отличаясь высоким уровнем эффективности и безопасности, являются оптимальной терапевтической опцией при многих клинических состояниях у пациентов с этим заболеванием. Однако всегда следует помнить, что только максимальная индивидуализация гликемического контроля и многофакторность подхода позволяет достичь долгосрочных успехов в терапии СД.



