За последние три десятилетия число больных сахарным диабетом (СД) в мире увеличилось более чем вдвое, что сделало его одной из важнейших проблем здравоохранения практически во всех странах [1]. По последним данным Международной федерации диабета (International Diabetes Federation) с начала XXI в. распространенность СД в возрастной группе 20–79 лет выросла со 151 млн до 463 млн человек. Более того, по прогнозам экспертов, уже к 2030 г. ожидается увеличение числа больных до 578 млн, большинство из которых, как и в настоящее время, составят пациенты с СД 2 типа [2].
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти и инвалидности среди людей с СД 2 типа [3]. На их долю приходится от трети до половины всех случаев летальных исходов, связанных с СД [4]. Учитывая клиническое бремя, которое несут осложнения ССЗ для пациентов с СД 2 типа, повышенное внимание уделяется совместному ведению этих заболеваний. То есть целью лечения СД 2 типа должно быть не только достижение гликемического контроля, но и предупреждение заболеваемости и смертности, связанных с кардиоваскулярными заболеваниями [4, 5].
Проведенные в последнее десятилетие метаанализы показали, что современные гипогликемические препараты, наряду с антигипергликемическим действием, оказывают положительный эффект в отношении функций органов кардиоренометаболической системы. К таким препаратам относят ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) и агонисты рецепторов глюкагоноподобного пептида 1 типа (аГПП-1) [6, 7].
Инновационные методы лечения способны помочь в повседневной клинической практике персонализировать терапевтический подход к пациенту, уменьшить и/или предотвратить частоту сердечно-сосудистых событий и замедлить развитие микро- и макрососудистых осложнений, которые являются основным фактором ранней заболеваемости и смертности у больных СД 2 типа.
ВЕДЕНИЕ ПАЦИЕНТА С САХАРНЫМ ДИАБЕТОМ 2 ТИПА: РОЛЬ ТЕРАПЕВТА
Ранее нарушение углеводного обмена зачастую остается не выявленным. По данным эпидемиологического исследования NATION, распространенность предиабета составила 19,3%, а диагноз СД 2 типа был установлен у 5,4% пациентов (ранее диагностированный – 2,5%, ранее не диагностированный – 2,9%) [8]. Лица с нарушенной толерантностью к глюкозе (НТГ) и/или нарушением глюкозы натощак (НГН) подвержены высокому риску не только развития СД, но и возникновения неблагоприятных сердечно-сосудистых событий [9].
Таким образом, специалисты первичного звена здравоохранения, врачи общей практики и терапевты должны быть осведомлены о необходимости внимательного отношения и регулярного мониторинга показателей углеводного обмена. Своевременное вмешательство оказывает наибольшее положительное влияние на контроль микро- и макрососудистых осложнений СД 2 типа. Это подтверждается результатами исследования UKPDS (United Kingdom Prospective Diabetes Study), которое продемонстрировало, что интенсивный гликемический контроль позволяет отсрочить развитие диабетических осложнений. Результаты UKPDS свидетельствуют о необходимости как можно более интенсивного ведения пациентов с СД 2 типа и сопутствующей сердечно-сосудистой патологией [10, 11].
Повышенный риск ССЗ при СД имеет многофакторную этиологию, и для минимизации риска поздних осложнений диабета важное значение, наряду с сахароснижающей терапией, имеет ранняя коррекция кардиоваскулярных факторов риска, включая артериальную гипертензию (АГ), дислипидемию, ожирение [12, 13].
В исследовании Steno-2 (интенсивное многофакторное вмешательство у пациентов с СД 2 типа и микроальбуминурией) было показано, что усиленный многофакторный подход имел устойчивые положительные эффекты в отношении сосудистых осложнений. Так, у больных, первоначально отнесенных к группе интенсивного лечения, смертность от всех причин снизилась на 20%, а от ССЗ – на 13% по сравнению с пациентами, получавшими стандартную терапию. Целевые показатели гликированного гемоглобина (HbA1c), систолического и диастолического артериального давления (АД), а также показатели общего холестерина, липопротеинов низкой плотности (ЛПНП) и триглицеридов также были ниже в группе интенсивного лечения [12].
Следовательно, лечение СД и его осложнений требует комплексного кардиометаболического подхода с активным вовлечением не только эндокринологов, но и кардиологов, терапевтов.
СОВРЕМЕННАЯ ФАРМАКОТЕРАПИЯ САХАРНОГО ДИАБЕТА 2 ТИПА
 Основное внимание при лечении СД 2 типа традиционно уделялось контролю гликемии, но сейчас важность многофакторного лечения подчеркивается в руководствах Американской диабетической ассоциации (ADA)/Европейской ассоциации по изучению сахарного диабета (EASD). Этот подход подразумевает коррекцию различных факторов риска ССЗ, включая гипергликемию, образ жизни, АГ и дислипидемию [13, 14].
Основное внимание при лечении СД 2 типа традиционно уделялось контролю гликемии, но сейчас важность многофакторного лечения подчеркивается в руководствах Американской диабетической ассоциации (ADA)/Европейской ассоциации по изучению сахарного диабета (EASD). Этот подход подразумевает коррекцию различных факторов риска ССЗ, включая гипергликемию, образ жизни, АГ и дислипидемию [13, 14].
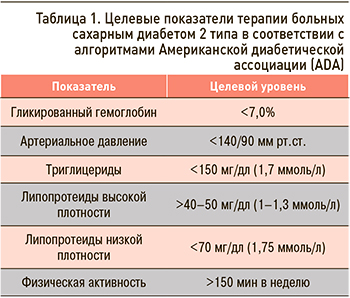
Текущие рекомендации предлагают целевой уровень HbA1c ≤6,5% (Американская ассоциация клинических эндокринологов, AACE) или <7,0% (ADA) для пациентов с коротким стажем СД, отсутствием значительных ССЗ и низким риском гипогликемии. Однако все руководства подчеркивают важность индивидуализации целей в зависимости от возраста, сопутствующих заболеваний и риска гипогликемии [13, 15, 16]. В таблице 1 представлены рекомендации ADA (2020) относительно целевых значений HbA1c, АД, метаболического профиля [13].
Согласно алгоритмам ведения СД 2 типа, у каждого пациента предполагается интенсификация терапии или изменение тактики лечения каждые 2–3 мес при отсутствии достижения индивидуальных целей гликемии [15]. Хотя контроль гликемии и связан со снижением риска микрососудистых осложнений, преимущества строгого контроля глюкозы в отношении макрососудистых осложнений сомнительны, особенно у лиц преклонного возраста и с длительным стажем диабета. Полученные результаты исследований ADVANCE, VADT и ACCORD предостерегают врачей от излишне агрессивного достижения целевых показателей и говорят о необходимости более плавного достижения поставленных целей [16–18].
Исследования EMPA-REG OUTCOME (эмпаглифлозин) и LEADER (лираглутид), завершившиеся в 2015 г., ознаменовали новую эру в лечения СД 2 типа, поскольку впервые продемонстрировали достоверную динамику снижения комбинированной первичной конечной точки 3Р-МАСЕ (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт) [19, 20]. В частности, в EMPA-REG OUTCOME было показано снижение 3Р-МАСЕ на 14%, а госпитализаций по поводу хронической сердечной недостаточности (ХСН) – на 38% [19]. В свою очередь, в исследовании DECLARE-TIMI 58 (дапаглифлозин) было достигнуто уменьшение частоты госпитализаций по поводу ХСН на 17%, однако не было выявлено статистически значимого в снижения 3Р-МАСЕ, так же, как и в исследовании эртуглифлозина (VERTIS) [21, 23]. Добавим, что успешные результаты в плане уменьшения риска госпитализации по поводу ХСН были недавно подтверждены еще в ряде рандомизированных клинических исследований (РКИ) препаратов из группы иНГЛТ2. Так, в исследованиях Emperor-redused (эмпаглифлозин) и DAPA-HF (дапаглифлозин) снижение этого показателя (первичная конечная точка) составило 25 и 26% соответственно [23, 24].
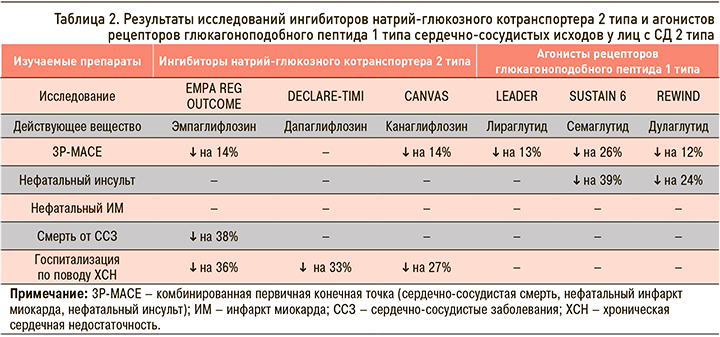
Что касается представителей класса аГПП-1, то среди них значительную частоту снижения комбинированных конечных точек 3Р-МАСЕ показали (табл. 2):
- лираглутид (исследование LEADER) – на 13% (95% доверительный интервал: 3–22%; p=0,01) [20];
- дулаглутид (исследование REWIND) – на 12% (95% доверительный интервал: 1–21%; р=0,0006) [25];
- семаглутид (SUSTAIN 6) – на 26% (95% доверительный интервал: 5–42%; p=0,02) [26].
Таким образом, терапия СД 2 типа препаратами класса иНГЛТ-2 преимущественно направлена на профилактику и лечение ХСН, тогда как аГПП-1 являются предпочтительными средствами для пациентов с высоким риском развития больших сердечно-сосудистых событий [15].
На основании проведенных исследований Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) ратифицировало новое показание к применению для препаратов этих групп. Пациентам с СД 2 типа для снижения 3Р-MACE, госпитализаций по поводу ХСН, снижения риска сердечно-сосудистой смерти или прогрессировании ХБП назначение иНГЛТ-2 и аГПП1 должно быть рассмотрено независимо от исходного уровня HbA1c или индивидуальной цели HbA1c [27].
СТРУКТУРА И МЕХАНИЗМЫ ДЕЙСТВИЯ АГОНИСТОВ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА 1
АГПП-1 – относительно новый класс инъекционных сахароснижающих препаратов, которые обладают эффективностью в отношении гликемического контроля, снижения массы тела и характеризуются низким риском гипогликемии [28].
Человеческий глюкагоноподобный пептид-1 (ГПП-1) представляет собой инкретиновый гормон, вырабатываемый L-клетками тонкого кишечника в ответ на прием пищи [28]. АГПП-1 стимулируют глюкозозависимую секрецию инсулина, подавляют повышенный уровень глюкагона, индуцируют пролиферацию β-клеток и оказывают антиапоптотическое действие на эти клетки [29, 30]. Также они обладают различными негликемическими эффектами, включая задержку опорожнения желудка и подавление аппетита, тем самым способствуя снижению массы тела [31].
Таким образом, терапия аГПП-1 нацелена на максимальное количество звеньев патогенеза СД 2 типа.
В зависимости от структуры различают человеческие аГПП-1 (дулаглутид, семаглутид, лираглутид, албиглутид) и препараты на основе эксендина (эксенатид, ликсенатид). АГПП-1 длительного действия (альбиглутид, дулаглутид, лираглутид, семаглутид и эксенатид пролонгированного действия) в большей степени влияют на уровень HbA1c и глюкозу в крови натощак, препараты короткого действия (экзенатид и ликсисенатид) – на поспрандиальную гликемию [32, 33]. На сегодняшний день из всех представленных молекул приоритетное место в терапии СД 2 отводится человеческим и пролонгированным формам аГПП-1 [33].
АГПП-1 существенно различаются не только по продолжительности действия и структуре молекул, но и по гомологии с эндогенным ГПП-1, химическим и физиологическим свойствам и сродству к рецептору ГПП-1 [34, 35].
Одним из аГПП-1 длительного действия является семаглутид, доказавший свою безопасность и эффективность в плане снижения HbA1c, достижения целевых показателей гликемии и снижения массы тела [34]. Семаглутид имеет высокую степень гомологии (94%) с нативным ГПП-1 и три ключевые структурные модификации, которые замедляют ферментативную деградацию пептида ферментом дипептидилпептидазой и обеспечивают прочное связывание препарата с альбумином (семаглутид имеет сродство к альбумину в 5,6 раза выше по сравнению с лираглутидом, который имеет более короткую дикислотную цепь) [34]. Все механизмы модификации лежат в основе продолжительного действия препарата и позволяют вводить его подкожно всего 1 раз в неделю: период полужизни семаглутида в организме составляет 6–7 дней [35, 36].
ИССЛЕДОВАТЕЛЬСКАЯ ПРОГРАММА SUSTAIN
Доказательная база эффективности и безопасности инъекционной формы семаглутида (в дозах 0,5 и 1 мг в неделю) была изучена в серии клинических исследовании SUSTAIN (Semaglutide Unabated Sustainability in Treatment of Type 2 Diabetes), которая включила 10 РКИ 3-й фазы [26, 37–41, 42–45]. В них семаглутид сравнивали с плацебо (в качестве монотерапии или в качестве дополнения к базальному инсулину), ситаглиптином, эксенатидом, инсулином гларгин, дулаглутидом, лираглутидом и препаратами из группы иНГЛТ 2 типа. В исследованиях принимали участие более 9000 пациентов, период наблюдения составил от 30 до 104 нед [26, 37–41, 42–45].
Критерии включения и исключения были одинаковыми для большинства исследований SUSTAIN. Все участники были старше 18 лет и страдали СД 2 типа. Исходный уровень HbA1c составлял от 7,0 до 10,5% [37–41, 42–45]. В качестве первичной конечной точки в исследованиях SUSTAIN 1–5 и 7–10 выбрано изменение HbA 1c по сравнению с исходным уровнем, помимо этого, оценивалось достижение целевых уровней HbA1c, изменение глюкозы натощак и постпрандиальной гликемии [37–41, 42–45].
Исследования продемонстрировали значительное снижение среднего уровня HbA1с в группе семаглутида (рис.). По сравнению с исходным уровнем этот показатель варьировал от –1,2 до –1,5% при использовании дозы 0,5 мг и от –1,5 до –1,8% при применении 1,0 мг (p <0,0001). Целевой уровень HbA1с ≤6,5% был достигнут у 66,7% больных в группе семаглутида, тогда как группе плацебо этот показатель составил лишь 13,2%, а в группе в группе активного сравнения – до 47,2%. При этом 74,3% пациентов в группе семаглутида достигли комбинированной конечной точки (HbA1с <7,0%) без тяжелой гипогликемии и набора веса.
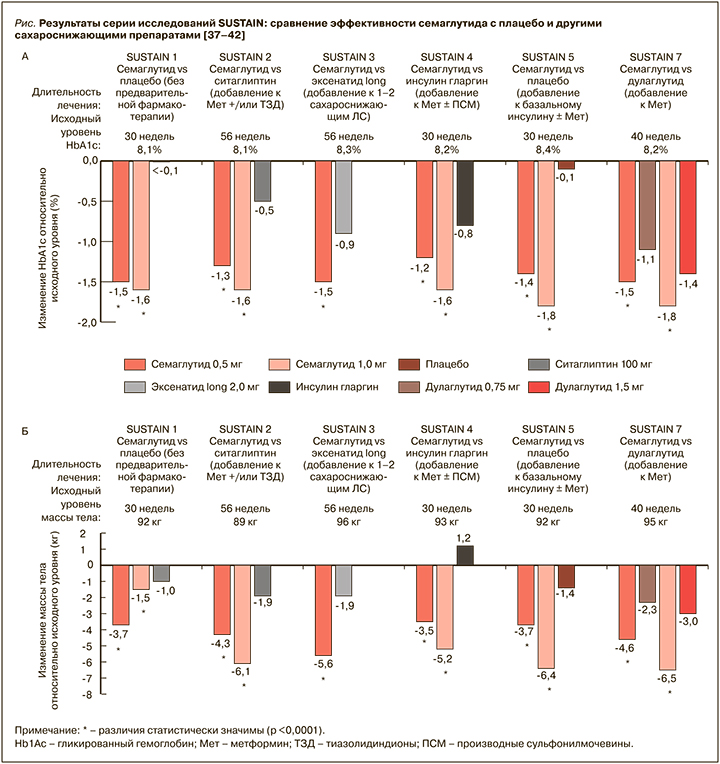
При использовании семаглутида 1,0 мг также было продемонстрировано значительное снижение уровня глюкозы в плазме натощак относительно всех препаратов сравнения к концу лечения (p ≤0,0005). Аналогичные результаты были получены в исследованиях SUSTAIN 1, 2 и 5 при применении препарата в дозе 0,5 мг (p ≤0,0002) [37–41, 42–45].
Во всех исследованиях программы SUSTAIN семаглутид в дозах 0,5 и 1,0 мг приводил к значимому снижению массы тела по сравнению со всеми группами сравнения (p <0,0001) (см. рис.). Снижение веса, по сравнению с исходным уровнем, варьировалось от 3,5 до 4,6 кг при использовании дозы 0,5 мг и от 4,5 до 6,5 кг на дозе 1,0 мг. 26,7% больных в обеих группах семаглутида достигли потери веса ≥10% по сравнению с 3,0% в группе плацебо (p ≤0,05) и до 7,7% по сравнению с другими сахароснижающими препаратами (p ≤0,0002).
АГПП-1 и иНГЛТ-2 в настоящее время являются наиболее действенными и при этом безопасными сахароснижающими препаратами по своему влиянию на сердечно-сосудистый прогноз [6]. Поэтому особый интерес на сегодняшний день представляют 5 систематических обзоров SUSTAIN (3, 7, 8 и 9, 10), в которых сравнивались препараты этих групп [39, 42–45].
В метаанализе SUSTAIN 3, 7 и 10 семаглутид сравнивался с другими представителями аГПП- 1 – дулаглутидом, лираглутидом и эксенатидом длительного действия [39, 42, 45]. В SUSTAIN 7 наблюдалось более выраженное снижение HbA1с на обеих дозах семаглутида по сравнению с максимальной дозой дулаглутида. Среднее снижение массы тела в группе больных, получавших семаглутид в дозе 1 мг, составило до 6,5 и 5,8 кг против 3 кг в группе дулаглутида (p <0,0001) и 1,9 кг в группе лираглутида (p <0,0001) [42].
В четвертом обзоре семаглутид 1,0 мг сравнивался с иНГЛТ-2 канаглифлозином в максимальной терапевтической дозе 300 мг. Как показали результаты, в группе семаглутида наблюдалось преимущество в плане снижения HbA1с относительно общего исходного среднего значения и уменьшения массы тела (р <00001; р=0,0029) [43].
Наконец, в исследовании SUSTAIN 9 оценивался синергетический эффект препаратов этих групп. Добавление семаглутида к терапии иНГЛТ 2 типа приводило к клинически значимому улучшению гликемического контроля и снижению массы тела в среднем на 3,81 кг по сравнению с плацебо. Доля пациентов, достигших целевых значений HbA1c <7,0 и <6,5% на фоне такой терапии, составила 78,7 и 66,7% по сравнению с 24,8 и 13,2 % в группе плацебо (p <0,0001) [44].
Таким образом, в низких и высоких дозах семаглутид превосходил все группы сравнения в улучшении гликемического контроля и уменьшении веса, что позволило значительно большему количеству пациентов с СД 2 типа достичь более выраженного и статистически значимого снижения HbA1c и массы тела.
Данные исследования SUSTAIN 6 (n=3297; период наблюдения 104 нед) продемонстрировали кардиоваскулярную безопасность семаглутида у больных СД 2 типа с высоким риском развития сердечно-сосудистых событий [42]. В это исследование включались пациенты старше 50 лет с установленным ССЗ, ХСН или ХБП не менее 3 стадии или больные лица старше 60 лет с хотя бы одним фактором риска ССЗ [42].
Первичной конечной точкой SUSTAIN 6 стало время до первого случая МАСЕ: смертельного исхода по причине сердечно-сосудистой патологии, инфаркта миокарда или инсульта без смертельного исхода. Подтверждающей вторичной конечной точкой служили композитный сердечно-сосудистый исход (смерть от сердечно-сосудистых причин, нефатальный инфаркт миокард, нефатальный инсульт, коронарная или периферическая реваскуляризация и госпитализация по поводу нестабильной стенокардии или сердечной недостаточности); развитие первого эпизода в период с начала исследования до 104-й недели отдельных компонентов комбинированного исхода; осложнения диабетической нефропатии и ретинопатии; изменение массы тела и уровня HbA1c через 104 нед относительно исходных значений [26].
Исходы MACE наблюдались у 108 из 1648 пациентов (6,6%) в группе семаглутида и у 146 из 1659 (8,9%) в группе плацебо. Несмертельный инфаркт миокарда произошел у 47 пациентов в группе семаглутида (2,9%) против 64 (3,9%) случаев в группе плацебо. Статистически значимая разница наблюдалась в отношении нефатального инсульта: 27 пациентов (1,6%) в группе семаглутида против 44 (2,7%) в группе плацебо. Показатели смертности от сердечно-сосудистых причин были одинаковыми в двух группах.
Также исследование SUSTAIN 6 продемонстрировало, что для предупреждения 1 события первичной конечной точки необходимо пролечить 45 человек. У пациентов, применявших семаглутид, риск первичного комбинированного исхода смерти от кардиоваскулярных причин, нефатального инфаркта миокарда или нефатального инсульта был на 26% ниже, чем у пациентов, получавших плацебо. Такой результат обусловлен в первую очередь низким риском развития нефатального инсульта (39%) и незначительным снижением риска развития нефатального инфаркта миокарда (26%), поскольку различий в отношении сердечно-сосудистой смерти не наблюдалось [26].
На фоне применения семаглутида наблюдалось улучшение прогноза в отношении нефропатии, а именно значимое снижение конечной комбинированной почечной точки (развитие макроальбуминурии, удвоение креатинина, инициация заместительной почечной терапии или почечная смерть) на 36% (95% доверительный интервал: 12–54%; р=0,005). Наиболее выраженным был эффект препарата в отношении развития макроальбуминурии (р=0,005) [26].
Данные исследования SUSTAIN 6 стали основанием для регистрации нового показания к назначению инъекционной формы семаглутида – снижения риска развития больших сердечно-сосудистых событий у пациентов с СД 2 типа и высоким сердечно-сосудистым риском в качестве дополнительной терапии ССЗ [27].
НЕБЛАГОПРИЯТНЫЕ И СЕРЬЕЗНЫЕ НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ АГОНИСТОВ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА 1
Наиболее частые побочные эффекты аГПП- 1 – преходящие, от легкой до умеренной степени тяжести желудочно-кишечные проявления, в частности тошнота, рвота и диарея. Нежелательные явления в группах семаглутида была сопоставима с таковой в группе эксенатида и лираглутида [39, 45]. Побочные реакции, которые привели к преждевременному прекращению лечения, были зарегистрированы у 9,4% пациентов, получавших семаглутид, и у 7,2% пациентов, получавших эксенатид [39]. При этом из-за нежелательных явлений со стороны ЖКТ прекратили лечение 5,7% пациентов, получавших семаглутид, против 2,7% пациентов, применявших эксенатид [39].
Для уменьшения риска развития нежелательных эффектов со стороны ЖКТ необходима постепенная титрация дозы семаглутида. Лечение начинают с дозировки 0,25 мг подкожно 1 раз в неделю в течение не менее 4 нед с последующим ее увеличением дозы до 0,5 мг 1 раз в неделю. Для дальнейшего улучшения гликемического контроля после 4 нед применения семаглутида в режиме 0,5 мг 1 раз в неделю дозу можно увеличить до 1 мг 1 раз в неделю [46].
Препараты класса аГПП-1, в частности семаглутид, отличает низкий риск развития гипогликемии. Частота ее развития (<3,1 ммоль/л) на фоне применении семаглутида не отличалась от таковой в группах плацебо (исследования SUSTAIN 1, 5, 6, 9), эксенатида (SUSTAIN 3), ситаглиптина (SUSTAIN 2), дулаглутида (SUSTAIN 7) и канаглифлозина (SUSTAIN 8) [26, 37–39, 41, 42–45]. В исследовании SUSTAIN 4 тяжелые и подтвержденные гипогликемии в группе семаглутида наблюдались реже, чем в группе инсулина гларгин [40]. Следует отметить, что в группах семаглутила и инсулина гларгин большинство эпизодов гипогликемии отмечалось у больных, одновременно принимавших препараты сульфонилмочевины [40].
Вместе тем применение семаглутида в метаанализе SUSTAIN 6 было ассоциировано с более высоким риском развития осложнений диабетической ретинопатии по сравнению с плацебо: она была выявлена у 50 пациентов, получавших этот аГПП-1 (3,0%), и у 29 (1,8%) – в группе плацебо (отношение рисков 1,76; 95% доверительный интервал: 1,11–2,78; p=0,02) [42]. Что касается лечения ретинопатии, то фотокоагуляция потребовалась 38 больным, применявшим семаглутид, и 20, получавшим плацебо, терапия интравитреальными препаратами – 16 и 13 пациентам соответственно. В то же время не наблюдалось статистически значимой разницы в развитии осложнений диабетической ретинопатии при использовании семаглутида по сравнению с плацебо у пациентов без ретинопатии на исходном уровне [26].
ЗАКЛЮЧЕНИЕ
Лечение пациентов с ССЗ и СД 2 типа ставит перед врачом ряд целей, неразрывно связанных между собой: это контроль гликемии, липидов крови, АД, нефропротекция, снижение риска больших сердечно-сосудистых событий. Появление препаратов аГПП-1 стало важным событием не только для эндокринологов, но и в равной степени для терапевтов. В качестве первой линии сахароснижающей терапии семаглутид следует рассматривать у пациентов с СД 2 типа и высоким сердечно-сосудистым риском. Такие пациенты будут иметь максимальную пользу от лечения семаглутидом за счет единого кардиометаболического терапевтического подхода: долгосрочного, стойкого контроля гликемии, снижения массы тела, первичной и вторичной профилактики больших сердечно-сосудистых событий.
Если пациент с высоким сердечно-сосудистым риском уже получает антигипергликемическую терапию, то с учетом результатов исследований SUSTAIN и стандартов оказания медицинской помощи пациентам с СД ADA-2020 необходимо рассмотреть приоритетное включение семаглутида в состав комбинированной сахароснижающей терапии вне зависимости от исходного уровня HbAc1 и сопутствующего лечения.
Важную роль в изменении парадигмы терапии пациентов с высоким сердечно-сосудистым риском и СД 2 типа играет обучение и регулярное информировании о свойствах препаратов врачей всех заинтересованных специальностей, особенно терапевтов, поскольку именно к ним, в отличие от кардиологов и эндокринологов, пациенты обращаются на более ранней стадии заболевания.
ССЗ остаются ведущей причиной смерти больных СД 2 типа. Это послужило основанием для разработки принципиально новых подходов к терапии, в основе которых лежит четкое понимание того, что пациенты с высоким сердечно-сосудистым риском и СД 2 типа должны получать препараты, оказывающие многофакторное влияние: снижающие риск развития больших сердечно-сосудистых событий, обеспечивающие стойкий гликемический контроль и клинически значимое снижение массы тела.
Результаты исследовательской программы семаглутида SUSTAIN отражены в обновленных клинических рекомендациях, в которых назначение аГПП-1 с целью снижения риска развития сердечно-сосудистых осложнений рекомендуется пациентам, имеющим высокий/очень высокий риск развития атеросклеротических ССЗ вне зависимости от уровня HbAc1 и сопутствующей терапии. Современная терапия СД 2 типа требует кардиометаболического подхода и активного вовлечения в лечебный процесс не только эндокринологов, но и терапевтов, которые повседневно встречаются с указанной категорией коморбидных пациентов.



