Распространенность сахарного диабета (СД) неуклонно растет во всем мире, значительно превышая прогнозы Всемирной организации здравоохранения (ВОЗ). Так, по данным экспертов ВОЗ, к 2025 г. в мире будет проживать около 300 млн человек с диагнозом СД. Однако уже в 2015 г., по данным Международной федерации диабета, число заболевших СД в мире составило 415 млн. Ожидается, что к 2035 г. этот показатель увеличится до 592 млн человек [1]. Подавляющее большинство пациентов страдают СД 2 типа. Данные о распространенности СД 2 типа, полученные в исследовании NATION (первое национальное эпидемиологическое кросс-секционное исследование, проведенное на территории Российской Федерации с сентября 2013 г. по февраль 2015 г.), дают основание полагать, что среди взрослого населения России в возрасте 20–79 лет около 5,9 млн человек больны СД 2 типа. Результаты исследования NATION также указывают на то, что значительное число случаев СД 2 типа (~54%) в России не диагностированы [2]. Таким образом, РФ занимает пятое место среди десяти стран с наибольшей популяцией, страдающей СД. На сегодняшний день отмечается тенденция не только к увеличению заболеваемости СД 2 типа, но и развитие данной патологии в более молодом возрасте, что связано с урбанизацией территории, увеличением распространенности ожирения и малоподвижного образа жизни. Все большей проблемой становится ранняя инвалидизация пациентов с СД 2 типа из-за развития поздних микрососудистых осложнений. Одним из актуальных направлений в современной медицине является разработка методов профилактики и лечения осложнений СД 2 типа.
Согласно данным ВОЗ, существует несколько типов дислипидемий (ДЛП) (табл. 1). Типы IIa, IIb и III являются атерогенными, в то время как I, IV и V типы чаще встречаются у лиц с СД 2 типом и метаболическим синдромом (МС) и поэтому считаются относительно атерогенными. Изолированная гипертриглицеридемия (ГТГ) составляет примерно 45% от всей популяции с ДЛП.
 Для СД 2 типа и МС более характерна ГТГ (IV тип), которая также сочетается с низким уровнем липопротеидов высокой плотности (ЛПВП) и преобладанием частиц липопротеидов низкой плотности (ЛПНП). В сочетании с такими факторами риска, как инсулинорезистентность, гипергликемия, артериальная гипертензия и абдоминальное ожирение, ДЛП способствует патологическим изменениям в микроциркуляторном русле, вызывая осложнения, типичные для СД, – диабетическая ретинопатия, нейропатия, поражение артерий нижних конечностей [3]. К рискам, которые вызваны ГТГ, относят инфаркты, инсульты и в целом смертность у пациентов с СД 2 типа. ГТГ – доказанный предиктор общей смертности у пациентов с СД 2 типа: высокий уровень триглицеридов повышает риск смерти на 65% в сравнении с нормальным уровнем [4]. ГТГ ассоциируется с сердечно-сосудистой смертностью: при уровне триглицеридов плазмы >133 мг/дл (>1,5 ммоль/л) относительный риск сердечно-сосудистой смертности возрастает примерно в 3 раза (p<0,001) [5]. При высоких уровнях триглицеридов риск инсульта повышается в 2 раза [6]. Целевой уровень триглицеридов для пациентов с СД 2 типа – 1,7 ммоль/л, что ниже, чем рекомендовано для общей популяции того же возраста и пола.
Для СД 2 типа и МС более характерна ГТГ (IV тип), которая также сочетается с низким уровнем липопротеидов высокой плотности (ЛПВП) и преобладанием частиц липопротеидов низкой плотности (ЛПНП). В сочетании с такими факторами риска, как инсулинорезистентность, гипергликемия, артериальная гипертензия и абдоминальное ожирение, ДЛП способствует патологическим изменениям в микроциркуляторном русле, вызывая осложнения, типичные для СД, – диабетическая ретинопатия, нейропатия, поражение артерий нижних конечностей [3]. К рискам, которые вызваны ГТГ, относят инфаркты, инсульты и в целом смертность у пациентов с СД 2 типа. ГТГ – доказанный предиктор общей смертности у пациентов с СД 2 типа: высокий уровень триглицеридов повышает риск смерти на 65% в сравнении с нормальным уровнем [4]. ГТГ ассоциируется с сердечно-сосудистой смертностью: при уровне триглицеридов плазмы >133 мг/дл (>1,5 ммоль/л) относительный риск сердечно-сосудистой смертности возрастает примерно в 3 раза (p<0,001) [5]. При высоких уровнях триглицеридов риск инсульта повышается в 2 раза [6]. Целевой уровень триглицеридов для пациентов с СД 2 типа – 1,7 ммоль/л, что ниже, чем рекомендовано для общей популяции того же возраста и пола.
Рекомендации по лечению ДЛП на сегодняшний момент выделяют дериваты фиброевой кислоты (фибраты) в качестве препаратов первого выбора для пациентов с ГТГ. Фибраты применяют в клинической практике более 60 лет. Они преимущественно снижают уровень триглицеридов, умеренно повышают уровень ЛПВП и обладают рядом плейотропных эффектов. Фибраты влияют на активацию ядерных рецепторов РPАR α (альфа-рецепторы, активация которых ведет к пролиферации пероксисом – органелл, вырабатывающих ферменты, усиливающие активность липопротеинлипазы). В Российской Федерации зарегистрированы два препарата из класса фибратов: фенофибрат (Трайкор) и ципрофибрат (табл. 2) [3].
Фибраты снижают концентрацию триглицеридов, повышают уровень ЛПВП и умеренно снижают ЛПНП. Фибраты назначают, главным образом, при ДЛП IIb, IV, V типов в сочетании с низким уровнем ЛПВП у пациентов с МС, СД 2 типа, семейной комбинированной гиперлипидемией и семейной эндогенной ГТГ. Фибраты влияют на состав частиц ЛПНП, переводя их из мелких и плотных в более крупные и менее атерогенные частицы ЛПНП. Кроме того, фибраты снижают активность белка, переносящего эфиры холестерина (ХС), что сопровождается повышением уровня ЛПВП. Фибраты стимулируют обратный транспорт ХС и повышают синтез желчных кислот в печени. Фибраты третьей генерации (фено- и ципрофибрат) не повышают литогенность желчи. Фенофибрат (Трайкор) снижает триглицериды на 55%, увеличивает ЛПВП на 30% и в меньшей степени влияет на ЛПНП и общий ХС.
 В крупном открытом 6-месячном исследовании, проведенном в Бельгии на большом контингенте (1148 пациентов с ДЛП), было показано, что лечение фенофибратом приводит в среднем к снижению уровня ЛПНП на 24,4%, триглицеридов на 36,6% и повышению среднего уровня ЛПВП на 15,2% [29]. Сходные результаты были получены в Германии в программе мониторинга 12-недельного применения фенофибрата врачами общей практики у 9884 пациентов [30]. Это исследование, проведенное на таком большом количестве больных с различными ДЛП, позволило прийти к заключению, что чем больше отклонение от нормы каждого показателя, тем более выражен эффект нормализующего воздействия фенофибрата. Снижение ЛПНП составляло 22–23%, уровень триглицеридов снижался в среднем на 30% при одновременном повышении ЛПВП на 24–25%. Фенофибрат переносился хорошо, нежелательные побочные эффекты были выявлены у 3,8% пациентов, и только в 0,4% они носили характер серьезных. Поскольку снижение ЛПВП имеет самостоятельное атерогенное значение, было проведено специальное исследование, в котором на 7098 пациентах с ДЛП было доказано повышающее уровень ЛПВП действие фенофибрата в зависимости от исходного значения ЛПВП [31]. Степень повышения ЛПВП была максимальной – на 90,2% при очень низком исходном уровне ЛПВП <0,65 ммоль/л (n=254). В когорте лиц с уровнем ЛПВП <0,90 ммоль/л (n=2078) степень повышения ЛПВП составила 44,39%, при уровне ЛПВП <1,03 ммоль/л (n=3535) его повышение составило 36,1%.
В крупном открытом 6-месячном исследовании, проведенном в Бельгии на большом контингенте (1148 пациентов с ДЛП), было показано, что лечение фенофибратом приводит в среднем к снижению уровня ЛПНП на 24,4%, триглицеридов на 36,6% и повышению среднего уровня ЛПВП на 15,2% [29]. Сходные результаты были получены в Германии в программе мониторинга 12-недельного применения фенофибрата врачами общей практики у 9884 пациентов [30]. Это исследование, проведенное на таком большом количестве больных с различными ДЛП, позволило прийти к заключению, что чем больше отклонение от нормы каждого показателя, тем более выражен эффект нормализующего воздействия фенофибрата. Снижение ЛПНП составляло 22–23%, уровень триглицеридов снижался в среднем на 30% при одновременном повышении ЛПВП на 24–25%. Фенофибрат переносился хорошо, нежелательные побочные эффекты были выявлены у 3,8% пациентов, и только в 0,4% они носили характер серьезных. Поскольку снижение ЛПВП имеет самостоятельное атерогенное значение, было проведено специальное исследование, в котором на 7098 пациентах с ДЛП было доказано повышающее уровень ЛПВП действие фенофибрата в зависимости от исходного значения ЛПВП [31]. Степень повышения ЛПВП была максимальной – на 90,2% при очень низком исходном уровне ЛПВП <0,65 ммоль/л (n=254). В когорте лиц с уровнем ЛПВП <0,90 ммоль/л (n=2078) степень повышения ЛПВП составила 44,39%, при уровне ЛПВП <1,03 ммоль/л (n=3535) его повышение составило 36,1%.
Статины относятся к другому классу гиполипидемических лекарственных средств, имеют выраженное действие на ЛПНП, но уровень триглицеридов снижают в среднем на 15–20%, а уровень ЛПВП повышают на 6–10% [3]. Фенофибрат (Трайкор) можно комбинировать с симва-, аторва-, флува- и розувастатином [3], которые являются стандартом многофакторного управления СД 2 типа, однако сохраняют достаточно большой резидуальный риск сосудистых катастроф. Поэтому в ситуации изолированной ГТГ использование фенофибрата более обосновано. В то же время пациенты со смешанной ДЛП должны получать статины, которые можно идеально комбинировать с фенофибратом в случае недостигнутых целевых показателей триглицеридов и ЛПВП.
 В рандомизированных проспективных плацебо-контролируемых программах по первичной и вторичной профилактике сердечно-сосудистых заболеваний с использованием фибратов новых поколений, в частности препарата Трайкор, было показано, что при положительных воздействиях на уровень в плазме крови липидных и аполипопротеиновых показателей спектра липопротеидов, на клинические эпизоды ИБС и на ангиографические проявления коронарного атеросклероза применение фенофибрата не вызывает нежелательных явлений, ранее показанных для фибрата первого поколения – клофибрата [32–36].
В рандомизированных проспективных плацебо-контролируемых программах по первичной и вторичной профилактике сердечно-сосудистых заболеваний с использованием фибратов новых поколений, в частности препарата Трайкор, было показано, что при положительных воздействиях на уровень в плазме крови липидных и аполипопротеиновых показателей спектра липопротеидов, на клинические эпизоды ИБС и на ангиографические проявления коронарного атеросклероза применение фенофибрата не вызывает нежелательных явлений, ранее показанных для фибрата первого поколения – клофибрата [32–36].
В исследовании ACCORD (The Action to Control Cardiovascular Risk in Diabetes), продолжавшегося более 5 лет, было показано, что добавление фенофибрата к статинам дополнительно снижает риск сердечно-сосудистых осложнений у пациентов с СД 2 типа на 31%, но не увеличивает риски побочных событий. В самом крупном исследовании с фибратами FIELD (Fenofibrate Intervention and Event Lowering in Diabetes), в котором изучалась эффективность как первичной, так и вторичной профилактики сердечно-сосудистых событий в популяции из 9795 пациентов с СД 2 типа, не имевших показаний для назначения гиполипидемической терапии, были получены следующие результаты: риск достижения первичной конечной точки, включавшей смерть от ИБС или нефатальный инфаркт, снизился на 19%. При последующем субанализе в группе пациентов с повышенными триглицеридами и сниженными ЛПВП фенофибрат (Трайкор) достоверно снизил частоту сердечно-сосудистых событий на 27%.
Распространенность диабетической полиневропатии (ДПН) составляет до 80% всех пациентов с СД. Существует множество различных теорий, объясняющих причины и механизмы развития ДПН. В то же время основным установленным патогенетическим фактором возникновения ДПН является гипергликемия [7, 8]. Гипергликемия вызывает нейрональное повреждение вследствие внутриклеточного повышения уровня глюкозы с избыточным метаболизмом (с активацией полиолового пути утилизации глюкозы под действием альдоредуктазы) и накоплением токсических продуктов (сорбитол, фруктоза), повышением внутриклеточного осмотического давления, отеком нейронов. Отмечается, что гипергликемия с накоплением токсических метаболитов и конечных продуктов гликирования усиливает образование свободных радикалов с развитием «оксидативного стресса» и снижение уровня мио-инозитола, что также оказывает повреждающее действие на нейроны. В последние годы появились данные, свидетельствующие об участии системного хронического вялотекущего воспаления в развитии ДПН. Доказано, что воспалительные цитокины способны вызывать повреждение миелиновой оболочки и сенсибилизировать периферические рецепторы, вызывающие невропатическую боль [9]. Известно, что повышение экспрессии фактора некроза опухоли α (ФНО-α) приводит к токсическому поражению и демиелинизации олигодендроцитов. Кроме того, ФНО-α стимулирует секрецию интерлейкинов (ИЛ)-1β и ИЛ-6, а также других воспалительных факторов, что опосредованно усиливает его пагубное действие на периферические отделы нервной системы [10]. Кроме того, ФНО-α ингибирует активность синтазы оксида азота в эндотелиальных клетках, приводя к снижению NO-индуцированной вазодилатации. Это, в свою очередь, способствует экспрессии факторов роста и молекул клеточной адгезии, в результате чего развиваются эндотелиальная дисфункция и ряд патологических изменений эндоневрального микроваскуляторного русла, приводящих к нарушению трофики нервной ткани [11]. Так, L. Yu и соавт. (2009) обнаружили, что у пациентов с ДПН (n=60) уровень ФНО-α значительно выше, чем у больных СД без осложнений (n=28) (р<0,001) [12]. В исследовании J. Doupis и соавт. (2009) у пациентов с ДПН (n=77) отмечались более высокие уровни С-реактивного белка (СРБ) (P<0,0001), ФНО-α (P<0,05) и фибриногена (Р<0,05). А у пациентов с болевой формой невропатии (n=46) уровень СРБ (р<0,01) был выше по сравнению с группой пациентов, страдающих безболевой формой невропатии [13]. Papanas и соавт. в своей работе (2011) показали, что у пациентов с СД и ДПН (n=64) значительно выше концентрация мочевой кислоты (P<0,001) и СРБ по сравнению с пациентами с СД 2 типа без невропатии (n=66) [14]. В исследовании T. Purwata и соавт. (2011) уровень ФНО-α был достоверно выше в группе с болевой формой невропатии (n=59). Статистически значимые различия были зафиксированы даже внутри группы с болевой формой (средний уровень ФНО-α 15,24±5,42 пг/ мл у пациентов с умеренной болью против 20,44±10,34 у пациентов с сильной болью) [15]. С. Herder и соавт. (2013) определяли сывороточные концентрации медиаторов воспаления, неврологические жалобы и оценку по Мичиганской шкале неврологических симптомов у 1047 пациентов из Аусбурга в возрасте от 61 года до 82 лет. Уровни ИЛ-1, ИЛ-6 и ИЛ-18 положительно коррелировали с оценкой по Мичиганской шкале неврологических симптомов. Эта корреляция сохранялась даже с поправкой на окружность талии, гипертонию, липидный спектр, курение, употребление алкоголя, уровень физической активности, инфаркты и инсульты в анамнезе, употребление нестероидных противовоспалительных средств [16].

По данным исследования FIELD, симптомы ДПН отмечены у 564 из 9795 больных СД 2 типа, включенных в исследование. Фенофибрат (Трайкор) уменьшил частоту возникновения новых случаев ДПН на 18% по сравнению с контрольной группой. Показано обратное развитие уже выявленной ДПН на 40% в группе лечения Трайкором [17]. Таким образом, длительная терапия фенофибратом снижала невропатию в общем и увеличила случаи обратного развития уже существующей невропатии.
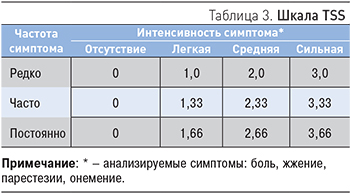
Для количественной оценки жалоб больных с ДПН используется шкала TSS (Total Symptom Score), которая включает четыре позитивных невропатических симптома: стреляющую боль, жжение, парестезии и онемение в стопах и/или голенях (табл. 3).
Для количественной оценки неврологического дефицита используется шкала NIS-LL (Neuropathy Impairment Score of Low Limbs), дающая достаточно объективное представление о степени тяжести поражения нервных волокон. Мышечная сила определяется с помощью сгибания и разгибания бедра, колена, голеностопа и пальцев стопы. В норме коэффициент мышечной силы – 0, снижение силы на 25% – 1, на 50% – 2, на 75% – 3, а коэффициент 4 – это уже паралич. Также по шкале NIS-LL оцениваются сухожильные рефлексы и степень снижения тактильной, болевой и вибрационной чувствительности (0 – в норме, 1 – снижены, 2 – отсутствуют). Очень важно оценивать сочетание показателей шкалы TSS и NIS-LL, имея в виду, что шкала TSS более плацебозависима.
В исследованиях по изучению эффектов фенофибрата при ДПН было показано улучшение состояния пациентов по шкалам NIS-LL и TSS (табл. 4).
ДПН может перерасти в синдром диабетической стопы и привести к ампутациям нижних конечностей. Каждые 24 ч совершается около 230 ампутаций по причине СД. Несмотря на строгие меры в отношении обратимых факторов, примерно одному из десяти пациентов с СД в итоге потребуется по меньшей мере одна ампутация. В исследовании UKPDS снижение гликированного гемоглобина на 0,9% с использованием интенсивного контроля глюкозы в течение 10 лет не снизило частоту ампутаций [18]. Контроль глюкозы в исследовании UKPDS в течение 20 лет также не влиял на частоту ампутаций [19]. Предотвратить риск ампутаций не удалось ни с помощью контроля артериального давления, ни путем снижения холестерина, что лишь подчеркивает важность оценки контроля других потенциальных факторов риска.
В исследовании FIELD оценивалось влияние препарата Трайкор на частоту ампутаций у пациентов с СД. По результатам исследования, показано снижение частоты малых нетравматических ампутаций на 46% по сравнению с плацебо (рисунок).
Воздействие терапии фенофибратом на риск ампутации может быть далеко от влияния на контроль уровня липидов, т.к. при многофакторных анализах ни один из показателей липидов не был связан с риском ампутации. Кроме того, в исследовании Heart Protection Study [20], в которое путем рандомизации были включены 5963 человека с СД, распределенных на группу, принимавшую симвастатин, и группу, принимавшую плацебо, не было продемонстрировало значительного различия в частоте ампутаций между группами, несмотря на значительное сокращение общего ХС, концентраций ЛПНП и небольшие изменения концентраций триглицеридов и ЛПВП в группе вмешательства по сравнению с группой контроля. Данный результат предполагает, что воздействие фенофибрата на снижение риска ампутаций скорее вызвано не влиянием данного препарата на концентрации липидов и в этой связи не зависит от разницы в использовании статинов между группами в исследовании FIELD.
Было предложено несколько теоретических моделей относительно положительного воздействия фенофибрата на микрососудистую систему. В рандомизированном плацебо-контролируемом исследовании 12-недельная терапия фенофибратом [21] сопровождалась улучшением эндотелийзависимой сосудистой реактивности, снижением уровня маркеров эндотелиальной дисфункции, а также провоспалительных маркеров, включающих ФНО-α, ИЛ-6 и ИЛ-1β в плазме; другое исследование также продемонстрировало, что терапия фенофибратом сопровождалась снижением вязкости крови [22]. У пациентов с ГТГ и различными признаками МС фенофибрат улучшал опосредованную гиперемией вазодилятацию, увеличивал концентрации адипонектина и улучшал чувствительность к инсулину [23]. Препарат может оказывать свое антиангиогенное воздействие напрямую [24] или путем снижения ишемии посредством данных воздействий [21–23]. Фенофибрат также активирует АМФ-киназу в эндотелиальных клетках через рецептор, активируемый пролифератором пероксисом, типа α, предотвращая апоптоз клеток сетчатки [25] и, возможно, увеличивая синтез NO [26]. Фенофибрат может также играть защитную роль в связи с подавлением окислительного стресса [27]. Сообщалось также, что фенофибрат оказывает нейропротективное действие на грызунов [28], что может быть особенно важно, если учесть ключевую роль невропатии в отношении риска ампутации.
По данным крупных исследований антиоксиданты, аспирин, статины, гипотензивные средства не смогли снизить частоту ампутаций у пациентов с СД. Таким образом, включение препарата Трайкор в схему лечения таких пациентов является рациональным.



