Ряд фармакологических средств (антибиотики, противоопухолевые препараты, иммунодепрессанты [1]) нарушают абсорбцию магния за счет воздействия на его почечную фильтрацию [2]. Большая часть магния (более 65%) фильтруется в почках и реабсорбируется в петле Генле, особенно в ее толстой восходящей ветви. Реабсорбция магния в петле Генле зависит от потенциала клеточных мембран и интенсивности обмена ионов хлорида и натрия.
Эти процессы, к сожалению, весьма чувствительны к воздействию ксенобиотических молекул, к которым относится подавляющее большинство лекарственных средств. Поэтому выраженная гипомагниемия часто наблюдается у пациентов, принимающих не только петлевые диуретики и осмотические вещества [3], но и другие виды фармацевтических препаратов, прежде всего антибиотики [4].
В настоящей статье представлены результаты систематического анализа фармакологических взаимодействий магния и антибиотиков. Последовательно рассматриваются антибактериальные эффекты магния, воздействие ионов магния на эффективность антибиотиков, антибиотики и другие препараты, вызывающие потери магния, в т.ч. аминогликозиды и фторхинолоны.
АНТИБАКТЕРИАЛЬНЫЕ ЭФФЕКТЫ МАГНИЯ
Ионы магния характеризуются антибактериальной активностью против стафилококков в стационарной фазе, т.к. разрушают мембранные оболочки золотистого стафилококка (рис. 1). В отличие от Staphylococcus aureus ионы магния не оказывают воздействия на кишечную палочку и сенную палочку [5].
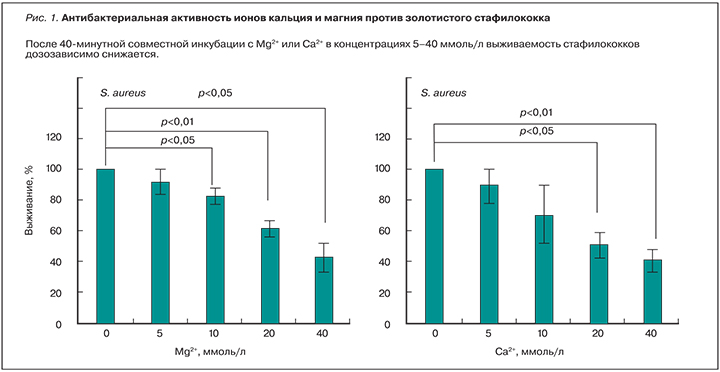
Антибактериальные свойства магния были показаны в модели имплантат-ассоциированной метициллин-резистивной инфекции S. aureus [6]. Антибактериальная эффективность металлических дисков из магния и титана (контроль) анализировалась после культивирования S. aureus в течение 6, 12 и 24 ч. Через 24 ч на поверхности Mg-дисков отмечены самые низкие уровни колонизации, и достоверно установлена бактерицидная эффективность магния по сравнению с титаном (р=0,01; рис. 2).
ВОЗДЕЙСТВИЕ ИОНОВ МАГНИЯ НА ЭФФЕКТИВНОСТЬ АНТИБИОТИКОВ
Показано влияние ионов кальция и магния на восприимчивость Pseudomonas к тетрациклину, гентамицину, полимиксину В и карбенициллину. Ионы кальция и магния увеличивают минимальные ингибирующие концентрации (МИК) тетрациклина, гентамицина, полимиксина и карбенициллина для 13 видов Pseudomonas [7]. Сочетание кальция и магния привело к увеличению МИК гентамицина.
Комплексообразование магния с фторхинолонами влияет на их антибактериальные свойства. Спектроскопия ядерного магнитного резонанса позволила локализовать Mg-связывающие сайты фторхинолонов между кетоновой и карбоксильной группами. Сродство магния к фторхинолонам коррелировало с их антимикробными свойствами против кишечной палочки и золотистого стафилококка [8].
Например, антацид, содержащий гидроксиды магния и алюминия, существенно влияет на всасывание и элиминацию пефлоксацина у здоровых добровольцев. В рандомизированном перекрестном исследовании каждый участник получал 400 мг пефлоксацина внутрь с добавлением или без добавления антацида. Совместное применение с антацидными средствами вызвало снижение уровней пефлоксацина в плазме и в моче. Площадь под кривой «концентрация–время» значительно уменьшилась (р<0,001), что указывает на нарушение всасывания пефлоксацина из желудочно-кишечного тракта. Относительная биодоступность пефлоксацина при комбинации с антацидом составила 44% от биодоступности без антацидов. Период полужизни пефлоксацина был значительно короче после его совместного приема с антацидом. Таким образом, чтобы обеспечить достаточную терапевтическую эффективность фторхинолонов, их следует принимать по крайней мере за 2 ч до приема антацидов [9]. Все эти результаты указывают на необходимость как можно более длительного перерыва между приемами препаратов магния и антибиотиков.

АНТИБИОТИКИ И ДРУГИЕ ПРЕПАРАТЫ, ВЫЗЫВАЮЩИЕ ПОТЕРИ МАГНИЯ
Антибиотики зачастую проявляют нефротоксичные и, в каком-то смысле, кардиотоксичные свойства. Во многом эти эффекты обусловлены именно потерями магния, которые возникают даже при однократном приеме антибиотиков. Так, гипомагниемия и нефротоксичность стимулируются приемом аминогикозида амфотерицина [10]. Фторхинолоны повышают риск фатальной аритмии «пируэт» (torsades de pointes) [11]; макролиды усугубляют гипокалиемию, гипомагниемию, брадикардию и удлинение QT на ЭКГ [12].
Из нежелательных эффектов антибиотикотерапии, специфически ассоциированных именно с потерями магния, следует выделить синдром «длинного QT», характеризующийся наследственным или приобретенным удлинением интервала QT на ЭКГ, которое существенно повышает риск желудочковой тахикардии и фибрилляции желудочков. Удлинение QT стимулируется антиаритмиками классов IA и III, антибиотиками (макролиды и фторхинолоны), антидепрессантами (особенно трициклическими), нейролептиками (галоперидол и фенотиазины) и др. [13].
Медикаментозная гипомагниемия по большей части происходит вследствие потери магния с мочой за счет усиления почечного клиренса. Магний-выводящие лекарства требуют достаточно частой проверки концентраций магния в плазме крови и эритроцитах [14]. Практически более приемлемым является профилактическое назначение препаратов магния на основе органических солей для профилактики гипомагниемии и истощения магниевого депо организма. К антибиотикам, вызывающим наиболее сильные потери магния, относятся аминогликозиды и фторхинолоны.
ГЕНТАМИЦИН И ДРУГИЕ АМИНОГЛИКОЗИДЫ
Гипомагнеземия является частым осложнением терапии аминогликозидами, т.к. повсеместно используемые терапевтические дозы этих антибиотиков вызывают гипомагниемию более чем у 30% пациентов. Больные, не получающие дотаций магния, имеют высокий риск развития гипомагнеземии [15].
В эксперименте эффекты аминогликозидов гентамицина, неомицина и тобрамицина на экскрецию кальция и магния были сопоставимы, в то время как нефротоксичное действие было наибольшим у неомицина и наименьшим – у тобрамицина [16]. Терапия гентамицином ассоциирована с симптоматическими гипомагниемией, гипокальциемией и гипокалиемией. Установлена достоверная корреляция между кумулятивной дозой гентамицина и сывороточной концентрацией Mg (р<0,05), а также между кумулятивной дозой гентамицина и почечной экскрецией Mg (r=0,89; р<0,01) [17].
Нефротоксичность гентамицина значительно усиливалась недостатком магния в диете: повреждения почек и смертность были более выражеными [18]. И наоборот, достаточная обеспеченность пищевым магнием оказывает защитное действие, предупреждая развитие острой почечной недостаточности после введения гентамицина внутримышечно (20 мг/кг). Гистологические исследования показали, что наименее тяжелая патология почечной ткани имела место у крыс, получавших диету с нормальным и высоким содержанием магния [19].
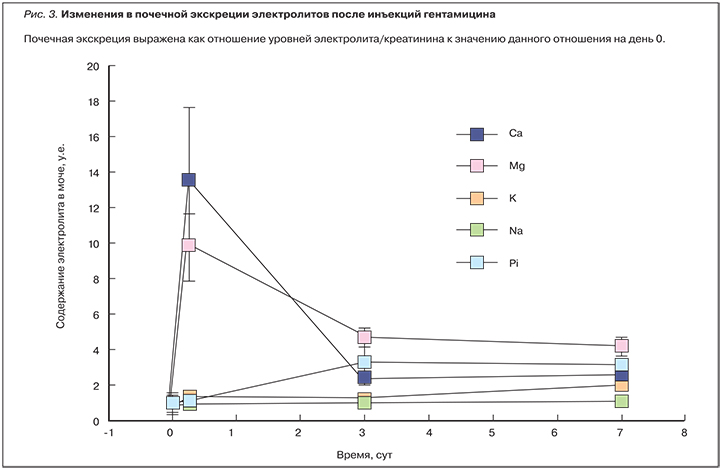
Гипомагнеземия, ассоциированная с применением гентамицина, вызывает гиперальдостеронизм и канальцевую токсичность, что делает необходимым постоянный контроль уровней магния, кальция и калия в сыворотке [20]. Гентамицин, известный своим нефротоксичным действием, стимулирует немедленную экскрецию кальция и магния с мочой. В эксперименте гентамицин (40 мг/кг) вводился в течение 7 сут. В течение 6 ч после введения он стимулировал значительную гиперкальциурию (14-кратное увеличение по сравнению с контролем) и гипермагнезурию (увеличение в 10 раз; рис. 3). Даже однократное введение гентамицина (в дозе 40 мг/кг) индуцировало значительные кальцеурию и магнезурию.
Клиническая практика многократно подтверждает, что аминогликозиды отрицательно влияют на почечный гомеостаз магния. Например, в исследовании пациентов с кистозным фиброзом (n=24; 9–19 лет) участники были госпитализированы из-за обострения легочных симптомов, вызванных синегнойной палочкой. Больные получали аминогликозид амикацин и цефалоспорин цефтазидим в течение 14 сут. Не было отмечено достоверных изменений уровней креатинина, мочевины, натрия, калия и кальция в плазме. Однако терапия антибиотиками значительно снизила концентрацию магния в плазме крови – с 0,77 (95% доверительный интервал [ДИ] 0,74–0,81) до 0,73 ммоль/л (95% ДИ 0,71–0,75). Параллельно отмечено увеличение фракционной экскреции магния с мочой – с 0,057 (95% ДИ 0,049–0,72) до 0,072 (95% ДИ 0,063–0,111) ммоль/л и общей экскреции магния – с 30,7 (95% ДИ 26–38) до 39 (95% ДИ 31–49) ммоль/л. Таким образом, аминогликозидная терапия стимулирует развитие гипомагниемии даже при отсутствии значительного возрастания уровней креатинина или мочевины (что указывало бы на выраженные нарушения функции почек) [21].
Терапия амфотерицином связана с повышенной экскреции магния с мочой вследствие нарушения его канальцевой реабсорбции. Применение амфотерицина у пациентов с системными грибковыми инфекциями (n=10, 30–68 лет) привело к формированию гипомагнеземии на 2-й неделе терапии после сравнительно небольших кумулятивных дозы амфотерицина В (~210 мг). Прекращение терапии амфотерицином возвращало уровни магния к наблюдаемым до лечения [22].
Гентамицин, используемый в стандартных клинических дозировках, стимулирует немедленное выведение кальция и магния с мочой. Перед началом исследования здоровые добровольцы получали диету с содержанием кальция 400 мг/сут и натрия 2300 мг/ сут в течение 1-й нед. Затем гентамицин (5 мг/кг) вводился внутривенно в течение 30 мин. Фракционная экскреция кальция с мочой выросла с 1,8±0,5 до 6,8±1,4% (р <0,01), а фракционная экскреция магния – с 3,4±0,8 до 11,8±6,4% (р=0,03). Гентамицин не вызывал изменений в почечной экскреции натрия, калия или фосфат-аниона [23].
Гипомагнеземия представляет собой повсеместное осложнение лечения больных с тяжелыми ожоговыми травмами. Это связано, в частности, с тем, что терапия аминогликозидами вызывает резкое увеличение почечной экскреции магния, что и способствует формированию гипомагниемии. Гипомагнеземия при лечении тобрамицином была ассоциирована с потерями калия, невосполнимыми при использовании одних препаратов калия. В то же время гипокалиемию удалось значительно скомпенсировать посредством использования препаратов магния [24].
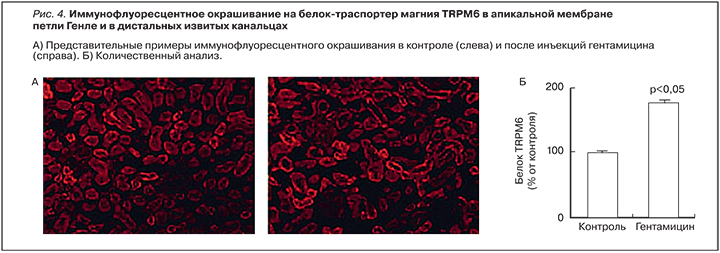
Фундаментальные исследования позволили установить молекулярные механизмы, связывающие прием аминогликозидов с потерями магния. Резкое увеличение экскреции Ca2+ и Mg2+ сопровождалось достоверным повышением экспрессии генов, кодирующих белки транспорта Ca2+ и Mg2+ в дистальных извитых канальцах – TRPV5 (175±3%), TRPV6 (170±4%), TRPM6 (156±4%) и кальбиндин-D28k (174±3%; во всех случаях р<0,05 по сравнению с контролем). Повышение экспрессии этих генов наблюдалось в течение всех 7 дней инъекций гентамицина [25].
Результаты иммунофлуоресцентного анализа подтвердили, что уровни соответствующих белков-транспортеров также увеличены в течение 7-дневного курса гентамицина. Установлено достоверное повышение уровней кальбиндина-D28k (202±5% от контроля; p<0,05), TRPV5 (194±4% от контроля) и белка-транспортера магния TRPM6 (178±4% от контроля; р<0,05; рис. 4).
ФТОРХИНОЛОНЫ
Фторхинолоны ципрофлоксацин, левофлоксацин, моксифлоксацин и гемифлоксацин широко используются для лечения различных видов бактериальных инфекций. К побочным эффектам фторхинолонов относят развитие судорог [26] и удлинение QT, особенно у пациентов с некорригированной гипокалиемией или гипомагниемией.
Одним из тяжелых последствий антибиотикотерапии фторхинолонами является разрушение структуры соединительной ткани. Курсовая антибиотикотерапия с использованием фторхинолонов может вызывать поражение ахилловых сухожилий (тендинит и даже разрывы), особенно у пациентов с низкой обеспеченностью магнием [27].
В экспериментальном исследовании собаки получали ципрофлоксацин (30 или 200 мг/кг) или плацебо перорально в течение 5 дней. Иммуногистохимическое определение уровней коллагена I, эластина, фибронектина и интегрина показало значительное снижение содержания всех этих белков, формирующих соединительную ткань. Например, уровень коллагена-I в сухожилиях (в произвольных денситометрических единицах) дозозависимо снижался с 3190±217 (контроль) до 1890±468 (30 мг/кг ципрофлоксацина) и 1695±135 (200 мг/кг ципрофлоксацина). У магний-дефицитных собак содержание коллагена-I составило 2053±491 ед.
Относительное содержание других белков в сухожилиях получавших ципрофлоксацин собак (30 мг/кг) также снижалось: эластина – на 73%, фибронектина – на 88%, β1-интегрина – на 96% [28]. Известно, что магний принимает активное участие в синтезе белков и гиалоуронановой основы соединительной ткани [29]. Поэтому приводимые выше данные подтверждают гипотезу о том, что токсическое воздействие фторхинолонов на соединительнотканные структуры может в значительной мере быть обусловлено магний-антагонистическим эффектом этих антибактериальных агентов [28].
В экспериментах с культурой хондроцитов удаление ионов Mg2+ из питательной среды клеток и добавление антибиотиков фторхинолонового ряда вызывает уменьшение адсорбции хондроцитов к коллагену-II, нарушение образования актиновых волокон и угнетение деления клеток. Эти изменения в структуре внеклеточного матрикса частично объясняют поражения, наблюдаемые в суставном хряще после введения фторхинолона [30].
В эксперименте на крысах эффекты лечения фторхинолоном и дефицита магния были особенно выражены, если терапия (курс 28 дней) проводилась в раннем возрасте (5 нед после рождения). В конце эксперимента был установлен тяжелый дефицит магния (0,33±0,12 против 0,97±0,08 ммоль/л в контроле). Повреждения хряща (рубцы и эрозии суставной поверхности, кластеры хондроцитов в пределах бесклеточных областей хрящевого матрикса и сохраняющиеся «расселины») были обнаружены в коленных суставах 70% взрослых крыс (9 мес), если терапия проводилась в возрасте 5 нед [31].
Применение фторхинолонов на фоне дефицита магния в эксперименте приводит к некрозу клеток развивающихся конечностей и к осаждению неструктурированного материала в межклеточном пространстве. Спарфлоксацин, темафлоксацин, ципрофлоксацин в дозах 60 и 100 мг/л тормозили развитие конечностей, особенно в магний-дефицитной среде (<10 32="" p="">
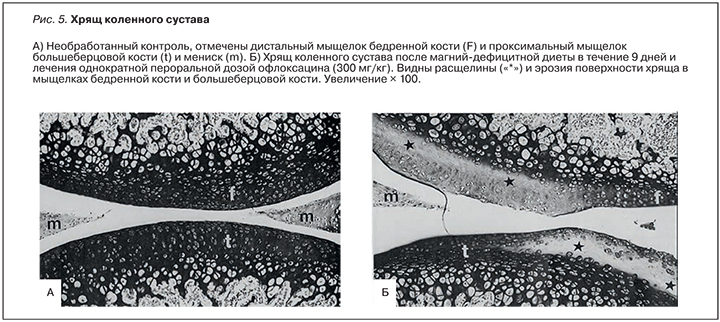
В эксперименте пероральное введение даже разовой дозы офлоксацина (300, 600 или 1200 мг/кг) в возрасте 5 нед было достаточным, чтобы вызвать грубые структурные дефекты хряща. Изменения, наблюдаемые на ультраструктурном уровне, указывают на поразительное сходство эффектов дефицита магния с эффектами разовой дозы офлоксацина (рис. 5). Хинолоновая артропатия, вероятно, обусловлена формированием нерастворимых хелатов магния и, таким образом, дефицита функционально доступного магния в суставном хряще [33].
Типичные ультраструктурные повреждения хряща при фторхинолоновой артропатии включали: 1) пучкообразные агрегаты на поверхности и в цитоплазме хондроцитов, 2) отделение клеточной мембраны от матрикса и некротирующихся хондроцитов, 3) разрушение внеклеточного матрикса, 4) набухание митохондрий. Возникновение некроза в клетках среднего слоя хряща, по-видимому, является важным для объяснения наблюдаемых изменений матрикса. Некроз сопровождался отчетливым уплотнением клеток перед их фрагментацией. Эти результаты гистологически подтверждают то, что применение фторхинолонов и низкая обеспеченность организма магнием вызывают практически неразличимые схожие патологические изменения ткани хряща [33].
Дефицит магния в хряще, возникающий при приеме фторхинолонов, ухудшает взаимодействия хондроцитов с внеклеточным матриксом, опосредованные, в частности, магний-зависимыми β1-интегринами. После однократного перорального приема офлоксацина экспрессия интегринов была достоверно снижена в непосредственной близости от мест поражений хряща. При магний-дефицитной диете ультраструктурные повреждения (образование расщелин, нарушения структуры коллагеновых волокон, осаждение фибронектина в хрящевом матриксе, снижение содержания гликозаминогликанов и др.) были весьма похожи на эффекты фторхинолона, хотя изменения в экспрессии интегрина были менее выражены [34].
По данным скрининга 2000 пациентов многопрофильных стационаров 7 регионов России антибиотикотерапия проводилась 638 пациентам 18–83 лет и сочеталась с гипомагнеземией (в плазме крови менее 0,8 ммоль/л, диапазон 0,55–0,68 ммоль/л; в эритроцитах менее 1,52 ммоль/л, диапазон 1,45–1,52 ммоль/л) у больных, получающих аминогликозиды и фторхинолоны, в 100% случаев, цефалоспорины – в 82% и пенициллины – в 70% [35]. При рекомендации коррекции дефицита магния (для сопровождения антибиотикотерапии назначались препараты органического магния Магне В6, Магне В6 Форте в дозе 5 мг/кг/веса в сут в течение 1 мес) значения концентрации магния в плазме крови поднимались у пациентов до уровня 0,7–0,96 ммоль/л, а в эритроцитах – до 1,52–1,68 ммоль/л.
ЗАКЛЮЧЕНИЕ
Между ионами магния и определенными антибиотиками (прежде всего, аминогликозидами и фторхинолонами) существуют антагонистические взаимодействия. Во-первых, антибиотикотерапия вызывает сильнейшие потери магния организмом, что обуславливает необходимость назначения магниевых препаратов. Во-вторых, ионы магния несколько снижают эффективность фторхинолонов и аминогликозидов за счет комплексообразования. Поэтому раздельный прием антибиотиков и препаратов магния повысит и эффективность, и безопасность антибиотикотерапии. Коррекция магниевого дефицита при антибиотикотерапии препаратом Магне В6 в таблетках (магния лактат, 48 мг элементного магния + пиридоксин 5 мг) и растворе (магния лактат, магния пидолат, 100 мг элементного магния + пиридоксин 10 мг) и препаратом Магне В6 Форте в таблетках (магния цитрат, 100 мг элементного магния + пиридоксин 10 мг) может быть решением проблемы магниевого дефицита при антибиотикотерапии.



