Причинами формирования дефицита магния является не только состояние острого или хронического стресса, но и в определенном смысле – неполноценное питание. Огромный массив фундаментальных и клинических исследований указывает на взаимосвязь между недостаточным содержанием магния в организме и риском развития различных заболеваний и патологических состояний [1]. В частности, проведенное в России крупномасштабное скрининговое исследование показало, что низкий уровень магния (<0,8 ммоль/л в плазме крови) соответствует достоверному повышению риска таких состояний, как «E66.3 Избыточный вес», «G47.8 Нарушения сна», «R56.8 Судороги», «H52 Миопия», «I63.0 Ишемический инфаркт мозга», «I10 Эссенциальная первичная гипертония», «I34.1 Пролапс митрального клапана», «F43.0 Острая реакция на стресс», «I20.0 Нестабильная стенокардия», «N94.3 Предменструальный синдром», «E11.7 E11.8 Инсулиннезависимый сахарный диабет», «I47.9 Пароксизмальная тахикардия неуточненная» и ряда других [2].
Неполноценность питания в отношении магния может проявляться по-разному. Во-первых, рафинированные продукты, содержание следовые количества магния, составляют значительную долю пищевого рациона современного человека. Во-вторых, потребляемые продукты питания могут содержать вещества (в частности, синтетические пищевые красители, разрыхлители, консерванты, антислеживатели, алкоголь и т.п.), которые способствуют усиленному выведению магния из организма. В-третьих, даже при формально высоком содержании магния в продуктах питания его биоусвояемость из этих продуктов может быть чрезвычайно мала (вследствие, например, присутствия в них тех или иных компонентов, в т.ч. хелаторов магния). Действительно, даже природные, несинтетические компоненты, входящие в состав пищи, могут существенно влиять на всасывание магния в кишечнике. Увеличение потребления белка и фруктозы улучшает всасывание магния, в то время как фитиновая кислота (ФК) существенно снижает его. Избыточное содержание в пище насыщенных жиров, кальция и фосфатов также оказывает четкий негативный эффект на усвоение магния. Очевидно, что влияние пищевых компонентов на всасывание магния критически важно при его низком суммарном потреблении пациентом, ведь потребление таких продуктов может привести к формированию острой недостаточности магния [3].
 В настоящей статье обсуждаются эффекты различных компонентов пищи, влияющие на всасывание магния. Последовательно рассматриваются вопросы о содержании магния в различных продуктах питания, в т.ч. в минеральной воде, взаимосвязи ФК, олигосахаридов/инулина и всасывания магния, также эффектах других компонентов пищи.
В настоящей статье обсуждаются эффекты различных компонентов пищи, влияющие на всасывание магния. Последовательно рассматриваются вопросы о содержании магния в различных продуктах питания, в т.ч. в минеральной воде, взаимосвязи ФК, олигосахаридов/инулина и всасывания магния, также эффектах других компонентов пищи.
СОДЕРЖАНИЕ МАГНИЯ В РАЗЛИЧНЫХ ПРОДУКТАХ ПИТАНИЯ
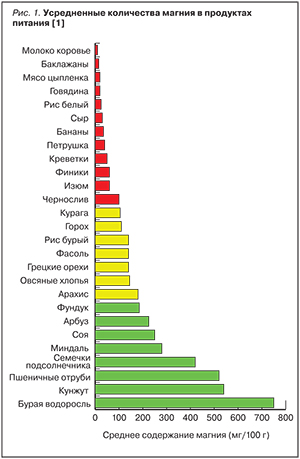
В настоящее время человек потребляет в среднем 175–225 мг/сут магния, в то время как 100 лет назад суточное потребление магния, по разным оценкам, составляло 400–500 мг/сут [1]. Одной из причин резкого снижения потребления магния является то, что в одном и том же виде продукта концентрации магния и других типичных для данного продукта макро- и микроэлементов могут значительно колебаться. Так, в пшеничных отрубях, выращенных на российских почвах, средние значения концентрации магния ниже (448 мг/100 г), чем в отрубях, выращенных в Европе (600 мг/100 г). Усредненные количества магния в различных продуктах питания приведены на рис. 1. Цельные зерновые продукты могут являться важным источником магния в питании человека: хлеб из непросеянной муки содержит магния в среднем 60 мг/100 г, хлеб с проростками – 285 мг/100 г, хлеб с отрубями – 490 мг/100 г, в то время как в «белом» хлебе количество магния значительно меньше (24 мг/100 г). Помимо того или иного количества магния, хлеб также может содержать значительные количества ФК – естественного комплексообразователя, который существенно снижает всасывание Mg, Ca, Fe и других микроэлементов из пищевых продуктов.
Несколько сортов сладкого картофеля (Ipomoea batatas L.), произрастающих на вулканических почвах Тенерифе (Канарские острова, Испания) содержат больше магния, чем натрия: средние концентрации магния составляют 609 мг/кг, натрия – 500 мг/ кг, калия – 4409 мг/кг, кальция – 564 мг/ кг [4]. Различные продукты могут способствовать повышению всасывания магния. Например, киви содержит невысокие количества магния (14–17 мг/100 г), но в то же время усвоение магния и других элементов (железа, кальция, фосфора) из данного фрукта является повышенным [5]. Обжаренные и молотые соевые бобы могут существенно повысить уровень магния в сыворотке крови. Однако, если использовать соевые бобы как единственный источник магния, их чрезмерное употребление повышает риск кальцификации тканей почек [6].
Подчеркнем еще раз, что высокое содержание магния в продуктах питания практически ничего не говорит о реальном всасывании магния из этих пищевых продуктов. Например, морские водоросли считаются ценными пищевыми источниками магния. Действительно, различные виды морских водорослей содержат магний в количестве 600–1000 мг/100 г, что соответствует 400– 600 мг/100 г растворимого магния. Однако анализ съедобных японских морских водорослей аоса (Ulvaceae pertusa), комбу (Laminaria japonica) и фунори (Gloiopeltis furcata) показали, что всасывание магния из них было весьма низким. Несмотря на высокое содержание растворимого магния в исследованных образцах водорослей, биодоступность магния из водорослей комбу была сравнима с таковой из оксида магния (т.е. менее 5%). Биодоступность магния из водорослей аоса и фунори была еще ниже (2–4%) [7]. Однако экстракты морских водорослей все же способствовали повышению минеральной плотности костной ткани в большей степени, чем оксид магния [8].
 СОДЕРЖАНИЕ МАГНИЯ В МИНЕРАЛЬНЫХ ВОДАХ
СОДЕРЖАНИЕ МАГНИЯ В МИНЕРАЛЬНЫХ ВОДАХ
Использование минеральной воды с высоким содержанием ионов магния имеет большое значение при диетической коррекции дефицита магния. Заметим, что еще Аристотель сказал, что «воды – такие, как почвы, через которые они проходят». Почвы с высоким содержанием магниевых минералов приводят к формированию вод с высоким содержанием магния.
Минеральные воды с высоким содержанием магния встречаются довольно редко: Баталинская минеральная вода (1,52 г/л), Донат (1,26 г/л), Пятигорская, Лысогорская скважина (0,65 г/л), воды курорта Кука, скважина № 27 (0,23 г/л), крымский нарзан (<0,2 г/л), кисловодские нарзаны (<0,2 г/л). Многие минеральные воды имеют следовые количества магния (Кармадон – 0,0054 г/л, Сосневская – 0,0868 г/л, Славяновская – 0,0432 г/л, Ессентуки 17 – 0,0708 г/л, Полюстровская – 0,006 г/л.) [1]. Прием пищи здоровыми добровольцами (n=10) улучшал всасывание магния из минеральной воды (110 мг/л), в которой магний представлен в виде раствора с высокой концентрацией ионов Mg2+. Среднее значение всасывания магния из минеральной воды составило 45±5% (40–56%). При потреблении воды совместно с приемом пищи всасывание было достоверно выше (52±4%, 46–60%, р=0,0001). Таким образом, биологическая доступность магния из минеральной воды повышается, когда вода потребляется с едой [9], что, вероятно, обусловлено увеличением объема пищевого транзита в тонком кишечнике, где происходит интенсивное всасывание магния.
Важно отметить дозозависимый характер биодоступности магния. Например, всасывание магния на фоне приема пищи измеряли у здоровых добровольцев после употребления в пищу стандартной диеты, дополненной 0, 10, 20, 40, и 80 мг-экв ацетата магния. Всасывание увеличивалось при повышении дозы магния. Кривая зависимости в координатах «доза–всасывание» хорошо описывалась уравнением, содержащим гиперболическую плюс линейную функцию (уравнение регрессии – у=ехр(1,27-2,89/(х+1))+0,07x; рис. 2) [10]. Это означает, что процесс абсорбции магния одновременно использует механизм всасывания, который достигает некоторого максимума поглощения (соответствующий, по всей видимости, насыщению магнием цельной крови), и механизм, который обеспечивает дальнейшее всасывание определенной, достаточно небольшой части (7%) потребляемого магния [10] и соответствует, вероятно, депонированию магния в других тканях. Для сравнения: всасывание кальция характеризуется в основном линейной зависимостью, что соответствует существованию специальных механизмов депонирования кальция непосредственно в костную ткань.
 ФИТИНОВАЯ КИСЛОТА И ВСАСЫВАНИЕ МАГНИЯ
ФИТИНОВАЯ КИСЛОТА И ВСАСЫВАНИЕ МАГНИЯ
Фитаты способствуют снижению всасывания практически всех микроэлементов, в т.ч. магния, из продуктов питания. В эксперименте добавление ФК (7,5–15 г на 1 кг пищи) приводило к дозозависимому уменьшению всасывания магния, снижению концентрации Mg2+ в плазме крови (контроль – 21±5 мкг/мл, 15 г/кг фитатов – 11±4 мкг/мл; р=0,04) и содержания магния в кости (контроль – 1664±127 мкг/г, 15 г/кг фитатов – 906±132 мкг/г; р=0,01). Сниженные биодоступность магния и его содержание в биосубстратах при приеме ФК сопровождалось увеличением содержания в печени реактивных соединений тиобарбитуровой кислоты и белковых карбонилов, а также снижением содержания восстановленного глутатиона (контроль – 30 нмоль/мг белка, 15 г/кг ФК – 24 нмоль/мг). Таким образом, ФК оказывает проокислительное действие на печень на фоне снижения всасывания магния в организме [11].
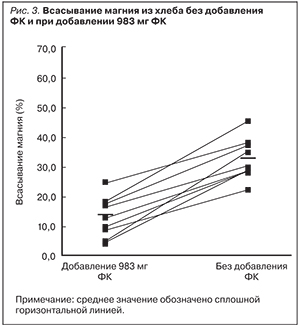
Известно, что сама по себе ФК вызывает определенные негативные метаболические изменения. В эксперименте диета, обогащенная ФК (0,2–1%), снижала концентрацию гормонов щитовидной железы и отношение Т3/Т4. Эти изменения сопровождались повышением уровня глюкозы в крови и увеличением уровней гликогена в печени и мышечной ткани [12]. Добавление ФК к белому пшеничному хлебу подавляло всасывание магния у здоровых добровольцев (n=16). В тестовый рацион, включающий 200 г хлеба без добавления ФК, она добавлялась в количествах, характерных для цельнозернового (983 мг) или ржаного хлеба (495 мг). Общее содержание магния в хлебе было стандартизовано до 86 мг/100 г во всех исследованных образцах. Всасывание магния контролировалось по его содержанию в фекалиях. Было показано, что добавление ФК дозозависимо снижает всасывание магния с 33±7% (контроль без ФК) до 24±13% (495 мг ФК; p<0,01) и до 13±7% (983 мг ФК; р<0,0005). Таким образом, поглощение магния из хлеба дозозависимо снижается при добавлении ФК [13] (рис. 3). Поэтому, например, хлеб, содержащий отруби, характеризуется не только высоким количеством магния, но и достаточно высоким содержанием ФК, затрудняющей всасывание магния. Частичное расщепление ФК тем или иным способом улучшает всасывание магния. Например, исследования абсорбции микроэлементов показывают, что фитаза из черной плесени (Aspergillus niger) значительно увеличивает биодоступность железа и цинка из продуктов с высоким содержанием фитатов [14]. Изготовление хлеба с использованием дрожжей и других заквасок существенно улучшает магнийдотирующие свойства хлеба за счет частичного расщепления ФК дрожжами и более высокого уровня кислотности (что способствует большей активности фермента фитазы в самой пшенице) [15]. Так, содержание ФК в дрожжевом хлебе было ниже на 52%, а в хлебе на закваске из дрожжей и лактобацилл ниже на 71% [16] по сравнению с бездрожжевым хлебом.
ОЛИГОСАХАРИДЫ И ВСАСЫВАНИЕ МАГНИЯ
В эксперименте маннитол улучшает всасывание и удержание кальция и магния. При содержании в рационе 4–8% маннитола всасывание магния достоверно увеличивалось, тогда как накопление магния в костной ткани было достоверном только на диетах с 8% содержанием маннитола [17].
 Галактоолигосахариды повышают всасывание минеральных веществ, что ассоциировано с улучшением свойств костной ткани. В частности, галактоолигосахариды увеличивают всасывание магния (р<0,02) и его удержание в костной ткани, что повышает прочность костей. Эти эффекты обусловлены пребиотическими свойствами галактоолигосахаридов, т.к. они способствуют увеличению доли бифидобактерий в микробиоте кишечника [18].
Галактоолигосахариды повышают всасывание минеральных веществ, что ассоциировано с улучшением свойств костной ткани. В частности, галактоолигосахариды увеличивают всасывание магния (р<0,02) и его удержание в костной ткани, что повышает прочность костей. Эти эффекты обусловлены пребиотическими свойствами галактоолигосахаридов, т.к. они способствуют увеличению доли бифидобактерий в микробиоте кишечника [18].
В эксперименте фруктоолигосахариды усиливали всасывание магния и противодействовали негативному воздействию ФК. Совместный прием фруктоолигосахаридов и ФК в течение 4 нед повысил абсорбцию кальция (+7%; p<0,05), магния (+19%; p<0,05) и железа (+17%; p<0,05). Кроме того, фруктоолигосахариды значительно увеличивали содержание магния в бедренной кости (p<0,01) [19].
Инулинсодержащие пребиотики улучшают усвоение магния [20]. Коротко- и длинноцепочечные фруктаны инулинового типа ферментируется микрофлорой и улучшают всасывание магния в кишечнике. В эксперименте фруктаны инулина, полученные из корней цикория, приводили к значительному усилению ферментации, снижению экскреции магния на 25–42% и увеличению его кишечной абсорбции на 20–25%. Интересно, что поглощение кальция увеличивалось только при использовании смесей коротко- и длинноцепочечных инулинов [21].
Экспериментальные исследования с использованием изотопных меток показывают, что более высокое суточное потребление инулина увеличивает всасывание в кишечнике и магния, и кальция. Поглощение кальция и магния было значительно ниже у более старых крыс (>10– 20 мес), чем у молодых и взрослых животных. Во всех исследованных возрастных группах (3, 6, 11, 21 мес) инулин снижал фекальную экскрецию магния в 2–3 раза, увеличивая мочевую экскрецию только в 1,5–2 раза. В результате более высокое суточное потребление инулина повышало суммарную кишечную абсорбцию магния на 25–30% и удержание магния в организме на 10–18% [22].
Фруктаны инулинового типа (инулин, олигофруктоза) улучшают функцию кишечника. В отличие от большинства пищевых волокон их ферментация в толстом кишечнике вызывает значительные изменения в составе кишечной микрофлоры с увеличением количества полезных бактерий и снижением числа потенциально вредных бактерий. Это также приводит к повышению всасывания кальция и магния [23].
В эксперименте мука из корней якона (Smallanthus sonchifolius, близкий родственник топинамбура, произрастающий в Южной Америке) содержала 62±9 мг магния на 100 г продукта, а также инулиновые фруктаны, улучающие всасывание магния. В течение 27 сут животные получали либо контрольную диету, либо муку якона (5 или 7,5% фруктоолигосахаридов). Потребление яконовой муки способствовало улучшению гистологии тканей кишечника: отмечено увеличение глубины и общего количества крипт, числа раздвоенных крипт. Потребление яконовой муки приводит к достоверному улучшению всасывания магния и кальция, что отражается в повышении прочности кости [24].
В клиническом исследовании диета с дотациями низкоусвояемых углеводов (100 г/сут, 31 день) способствовала повышению всасывания и удержания магния у здоровых добровольцев (n=10). Потребление низкоусвояемых углеводов не вызывало расстройств пищеварения (за исключением метеоризма у некоторых участников). Относительное всасывание магния увеличилось на 20% (р=0,007), а удержание магния повышалось на 31 мг/сут (р=0,024) [25]. Таким образом, низкокалорийная диета с большим количеством клетчатки не только способствует улучшению состояния микробиоты, но и является прекрасным вспомоществованием для повышения усвоения магния организмом.
 ЭФФЕКТЫ ДРУГИХ КОМПОНЕНТОВ ДИЕТЫ
ЭФФЕКТЫ ДРУГИХ КОМПОНЕНТОВ ДИЕТЫ
В эксперименте белковая фракция яичного желтка ингибировала всасывание кальция, магния и железа. Белковая фракция желтка по сравнению с казеином и соевым белком уменьшает всасывание кальция и магния вследствие резистентности фосвитина к протеолизу в соляной кислоте желудка [26].
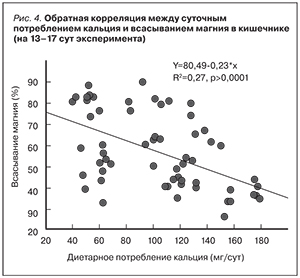
Всасывание магния обратно пропорционально суточному потреблению кальция (рис. 4). Тем не менее дотации магния в эксперименте увеличивают минеральную плотность костной ткани за счет улучшения костного метаболизма при условии адекватного потребления кальция с пищей [27].
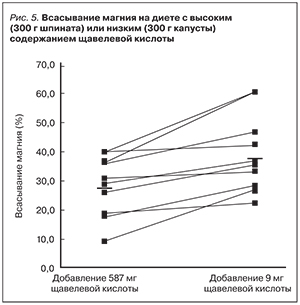
Всасывание магния значительно снижается на фоне приема овощей с высоким содержанием щавелевой кислоты и ее солей, оксалатов (например, шпината) по сравнению с овощами с низким содержанием щавелевой кислоты (например, капусты). В клиническом исследовании здоровые добровольцы (n=9) получали либо 100 г белого хлеба без фитатов и 300 г шпината (587 мг щавелевой кислоты, 120 мг магния), либо белый хлеб и 300 г капусты (9 мг щавелевой кислоты, 115 мг магния). Всасывание магния была достоверно ниже в случае использования в диете шпината (27±10%) по сравнению с капустой (37±12%; p=0,01; рис. 5) [28]. Таким образом, наличие в шпинате и капусте почти равного количества магния не означает одинаковое его всасывание, т.к. поступление магния из шпината отчасти нивелируется высоким содержанием щавелевой кислоты.
Данные о влиянии лактозы на всасывание магния противоречивы. С одной стороны, утверждается, что лактоза улучшает всасывание магния и марганца из детских молочных смесей [29]. С другой стороны, в эксперименте было показано, что добавление лактозы к пище не оказывает никакого влияния на усвоение магния [30].
ВОЗДЕЙСТВИЕ КОФЕИНА, АЛКОГОЛЯ, СИНТЕТИЧЕСКИХ ПИЩЕВЫХ ДОБАВОК И ПОЛЛЮТАНТОВ НА ВЫВЕДЕНИЕ МАГНИЯ
В современном питании магний является одним из наиболее «пострадавших» микронутриентов. На фоне снижающегося тренда потребления свежих, экологически чистых продуктов (прежде всего зелени, овощей, орехов) и утраты разнообразия питания наметилась крайне негативная тенденция все большего использования в питании «веществ-вытеснителей» магния (искусственные красители, энергетические кофеинсодержащие напитки, напитки типа «кола», пересоленная еда, раннее употребление алкоголя и т.д.). На «магний-дефицитный тренд» в питании указывают результаты крупномасштабных исследований NHANES, проведенных в США. Исследовались когорты детей 1–5 лет в разные годы. Исследования NHANES в периоды 1976– 1980, 1988–1994 и 2001–2006 гг. показали, что в 1976–1980 гг. примерно 85% детей потребляли молоко, в то время как в 2001–2006 гг. – только 77%. Если в 1976–1980 гг. потребление цветного и ароматизированного молока (содержащего искусственные розовые красители и ароматизаторы вишни, ананаса, клубники и т.д.) было относительно низким (менее 3%), то к 2006 г. оно увеличилось до 14% (р<0,001). Потребление фруктовых соков и лимонадов также резко возросло. Так, к 2006 г. более 50% населения США стали употреблять пакетированные соки по сравнению с 30% в 1976–1980 гг. (р<0,001) [31]. Также до 30% детей стали употреблять т.н. безалкогольные напитки и лимонады, напитки типа «кола», содержащие большое количество красителей и следовые дозы магния. Распространенным заблуждением является мнение, что фруктовый сок является источником магния для детей. Даже 100% соки, потребляемые в количестве 1 л/сут, могут покрывать не более 11% суточной потребности в магнии, а безалкогольные напитки вообще не являются источниками каких-либо микронутриентов, в т.ч. и магния [32]. Некоторые компоненты продуктов питания могут стимулировать диурез, что будет усугублять дефицит магния, кальция и других минералов. В клиническом исследовании здоровые добровольцы (n=17, возраст – от 17 лет до 41 года) получали 300 мг/сут элементного магния и двукратно принимали кофеин в дозе 3 мг/кг в 7:00 и 10:00. После приема второй дозы кофеина содержание магния в моче резко возрастало до 16:00; в период с 16:00 до 1:00 следующих суток не было отмечено достоверного повышения экскреции магния. В целом было показано, что потребление кофеина усиливало суточные потери магния с мочой [33].
Этанол, входящий в состав алкогольных продуктов, также резко усиливает потери электролитов, в т.ч. магния. Употребление алкоголя приводит к 2–3-кратному увеличению экскреции магния [34]. Симптоматика алкоголизма и возникающие на фоне приема алкоголя патологии отчасти обусловлены именно возникающей недостаточностью магния (жажда, озноб, беспокойство, судороги, алкогольная эпилепсия, делирий, тахикардия, алкогольная кардиомиопатия и т.д.) [35]. Даже «умеренные» дозы алкоголя (<30 мл этанола в сут) приводили к повышенной экскреции кальция и магния по сравнению с контрольной группой непьющих испытуемых [36]. Прием этанола в количестве 0,5 г/кг (т.е. приблизительно тех же 30–35 мл) в течение 15–25 мин приводит к усиленному диурезу и мочеиспусканию не позднее чем через 1–2 ч. Эффект дозозависим, и количество выводимой мочи возрастает пропорционально количеству выпитого алкоголя. Следует отметить, что с мочой выводится менее 1% от потребленного алкоголя и продуктов его биотрансформации; остальная часть алкоголя и его метаболитов оказывает токсическую нагрузку на печень, легкие и другие органы [37].
Потенциальную угрозу в плане истощения магниевого депо представляют ярко окрашенные сладости, печенье, конфеты, газированные напитки, консервы, которые содержат синтетические консерванты и красители, ведущие к развитию не только дефицита магния, но и гиперактивности. Например, в Саутгемптонском исследовании была установлена корреляция между пищевыми добавками E102, E104, E110, E122, E124, E129, приводящими к потерям магния, с развитием гиперактивности у детей [38]. В исследовании участвовали 153 ребенка в возрасте 3 лет и 144 детей 8–9 лет. В течение 6 нед дети не употребляли пищевых продуктов, содержащих использовавшиеся в исследовании красители. В течение 1-й, 3-й и 5-й нед все дети получали только сок-плацебо (без красителей и бензоата натрия); в течение 2-й, 4-й и 6-й нед группа детей была рандомизирована к получениию 300 мл/ сут сока со смесью красителей (смесь А или смесь В). Для 3-летних детей смесь А включила 20 мг искусственных пищевых красителей (5 мг «желтого заката» [E110], 2,5 мг кармоизина [E122], 7,5 мг тартразина [E102], 5 мг «пунцового 4R» [E124]) и 45 мг бензоата натрия [E211]. Смесь B включила 30 мг искусственных пищевых красителей (7,5 мг «желтого заката», 7,5 мг кармоизина, 7,5 мг «хинолинового желтого» [E110], 7,5 мг «красного очаровательного» [E129]) и 45 мг бензоата натрия. Результаты исследования показали, что прием смеси красителей в течение всего одной недели приводил к достоверному повышению показателей гиперактивности по шкале GHA как у 3-летних, так и у 8–9-летних детей [38].
Фосфаты, добавляемые в сосиски, сардельки, колбасу и другие мясопродукты, не только удерживают влагу и способствуют сохранению розоватого цвета, но и затрудняют усвоение магния. Пересоленная пища, вследствие увеличения салиуреза и диуреза под действием хлорида натрия, приводит к неизбежным потерям магния [39]. Повышенное потребление насыщенных твердых жиров (сливочное масло и другие молочные продукты, низкокачественная, жирная говядина и свинина, маргарин) затрудняет усвоение магния. Избыток в пище и в воде таких загрязнителей, как свинец, пестициды, полихлорированные бифенолы, полифторалкилы, также негативно сказывается на обеспеченности магнием [1].
Заметим, что фармакокинетическим и фармакодинамическим синергистом магния является пиридоксин. В исследовании Women’s Health Initiative (WHI), включавшем 3713 женщин в возрасте 50–79 лет, более высокое суточное потребление магния (с пищей, водой или в виде добавок органического магния) ассоциировалось со снижением концентраций маркеров системного воспаления (С-реактивный белок, фактор некроза опухоли-α, интерлейкин-6) и эндотелиальной дисфункции [40]. В крупномасштабном мультиэтническом исследовании по изучению атеросклероза (MESA), включившем 5181 человека в возрасте 45–84 лет, установлено, что потребление магния обратно пропорционально концентрациям гомоцистеина: при переходе от высшего к низшему квинтилю потребления магния уровни гомоцистеина значимо снижались от 9,20 до 8,33 мкмоль/л (р<0,001) [41]. В этой связи очевидна перспективность комбинированных препаратов органического магния (цитрат магния и пиридоксин, лактат магния и пиридоксин и т.д.) для снижения уровней системного воспаления и гомоцистеина. Продуктом-концентратором витаминов группы В являются кедровые орехи: витамин В1 – 33,82 мг, витамин В2 – 88,05 мг, витамин В6 – 122,4 мг на 100 г. Витамин В6 содержится в небольших количествах в следующих продуктах (на 100 г): фисташки – 1,71 мг, семена подсолнечника – 1,34 мг, чеснок – 1,23 мг, курица – 0,9 мг, печень – 0,8 мг, облепиха – 0,8 мг, тунец – 0,8 мг, скумбрия – 0,8 мг, кунжут – 0,78 мг, хрен – 0,7 мг, кориандр – 0,6 мг, фундук – 0,56 мг, орех грецкий – 0,536 мг, чечевица – 0,52 мг, коричневый рис – 0,508 мг, гранат – 0,5 мг, орех кешью – 0,427 мг, фасоль – 0,396 мг, пшено – 0,38 мг, банан – 0,36 мг, говядина – 0,36 мг. При хранении и нагревании витамин В6 разрушается. Недостаточная обеспеченность витамином В6 в России очень часта, а у женщин вообще занимает лидирующую позицию [42]. При недостаточной обеспеченности витамином В6 гипомагниевые состояния развиваются значительно быстрее, и, напротив, при совместной коррекции обоих микронутриентов эффективное восстановление баланса магния и пиридоксина происходит в короткие сроки (1–2 мес).
Важно отметить, концентрация магния в плазме крови претерпевает циркадианные изменения. В частности, в период с 3:00 до 5:00 отмечаются наиболее низкие за сутки концентрации магния [1]. Поэтому прием препаратов магния можно перенести на вечер (чтобы профилактировать избыточное падение уровней магния в крови) или на утро (чтобы быстрее восстановить уровни магния).
ЗАКЛЮЧЕНИЕ
Компенсация недостаточности магния с использованием специальной диеты кажется оптимальным решением проблемы дефицита магния в организме. Между тем научные данные свидетельствуют о том, что даже пища с формально высоким содержанием магния может характеризоваться его низкой биоусвояемостью. Более того, многочисленные синтетические пищевые добавки в виде красителей и консервантов провоцируют дефицит магния. Высококалорийная диета с избытком насыщенных жиров и соли, алкоголя, недостатком клетчатки, инулинов и продуктов-доноров позитивной микробиоты (лактобактерий и др.) не только не обеспечивает человека достаточным количеством магния, но и провоцирует провоспалительные реакции, нарушая иммунную защиту организма.
Заметим также, что биодоступность магния и других микроэлементов из фармацевтических форм и пищевых продуктов зависит не только от состава пищи и наличия в ней, например, фитатов или оксалатов, но также и от состояния желудочно-кишечного тракта. Так, снижение секреции соляной кислоты желудочного сока вместе с изменениями в проницаемости слизистой оболочки кишечника может заметно снижать всасывание питательных веществ – факт, полностью игнорируемый при формулировке рекомендаций по питанию и потреблению микроэлементов. Сниженная кислотность желудочного сока будет способствовать резкому снижению всасывания магния из такой фармацевтической формы, как оксид магния (который может всасываться в организме только при условии растворения в соляной кислоте желудка) [43].
Компенсация дефицита магния должна быть комплексной. На фоне рекомендаций по оптимизации диеты (исключения «синтетической», высококалорийной, жирной пищи, включения продуктов-доноров магния с низким содержанием фитатов, дополнение диеты клетчаткой и инулинсодержащими продуктами и т.д.) следует также обеспечить прием достаточного количества элементного магния в составе органических солей – лактата магния (например, Магне В6), цитрата магния (Магне В6 Форте), пироглутамата магния (Магне В6 в ампулах, раствор для питья) и т.д.



