Многие фармакологические препараты стимулируют развитие гипомагнеземии. Ятрогенная гипомагнеземия весьма часто возникает при приеме ряда антибиотиков (фторхинолоны, аминогликозиды, макролиды, амфотерицины и др. [1]), иммунодепрессантов (ингибиторы кальциневрина, циклоспорин, FK506), модуляторов EGFR (рецептора эпидермального фактора роста), ингибиторов протонной помпы и, конечно же, при приеме диуретиков. Развивающиеся при употреблении этих препаратов потери магния повышают риск развития артериальной гипертонии, судорог, аритмий и других патологических состояний [2].
Диуретики активно используют в комбинации с различными антигипертензивными препаратами для повышения их эффективности [3]. Снижая объем циркулирующей крови, диуретики приводят к салиурезу, что предполагает потери не только натрия, но и других электролитов. Действие большинства диуретиков основано на снижении реабсорбции хлорида натрия в различных участках нефрона. В сочетанной терапии с антигипертензивными средствами диуретики эффективны у широкого круга пациентов с артериальной гипертензией (АГ), но неизбежно вызывают электролитный и кислотно-щелочной дисбаланс организма, связанный с сердечно-сосудистым риском и смертностью (особенно у пожилых пациентов). Так, терапия диуретиками ассоциирована с гипонатриемией, гипокалиемией, гипомагнеземией, нарушениями регуляции кальция, фосфата и кислотно-щелочного гомеостаза [4]. Злоупотребление диуретиками является весьма распространенным клиническим сценарием, приводящим к смертельно опасной фибрилляции предсердий, вызванной глубокой гипомагнеземией [5].
К сожалению, в клинической практике для нижней границы нормы магния в плазме крови часто используются заниженные значения (0,7 и даже 0,65 ммоль/л вместо 0,83 ммоль/л). Поэтому ятрогенная гипомагнеземия, возникающая как побочный эффект использования диуретиков, часто остается незамеченной [6]. В то же время проводимые в России крупномасштабные скрининговые исследования показали, что уровни магния в плазме крови менее 0,8 ммоль/л соответствуют достоверному повышению риска таких состояний, как избыточный вес, нарушения сна, судороги, миопия, ишемический инфаркт мозга, эссенциальная первичная гипертония, пролапс митрального клапана, острая реакция на стресс, нестабильная стенокардия, предменструальный синдром, инсулиннезависимый сахарный диабет, неуточненная пароксизмальная тахикардия и др. [7, 8].
В настоящей работе представлены результаты систематического анализа причин и последствий ятрогенной недостаточности магния, возникающей вследствие приема диуретиков. Последовательно рассмотрены основные классы диуретиков и их магнийвыводящие эффекты, врожденная и ятрогенная дисфункции почек вследствие приема диуретиков, нежелательные побочные последствия применения диуретиков. Отдельное внимание уделено вопросу использования препаратов магния для компенсации гипомагнеземии и других негативных эффектов терапии диуретиками.
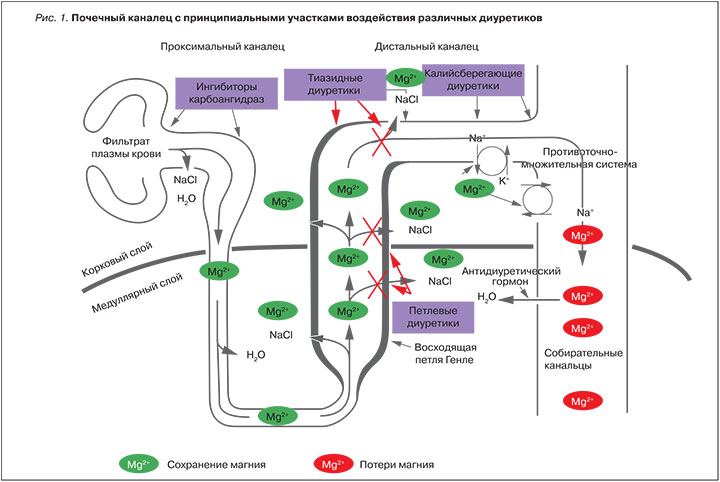
ОСНОВНЫЕ КЛАССЫ ДИУРЕТИКОВ И ИХ МАГНИЙВЫВОДЯЩИЕ ЭФФЕКТЫ
Информация о специфических антимагниевых свойствах каждого из фармакологических классов диуретиков весьма важна для адекватного ведения пациентов (в т.ч. для назначения солей магния и, при необходимости, калия), позволяющего избежать неблагоприятных побочных эффектов [9]. Классификация диуретиков основана на локализации их действия в нефроне и соответствующих механизмах (таблица, рис. 1). Все диуретики действуют путем ингибирования поступления катиона Na+ либо аниона HCO3- в клетки. Ингибиторы карбоангидразы (например, ацетазоламид) тормозят дегидратацию Н2СО3 в люмене, гидратацию Н2СО2 внутри клеток проксимальных канальцев и выход аниона HCO3- из клетки. В результате проксимальная реабсорбция HCO3- уменьшается, что индуцирует диурез и салиурез. Усиленное выведение HCO3- приводит к метаболическому ацидозу и гипокалиемии. Негативное влияние ингибиторов карбоангидраз на потери магния остается неизученным.
Калийсберегающие диуретики ингибируют Na-каналы люминальной мембраны кортикальной собирающей трубочки. Это приводит к умеренному диурезу на фоне заметного снижения потерь калия с почками [10]. Kалийсберегающие диуретики отчасти являются и магнийсберегающими диуретиками.
Петлевые диуретики ингибируют Na/ Cl-котранспортер в толстой восходящей ветви петли Генле. Это приводит к выраженному диурезу и салиурезу, а также сопровождается повышенной экскрецией ионов Ca2+, Mg2+ и K+. Тиазидные диуретики ингибируют Na/ Cl-котранспортер в начале дистальных канальцев. Диурез в случае тиазидов менее выражен, чем у петлевых диуретиков, но почечные потери ионов K+ и Mg2+ сопоставимы с петлевыми диуретиками. Таким образом, петлевые и тиазидные диуретики являются наиболее «антимагниевыми» из всех известных диуретиков (рис. 1) [5].
Реабсорбция магния в почечных канальцах имеет свои отличительные особенности по сравнению с реабсорбцией натрия и кальция. Концентрация магния в проксимальных канальцах возрастает в 1,5 раза выше, чем в клубочковом фильтрате. Около 20–30% отфильтрованного магния реабсорбируется в проксимальных канальцах (натрия или кальция – 50–60%). Несмотря на то, что реабсорбция магния составляет лишь половину реабсорбции натрия, она зависит от уровней натрия и объема внеклеточной жидкости. Основная порция отфильтрованного магния (около 65%) реабсорбируется в петле Генле, преимущественно в восходящей части [11]. Поэтому диуретики, действующие в этой области и блокирующие обратный захват магния, будут наиболее сильно стимулировать потери магния организмом.
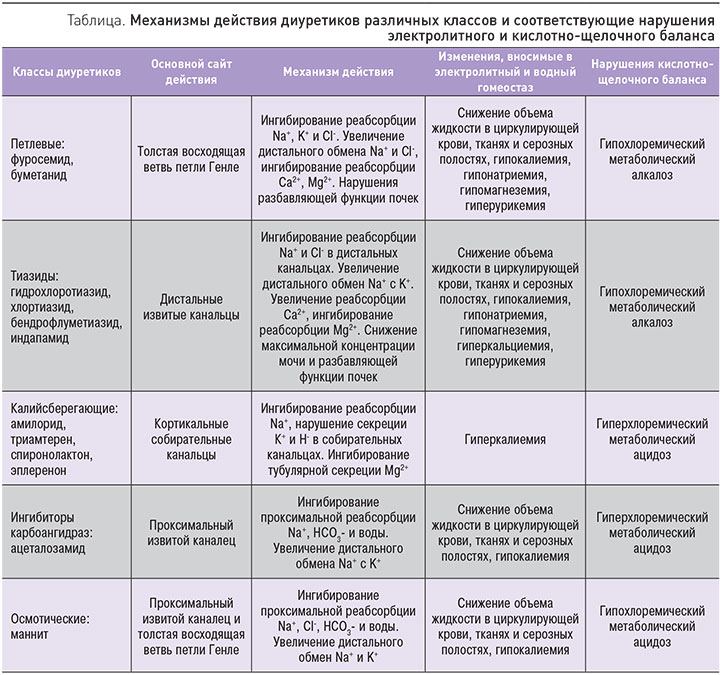
Петлевые диуретики (фуросемид, пиретанид, буметанид) обратимо связываются с Na/Cl/K-котранспортером, отвечающим за всасывание Cl- в восходящем колене петли Генле. В результате реабсорбция хлорида натрия в этом сегменте нефрона снижается, что приводит к уменьшению обратного всасывания воды, реабсорбции Са2+ и Mg2+ и увеличивает экскрецию магния, кальция и калия с мочой [12]. Реабсорбция хлорида натрия в толстой восходящей ветви петли Генле опосредована через Na/K-котранспортер NKCC2. Котранспортер активируется при низкой внутриклеточной концентрации Na+, регулируемой базолатеральной Na/K-АТФазой, K/ Cl-котранспортером и Cl-каналом CLC-K2 [13]. Петлевые диуретики усиливают выведение магния даже без увеличения диуреза как такового. В эксперименте показано, что диурез значительно увеличивался при дозах фуросемида в 2,4 мг/кг и выше. Тем не менее при использовании фуросемида в дозе всего в 0,8 мг/кг происходило достоверное падение уровней магния в сыворотке крови, а при дозе в 1,6 мг/кг отмечено достоверное повышение потерь магния с мочой [14] (рис. 2).
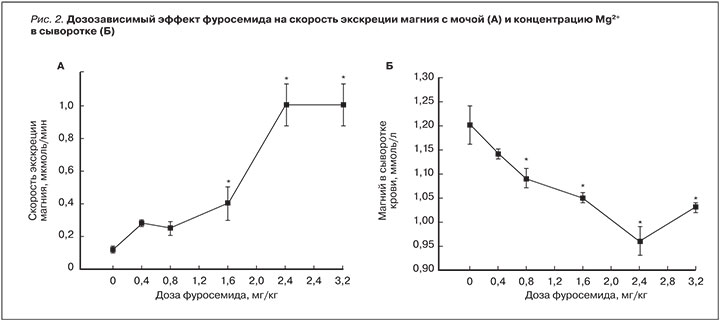
Тиазидные диуретики действуют в дистальных извитых канальцах. Дистальный каналец реабсорбирует 70–80% магния, поступающего из петли Генле. Поскольку реабсорбция ионов Mg2+ после прохождения дистального канала крайне мала, данный сегмент выводящих трубочек играет важную роль в определении количества выводимого с мочой магния. Пептидные гормоны (например, антидиуретический гормон, паратиреоидный гормон, кальцитонин, глюкагон, аргинин-вазопрессин) усиливают обратный захват Mg2+ в дистальных канальцах. Повышение уровней Mg2+ в плазме крови приводит к активации Mg-чувствительного белка-сенсора CASR, что пропорционально снижает всасывание магния обратно в кровоток [15]. Тиазидные диуретики повышают почечную экскрецию Na+, блокируя Na/Cl-котранспортер NCC в дистальных канальцах. В эксперименте тиазид-индуцированная гипомагнеземия ассоциирована с пониженными уровнями экспрессии гена TRPM6 и более низкими уровнями белка Mg-транспортирующего канала TRPM6 [16] (рис. 3).
Совместное использование калийсберегающих диуретиков с тиазидными и петлевыми диуретиками несколько снижает риск развития гипокалиемии и гипомагнеземии [13]. Петлевые диуретики фильтруются через клубочки и достигают сайтов своего действия в петле Генле после секретирования в проксимальных канальцах. Они обратимо ингибируют Na/K-котранспортер (ген NKCC2) в апикальной мембране эпителиальных клеток толстой восходящей ветви петли Генле. В то же время калийсберегающие диуретики непосредственно блокируют натриевые ENaC каналы и, следовательно, тормозят реабсорбцию натрия в дистальных и собирательных канальцах [13]. Действие калийсберегающих диуретиков осуществляется в дистальных и собирательных канальцах. Реабсорбция Na+ происходит через амилоридчувствительный эпителиальный Na-канал (ENaC). Альдостерон увеличивает активность ENaC и Na/K-АТФазы, что повышает реабсорбцию Na+, секрецию К+ и Н+ в мочу. Альдостерон также регулирует уровни гидрокарбоната НСО3- в плазме крови, тем самым поддерживая кислотно-щелочной баланс крови. Антагонисты альдостерона (эплеренон, спиронолактон) конкурентно ингибируют связывание альдостерона с минералокортикоидным рецептором, в то время как амилорид и триамтерен непосредственно блокируют натриевые каналы ENaC и, таким образом, обратное всасывание Na+ [13]. Kалийсберегающие диуретики проявляют слабый магнийсберегающий эффект. Действительно, магнезурия, индуцированная тиазидами, может быть частично уменьшена низкими дозами калийсберегающих диуретиков (например, триамтереном в средней дозе 25 мг). Однако такие дозировки необходимо подбирать для каждого пациента, т.к. слишком высокие или слишком низкие дозы триамтерена не проявляют магнийсберегающих эффектов [17].
Заметим также, что сочетание диуретиков с другими препаратами (антибиотиками, цитостатиками и др.) могут существенно усугублять магнийвыводящие эффекты, несмотря на использование калийсберегающих диуретиков. Например, использование ингибиторов протонной помпы в популяционной когорте (n=724) было ассоциировано с повышенным риском гипомагнеземии (уровни магния в плазме крови менее 0,72 ммоль/л, отношение рисков [ОР] – 2,0, 95% доверительный интервал [ДИ] 1,4–2,9, особенно на фоне приема диуретиков – ОР 7,2, 95% ДИ 1,7–31) [18, 19].
О ВРОЖДЕННОЙ И ЯТРОГЕННОЙ ДИСФУНКЦИИ ПОЧЕК
Проведенный нами систематический анализ показал, что клинические последствия применения магнийвыводящих диуретиков характеризуются определенной степенью схожести с такими врожденными заболеваниями почек, как синдром Гительмана и синдром Барттера.
Синдром Гительмана – врожденное заболевание почек, при котором дисфункция дистальных канальцев (вследствие дефекта гена Na/ Cl-котранспортера) приводит к метаболическому алкалозу с нормальным артериальным давлением, гипокалиемией, гипомагнеземией и гипокальциурией. Лечение состоит в приеме дотаций калия и магния внутрь и, при необходимости, использовании калийсберегающих диуретиков [20]. Для синдрома Гительмана характерны тяжелая гипокалиемия (калий в сыворотке крови 2,7–3,0 ммоль/л), гипомагнеземия, метаболический алкалоз и выраженная стимуляция ренин-ангиотензин-альдостероновой системы. Клинические проявления включают усталость, мышечные судороги и слабость. Увеличение выделение натрия с мочой наблюдается после введения фуросемида, но не после введения гидрохлортиазида, что указывает на дефект активности тиазидчувствительного натрий-хлоридного белка-транспортера в дистальных извитых канальцах. Терапия заключается в пожизненном назначении смесей солей магния и калия [21].
Долгосрочный прием диуретиков провоцирует развитие псевдо-синдрома Барттера, который весьма схож с врожденными формами синдрома Барттера. Пациенты с врожденным синдромом Барттера характеризуются как нормотензивные, гиперренинемические, гипокалиемические пациенты с метаболическим алкалозом с нормальной экскрецией хлоридов с мочой и, конечно, без следов диуретиков в моче. У пациентов с псевдо-синдромом Барттера в моче содержатся значительные количества диуретиков и их метаболитов, а также определяются высокие уровни мочевой кислоты в плазме крови. Эти две группы больных не отличаются по уровням Na+, Cl-, K+, HCO3-, ренина и альдостерона в плазме крови. Фармакологической пробой на псевдо-синдром Барттера является введение фуросемида (40 мг внутривенно), что вызывает резкое усиление оттока мочи (11,7–21,8 мл/мин), осмоляльности мочи (148–186 мОсм/кг) и фракционной экскреции натрия (15–24%) при синдроме Барттера, но не в случае псевдо-синдрома Барттера [22].
О НЕГАТИВНЫХ КЛИНИЧЕСКИХ ПОСЛЕДСТВИЯХ ПРИМЕНЕНИЯ ДИУРЕТИКОВ И НЕДОСТАТОЧНОСТИ МАГНИЯ
Как показано выше, все диуретики способствуют выведению из организма натрия, многие усиливают выведение катионов калия, кальция, магния, а также хлорид- и бикарбонат-анионов. Усиление экскреции анионов хлорида и бикарбоната приводит к расстройствам кислотно-щелочного баланса, сопровождающим использование диуретиков. Побочные эффекты, как правило, дозозависимы и обратно пропорциональны объему крови [23].
Идиосинкратические реакции на диуретики включают интерстициальный нефрит, панкреатит, миалгии, кожную сыпь, тошноту, головокружение [23]. Петлевые и тиазидные диуретики стимулируют развитие гипокалемического, гипомагнемического метаболического алкалоза. Ингибиторы карбоангидраз, назначаемые более 3-х суток, могут вызывать метаболический ацидоз (зачастую симптоматический) [24]. Тиазидные диуретики повышают риск сахарного диабета и ассоциированы с глюкозотолерантностью и гиперхолестеринемией [24]. Обычно уделяют большее внимание именно гипокалиемии, возникающей в результате использования диуретиков. В то же время гипомагнеземия характеризуется не менее серьезными последствиями. Например, более низкие уровни магния в плазме крови ассоциированы с сердечно-сосудистым риском и смертностью пациентов на гемодиализе (n=206) [25]. Развитие глубокой гипомагнеземии у пациентов отделения интенсивной терапии (n=446) ассоциировано с более высокими показателями смертности (35%, норма – 12%, р<0,01) и было результатом не только септического шока (p<0,01), но и использования диуретиков (р<0,01) [26]. Более того, именно возникновение гипомагнеземии объясняет широкий спектр неблагоприятных побочных эффектов диуретиков. Так, клинические симптомы, ассоциированные с использованием диуретиков, включают депрессию, мышечную слабость, гипокалиемию, резистентную к применению солей калия, и фибрилляции предсердий, рефрактерные к терапии дигоксином. Этот же набор симптомов характерен и для дефицита магния [27]. Более того, дотации магния способствуют быстрому преодолению этих клинических проявлений, возникающих при использовании диуретиков [28].
Глюкозотолерантность и гиперхолестеринемия, ассоциированные с использованием диуретиков (в частности, тиазидных), также возникают как вторичное следствие гипомагнеземии [28]. Действительно, ион магния необходим для передачи сигнала от рецептора инсулина и, кроме того, для поддержания ферментативной активности ацилсинтетаз жирных кислот. Поэтому именно дефицит магния, а не калия ассоциирован с глюкозотолерантностью и нарушениями липидного профиля [27].
 Гипомагнеземия, стимулируемая применением диуретиков (в частности, тиазидных), стимулирует развитие гиперхолестеринемии и в результате способствует формированию нарушений строения сосудистой стенки у пациентов с АГ. Например, в исследовании пациенток с АГ участницы были разделены на две группы в соответствии с низкими (<0,83 ммоль/л) или нормальными (≥0,83 ммоль/л) концентрациями магния в плазме крови. Та же группа пациенток разделялась в соответствии с низкими (<1,56 ммоль) и нормальными (≥1,56 ммоль/л) концентрациями магния в эритроцитах. Низкие уровни магния в плазме были ассоциированы с повышенным сердечно-сосудистым риском по Фремингемской шкале (16%±3%, норма – 11%±1%; р=0,024), более высоким артериальным давлением, как систолическим (148±7 мм рт. ст., норма – 135±3 мм рт. ст., p=0,049), так и диастолическим (91±3 мм рт. ст., норма – 84±2 мм рт. ст., р=0,042). Гипомагниемия также была связана с повышенной толщиной стенки сонной артерии (0,92±0,09 мм, норма – 0,76±0,02 мм, р=0,023). Низкие концентрации магния в эритроцитах были ассоциированы с повышенными значениями параметров жесткости сосудистой стенки – повышенным давлением аугментации (20±2 мм рт. ст., норма – 15±1 мм рт. ст., р=0,032) и индексом аугментации (43±2% по сравнению с 33±2%; р=0,004) [29].
Гипомагнеземия, стимулируемая применением диуретиков (в частности, тиазидных), стимулирует развитие гиперхолестеринемии и в результате способствует формированию нарушений строения сосудистой стенки у пациентов с АГ. Например, в исследовании пациенток с АГ участницы были разделены на две группы в соответствии с низкими (<0,83 ммоль/л) или нормальными (≥0,83 ммоль/л) концентрациями магния в плазме крови. Та же группа пациенток разделялась в соответствии с низкими (<1,56 ммоль) и нормальными (≥1,56 ммоль/л) концентрациями магния в эритроцитах. Низкие уровни магния в плазме были ассоциированы с повышенным сердечно-сосудистым риском по Фремингемской шкале (16%±3%, норма – 11%±1%; р=0,024), более высоким артериальным давлением, как систолическим (148±7 мм рт. ст., норма – 135±3 мм рт. ст., p=0,049), так и диастолическим (91±3 мм рт. ст., норма – 84±2 мм рт. ст., р=0,042). Гипомагниемия также была связана с повышенной толщиной стенки сонной артерии (0,92±0,09 мм, норма – 0,76±0,02 мм, р=0,023). Низкие концентрации магния в эритроцитах были ассоциированы с повышенными значениями параметров жесткости сосудистой стенки – повышенным давлением аугментации (20±2 мм рт. ст., норма – 15±1 мм рт. ст., р=0,032) и индексом аугментации (43±2% по сравнению с 33±2%; р=0,004) [29].
Гипомагнеземия вследствие приема диуретиков стимулирует повышение уровней катехоламинов в крови, что приводит к увеличению в плазме крови фракции липопротеинов и к подъему артериального давления [30]. Повышение уровней катехоламинов на фоне недостаточности магния связано со снижением активности магнийзависимого фермента метаболизма катехоламинов, катехоламин-О-метилтрансферазы [27]. И наоборот, дотации магния нормализуют метаболизм катехоламинов, что приводит к нормализации давления. Например, пациенты, проходившие длительное лечение АГ диуретиками (n=18), получали дотации магния в виде гидрохлорида аспартата магния (330 мг/сут в расчете на элементный магний в течение 6 мес). И систолическое, и диастолическое артериальное давление достоверно снижалось (в среднем на 12±8 мм рт. ст., р<0,05) [31].
Даже однократный прием диуретиков усиливает почечную экскрецию магния. Например, однократный прием фуросемида, этакриновой кислоты или политиазида здоровыми добровольцами приводил к значительному увеличению почечной экскреции магния. Повышенная экскреция магния коррелировала с почечной экскрецией натрия после применения фуросемида (r=0,69, р=0,001), этакриновой кислоты (r=0,87, р=0,001) и политиазида (r=0,59, р<0,01) [32]. Важность магнийвыводящего эффекта однократного приема диуретиков становится особенно очевидной у пациентов с сердечно-сосудистой патологией. Если у таких больных имелась недостаточность магния и она не была замечена лечащим врачом, то и однократное применение диуретиков может одномоментно снизить уровень магния в плазме крови ниже критического (0,5 ммоль/л). Это существенно повысит риск тахиаритмий и инфаркта миокарда. Клинические исследования показали взаимосвязь между применением тиазидных диуретиков и возникновением желудочковых аритмий вследствие дисбаланса электролитов. У пациентов с АГ в пожилом возрасте дефицит магния особенно повышает вероятность внезапной смерти вследствие желудочковой тахиаритмии. При этом известно, что дотации калия недостаточны для восстановления электролитного баланса после приема диуретиков и купирования аритмий, что обуславливает необходимость использования препаратов магния [33].
Хроническая гипомагнеземия, возникающая вследствие долговременного приема диуретиков, пусть даже в малых дозах, стимулирует формирование синдрома удлиненного QT, который является промежуточной стадией и предвестником формирования аритмий [34]. QT интервал определяется как время от начала Q волны до конца зубца Т и представляет собой меру сердечной реполяризации. Длительность интервала QT на электрокардиограмме колеблется в интервале 350–440 мс. Большие значения QT могут быть результатом недостаточного питания, ведущего к низким уровням магния и калия в крови, или возникают при использовании диуретиков и других лекарственных препаратов [27]. При наличии синдрома удлиненного QT (МКБ-10 I45.8) задержка реполяризации миокарда после удара сердца повышает риск эпизодов аритмии «пируэт», что приводит к обморокам и к внезапной смерти вследствие фибрилляции желудочков [35].
Важность гипомагнеземии как центрального звена, обуславливающего возникновение негативных побочных эффектов диуретиков, заключается и в том, что гипомагнеземия способствует нарушению гомеостаза калия и усилению потерь калия с мочой. Даже при использовании низких доз тиазидных или петлевых диуретиков гипокалиемия возникает у 11% пациентов, причем у 40% этой подгруппы больных гипокалиемия обязательно сопровождается гипомагнеземией [36]. Калийсберегающие свойства иона магния [37] обусловлены тем, что магний является кофактором Na/K-АТФаз, участвует в энергетическом обмене и в поддержании активности Na/K-котранспортеров. Поэтому дефицит ионов магния ухудшает процессы перекачивания ионов натрия из клетки и ионов калия в клетку. Дефицит ионов магния выпрямительных K-каналах миокарда вызывает аритмию. Гиперальдостеронизм, неполноценный рацион питания, прием алкоголя усугубляют потери магния и калия с мочой [38].
Следует заметить, что даже при отсутствии формально регистрируемой гипомагнеземии (уровни магния в крови менее 0,82 ммоль/л) изменения концентраций электролитов и натрий-калиевых белков-транспортеров, возникающие при продолжительном приеме диуретиков, способствуют формированию хронического дефицита калия и магния в мышечной ткани. Например, в группе пациентов, получавших диуретики в течение 2–14 лет (n=25), средние концентрации калия, магния и натрий-калиевых белков-транспортеров в биопсиях скелетных мышц были значительно ниже, чем в контрольной группе. Несмотря на то, что пациенты получали дотации калия, у 56% пациентов средняя концентрация калия в мышцах была ниже 3,4 ммоль/л, что соответствует выраженной недостаточности калия [39]. Уровни калия были прямо пропорциональны уровням магния в мышцах (рис. 4).
ОБ ИСПОЛЬЗОВАНИИ ПРЕПАРАТОВ МАГНИЯ ДЛЯ КОМПЕНСАЦИИ ГИПОМАГНЕМИИ И ГИПОКАЛИЕМИИ, ВОЗНИКАЮЩИХ ПРИ ТЕРАПИИ ДИУРЕТИКАМИ
Один из способов избежать побочных эффектов диуретиков очевиден – индивидуальное снижение дозы. В то же время совершенно ясно, что этот подход снижает и эффективность терапии диуретиками [40]. Резистентность пациентов к высоким дозам петлевых диуретиков может быть преодолена посредством совместного использования с тиазидными диуретиками. Однако такой подход к терапии существенно усугубляет нарушения электролитного баланса, вызывая глубокую гипомагнеземию. Хотя магнезурия, индуцированная тиазидами, может быть частично уменьшена посредством приема низких доз калийсберегающих диуретиков, данный подход требует индивидуального подбора сочетания диуретиков для каждого пациента [17]. У некоторых пациентов потери калия и магния при использовании тиазидных диуретиков могут быть несколько снижены за счет совместного применения с петлевым диуретиком торасемидом. В исследовании 12 здоровых добровольцев совместное применение гидрохлоротиазида (25 мг) и торасемида (5–10 мг) в большей степени увеличивало натрийурез, чем экскрецию К+ и Mg2+ [41]. Однако такой режим не позволяет эффективно профилактировать гипомагнеземию.
Принимая во внимание, что широкий круг побочных эффектов диуретиков ассоциирован именно с гипомагнеземией, следует признать, что компенсация дефицита магния не менее, а то и более важна, чем компенсация дефицита калия или других электролитов [37]. Поэтому гораздо более эффективным средством предотвращения нарушений электролитного баланса при использовании диуретиков является одновременное назначение органических солей магния (при необходимости также и калия). Например, пероральный прием дотаций органических солей магния (300 мг/сут в расчете на элементный магния, не менее 30 сут) является эффективным способом достижения существенного прироста уровней магния и калия в плазме крови и в эритроцитах у пациентов с тяжелой застойной сердечной недостаточностью, проходящих терапию фуросемидом (>80 мг/сут) [42].
В исследовании с участием здоровых добровольцев (n=22) участники получали гидрохлортиазид в дозе 50 мг/сут и были рандомизированы для получения смеси солей калия (160 мг/ сут в расчете на элементный калий) и магния (240 мг/ сут) или на получение только калия в форме хлорида (160 мг/сут в расчете на элементный калий). Однако только совместное использование солей магния профилактировало гипомагнеземию и гипокалиемию, чего не наблюдалось при отдельном назначении хлорида калия [43].
Использование смесей органических солей калия и магния является эффективным способом предотвращения провоцируемых тиазидными диуретиками гипокалиемии, гипомагнеземии и соответствующих негативных побочных эффектов, в т.ч. мочекаменной болезни. Здоровые добровольцы (n=61) принимали гидрохлоротиазид (50 мг/сут) в течение 3-х нед, и у них развились гипокалиемия и гипомагнеземия. Прием не менее чем 300 мг/сут элементного магния способствовал нормализации уровней магния в крови. Побочные эффекты терапии тиазидными диуретиками практически полностью нивелировались при приеме 2800 мг/сут калия и 420 мг/сут магния [44, 45].
Только долговременный прием пероральных препаратов магния позволяет полностью компенсировать дефицит магния, возникающий в организме при использовании диуретиков. Например, дотации магния педиатрическим пациентам, длительно получающим диуретики (n=76, возраст 1 год – 17 лет), нормализуют уровень магния, калия и натрия в скелетных мышцах. При этом короткий срок приема препарата (2–12 нед) позволял частично компенсировать гипомагнемию, что практически не затронуло уровни магния в мышцах. Дотации магния в течение 26 нед (6 мес) позволили нормализовать уровни магния и калия в мышечной ткани у большинства пациентов [46].
Сопровождение диуретикотерапии дотациями магния улучшает метаболизм глюкозы, нарушения которого возникают именно вследствие гипомагнеземии. У пациентов с АГ (n=18) после лечения тиазидными диуретиками отмечено повышение уровней инсулина в плазме крови (от 66±7 до 87±8 пмоль/л, р<0,02), триглицеридов (от 1,88±0,24 до 2,34±0,44 ммоль/л, р<0,05). Дотации магния в течение 8 нед (180 мг/сут в расчете на элементный магний) стимулировали достоверное повышение уровней магния в плазме (р<0,05) и в эритроцитах (р<0,01), улучшение всасывания и окислительного метаболизма глюкозы. Уровни магния в эритроцитах были обратно пропорциональны уровням инсулина в плазме крови (р<0,05) [47].
ЗАКЛЮЧЕНИЕ
Диуретики входят во многие схемы лечения сердечно-сосудистых, цереброваскулярных, инфекционных, почечных заболеваний, а также широко применяются в терапии неотложных состояний. Чаще всего диуретики комбинируют с антигипертензивными препаратами, диуретиками других классов, антибиотиками и многими другими лекарственными препаратами. Поэтому сочетание нескольких магнийвыводящих препаратов вовсе не экзотика, а весьма распространенная проблема в современной клинической практике. Наиболее агрессивными по отношению к магнию являются петлевые и тиазидные диуретики, особенно в сочетании с магнийвыводящими антибиотиками (аминогликозиды, фторхинолоны, амфотерицины, макролиды). При планировании фармакотерапии следует обязательно учитывать магнийвыводящие свойства назначаемых препаратов. Современным подходом к предотвращению магниевого дефицита при использовании таких видов комбинированной терапии является превентивное назначение магниевых препаратов на основе органических солей (Магне В6 Форте, Магне В6 и др.). Наилучшей из этих солей для совместного назначения с диуретиками является цитрат магния, имеющий неоспоримые преимущества в лечении пациентов с заболеваниями почек, уролитиазом. Катион магния синергичен с цитрат-анионом [27] и потенцирует защитные эффекты цитрат-аниона по отношению к паренхиме почек. Заметим, что при сопровождении терапии диуретиками таблетки Магне В6 Форте следует запивать достаточным количеством воды (100–200 мл), т.к. это потенцирует и диурез, и всасывание магния.



