По прогнозам европейских исследователей, к 2025 г. число остеопоротических переломов в Европе увеличится по сравнению с 2010 г. на 28% и составит 4,5 млн [1]. По данным Международного фонда остеопороза (ОП), каждые три секунды в мире происходит один остеопоротический перелом. Начиная с возраста 50 лет, каждая третья женщина и каждый четвертый мужчина в течение оставшейся жизни перенесут хотя бы один остеопоротический перелом [2, 3].
Социальную, медицинскую и экономическую значимость ОП определяют именно переломы, которые сопровождаются снижением качества жизни, большими финансовыми затратами, а зачастую и смертностью. Тяжесть последствий перелома зависит от возраста пациента, сопутствующих заболеваний и локализации самого перелома. В случае переломов проксимального отдела бедренной кости менее половины пожилых пациентов восстанавливают свой функциональный статус, а каждый третий утрачивает способность к самообслуживанию и нуждается в длительном постоянном уходе. Показатели смертности при этом достигают 36% в течение первого года после перелома [4].
В 2010 г. общее число случаев переломов проксимального отдела бедренной кости в России составляло 112 тыс. С учетом увеличения продолжительности жизни населения в ближайшие годы в России будет наблюдаться рост случаев патологических переломов [5]. Выявление лиц с высоким риском переломов и назначение эффективной фармакотерапии ОП – приоритетные задачи здравоохранения.
НЕМНОГО О СТРУКТУРЕ КОСТНОЙ ТКАНИ
Костная ткань представляет собой динамическую систему, которая непрерывно изменяется на протяжении жизни человека и обладает высокой чувствительностью к эндогенным и экзогенным воздействиям. Будучи органом опоры и защиты внутренних органов, местом прикрепления сухожилий мышц, она выполняет формообразующую функцию, играет роль рычага при движениях, участвует в кроветворении, обеспечивает резерв жизненно важных минералов.
Костная ткань представлена клеточными элементами, органическим матриксом и минеральными веществами. Органический матрикс (или остеоид) на 90% состоит из коллагена. Фибриллы коллагена формируют пластины, которые расположены либо параллельно друг другу вдоль трабекул, либо концентрически вокруг кровеносных сосудов, образуя при этом гаверсовы каналы, соединенные между собой поперечными (фолькманновскими) каналами. При ускоренном метаболизме, на фоне эндокринных, хронических воспалительных заболеваний, в первую очередь ревматических, указанная геометрия костной ткани нарушается, ее прочность утрачивается.
Неколлагеновая часть матрикса представлена витамин К-зависимыми глютамилпротеинами (остеокальцином), матричными протеинами, протеином S, остеопонтином, остеонектином, фибронектином, а также фосфопротеидами, сиалопротеидами и белками сывороточного происхождения. Белки неколлагеновой группы также связаны с минерализацией кости. Минеральная часть кости представлена преимущественно кальцием и фосфатом, а также другими макро- и микроэлементами (магнием, марганцем, цинком, селеном, бором). Для нормальной минерализации костей необходимо поддержание определенных концентраций Са2+ и РО43- и микроэлементов во внеклеточной и периостальной жидкости.
ДИНАМИКА КОСТНОГО МЕТАБОЛИЗМА
Ремоделирование кости (образование и резорбция) – динамический процесс, при котором неорганические вещества (минералы) откладываются в органический матрикс, восстанавливая ее структуру. Кость формируют клетки мезенхимального происхождения – остеобласты, которые синтезируют и секретируют органический матрикс. Они снабжены большим количеством рецепторов паратиреоидного гормона, витамина D, простагландинов, интерлейкинов и трансформирующего фактора роста β и др. В остеобластах локализуется основное количество щелочной фосфатазы кости.
Сразу после секреции матрикса начинается его минерализация, которая заканчивается через несколько недель. В процессе минерализации остеобласты превращаются в остеоциты – полностью интегрированные в кость и имеющие очень низкую метаболическую активность. Резорбцию кости осуществляют остеокласты (многоядерные клетки, образующиеся при слиянии клеток-предшественников макрофагально-моноцитарного ряда), активно синтезируя и секретируя во внеклеточное пространство лизосомальные ферменты [6].
Именно нарушение костного ремоделирования, которое проявляется усилением резорбции костной ткани и снижением ее формирования, лежит в основе патогенеза ОП.
ФАРМАКОТЕРАПИЯ ОСТЕОПОРОЗА: РЕАЛИИ И ПЕРСПЕКТИВЫ
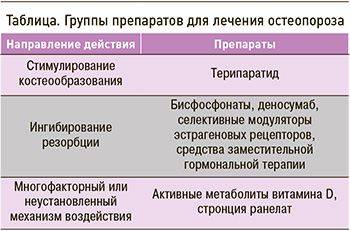 Фармакологическая терапия ОП направлена на восстановление равновесия между резорбцией кости и ее формированием (табл.).
Фармакологическая терапия ОП направлена на восстановление равновесия между резорбцией кости и ее формированием (табл.).
Исследования в области остеоиммунологии позволили расширить представления о механизмах развития ОП и разработать современные таргетные препараты, действующие на основные звенья патогенеза заболевания. Установлено, что изменения экспрессии молекул-регуляторов, участвующих в ремоделировании кости, с возрастом и вследствие негативного влияния других факторов приводят к снижению прочности кости. Одной из ключевых молекул, влияющих на костный обмен, является склеростин, продуцируемый зрелыми клетками костной ткани (остеоцитами). Он ингибирует Wnt-сигнальный путь и препятствует дифференцировке мезенхимальных стволовых клеток и созреванию остеобластов – клеток, формирующих новую костную ткань. При инициации процессов костного ремоделирования синтез склеростина остеоцитами снижается, что способствует активации остеобластогенеза [7].
В 2019 г. в США, Канаде и ряде стран Европы был одобрен к применению ромосозумаб – человеческое моноклональное антитело к склеростину. По результатам III фазы клинических исследований ромосозумаб показал высокую эффективность в лечении постменопаузального ОП. Однако учащение сердечно-сосудистых событий у части испытуемых потребовало дальнейшего анализа данных [8].
Помимо склеростина, ключевая роль в развитии ОП принадлежит цитокиновой системе RANK/RANKL/OPG. Клетки остеобластного ряда экспрессируют на своей поверхности лиганд рецептора-активатора ядерного фактора каппа-В (RANKL), который связывается с рецептором RANK, расположенным на клеточной мембране преостеокластов, и активирует созревание остеокластов. Гиперпродукция RANKL приводит к усилению резорбции костной ткани.
Первым моноклональным антителом, разработанным для лечения ОП, стал деносумаб. Связывая RANKL, этот биопрепарат предотвращает взаимодействие RANK c RANKL, в результате чего значительно замедляется и ослабляется процесс дифференциации и активации остеокластов [9]. В настоящее время появились данные многолетних проспективных наблюдений, оценивающих отдаленную эффективность и безопасность деносумаба [10, 11]. В нашей стране накоплен опыт применения этого моноклонального антитела не только при лечении постменопаузального ОП, но и при лечении ОП у больных ревматоидным артритом [12–14].
ФАКТОРЫ РАЗВИТИЯ ОСТЕОПОРОЗА И РОЛЬ КАЛЬЦИЯ И ВИТАМИНА D В ЕГО ЛЕЧЕНИИ
Говоря о патогенезе ОП, нельзя не упомянуть провоспалительные цитокины – фактор некроза опухоли альфа (ФНО-α), интерлейкин-6 (ИЛ-6) и ИЛ-17, которые играют важнейшую роль в усилении дифференцировки остеокластов и индукции остеопоротических изменений. Особое значение они приобретают в патогенезе вторичного ОП у пациентов с воспалительными заболеваниями [15].
Возникновение и прогрессирование ОП, низкотравматических переломов ассоциируется с различными экзогенными и эндогенными факторами, коморбидными состояниями и хроническими воспалительными заболеваниями. Установлено, что ревматоидный артрит, сахарный диабет, целиакия, хроническая почечная недостаточность, хроническая обструктивная болезнь легких и бронхиальная астма, патология щитовидной и паращитовидной желез, заболевания крови, печени и поджелудочной железы, а также прием противосудорожных препаратов, глюкокортикоидов и многих других лекарственных средств способствует развитию ОП [16].
Не вызывает сомнений, что проживание в северных широтах, дефицит потребления продуктов, содержащих витамин D, возраст старше 65 лет, нарушение функции почек, ожирение и другие коморбидные состояния относятся к причинам гиповитаминоза D, который рассматривается как фактор развития ОП и повышения риска падений и переломов.
Следует отметить, что при выборе медикаментозной терапии ОП препараты кальция и витамина D должны быть обязательным компонентом любой схемы лечения. Суточное поступление кальция (с учетом продуктов питания) должно составлять 1000–1500 мг (безопасная доза). Суточное потребление витамина D колеблется от 800 до 2000 МЕ в зависимости от тяжести ОП, сопутствующих заболеваний и ожирения. При этом людям старше 65 лет при снижении клиренса креатинина ниже 60 мл/мин вместо нативного витамина D рекомендованы активные метаболиты или аналоги витамина D [16].
По мнению диетологов, физиологическая потребность в витамине D для детей и взрослых составляет 10 мкг/сут, а для лиц старше 60 лет – 15 мкг/сут. Однако среднее его «потребление» в разных странах колеблется от 2,5 до 11,2 мкг/сут, т.е. не обеспечивает суточную потребность и создает предпосылки для возникновения его дефицита [17]. Дефицит витамина D определяется по содержанию 25(OH)D в сыворотке крови при значениях <20 нг/мл; концентрация 25(OH)D >20 нг/мл, но <30 нг/мл расценивается как «недостаточность» витамина D, >30 нг/мл – как оптимальный уровень витамина D [18–20].
В кишечнике витамин D регулирует активное всасывание кальция, поступающего с пищей. Недостаток витамина D сопровождается нарушением абсорбции Ca2+, что может вызвать пролиферацию клеток паращитовидной железы и увеличение секреции паратиреоидного гормона, а также возникновение вторичного гиперпаратиреоза, резорбцию кости, нарушение процессов ремоделирования и минерализации костной ткани, снижение ее плотности и изменение костной архитектуры. Все это создает предпосылки для развития ОП и повышения риска переломов [21].
В почках витамин D, наряду с другими кальциемическими гормонами, регулирует реабсорбцию кальция в петле нефрона. Также витамин D повышает активность остеобластов, способствует минерализации костного матрикса, формированию микромозолей в костях и заживлению микропереломов, что повышает прочность и плотность костной ткани [21].
Уменьшение содержания витамина D ведет к нарушению функции нервно-мышечного аппарата, так как проведение импульсов с двигательных нервов на поперечнополосатую мускулатуру и сократимость последней являются кальций-зависимыми процессами. Рецепторы к витамину D присутствуют в мембране мышечных клеток, где регулируют транспорт кальция и фосфата, а также в ядре клеток, где участвуют в производстве энергии для сокращения мышцы. Недостаточность витамина D ассоциируется с нарушением двигательной активности, координации движений и, как следствие, повышает риск падений, прежде всего у пожилых пациентов. Метаанализ рандомизированных контролируемых исследований (РКИ) показал значительное снижение риска падений при приеме препаратов витамина D по сравнению с пациентами в группе контроля [22].
Для профилактики и лечения ОП и дефицитных состояний витамина D широко используется как нативный витамин D, так и химически синтезированные лекарства, являющиеся его аналогами. Эта группа препаратов относится к числу наиболее хорошо переносимых и безопасных средств для лечения состояний, связанных с нарушением кальций-фосфорного обмена, и заболеваний опорно-двигательного аппарата, таких как первичный и вторичный ОП, рахит, остеомаляция. При индивидуальном подборе доз препаратов витамина D на основе оценки уровня кальция в плазме крови риск развития побочных эффектов минимален.
НЕ ТОЛЬКО D, НО И K
Витамин К – еще один жирорастворимый витамин, который участвует в метаболизме костной ткани. Существуют две основные формы этого витамина – К1 (филлохинон) и К2 (менахинон), которые обладают разной химической структурой, периодом полувыведения, внепеченочной активностью и источниками поступления. Обе они имеют общий механизм действия.
Основной и наиболее изученный механизм действия витамина К связан с ферментом гамма-глутамилкарбоксилазой, кофактором которого он является. Этот фермент катализирует превращение остатков глутаминовой кислоты в витамин K-зависимых белках в гаммакарбоксиглутаминовую кислоту. Этот процесс является ключевым для витамин К-зависимых протеинов. Всего известно 17 витамин К-зависимых белков, 5 из которых участвуют в костном обмене, другие же необходимы для поддержания нормального свертывания крови и работы сердечно-сосудистой системы [23]. Имеются данные о протективной «антикальцифицирующей» роли витамин К-зависимых матриксных белков в сосудистой стенке, снижающих прогрессирование кальцификации сосудов и атеросклероза [24].
В настоящее время активно изучается роль витамина К в костном метаболизме. Установлено, что он влияет как на костеобразование, так и на деструкцию: стимулирует пролиферацию и дифференцировку остеобластов, необходим для минерализации костного матрикса, активации остеокальцина, матриксных белков, периостина и повышения активности костной щелочной фосфатазы. Кроме того, витамин К препятствует костной деструкции путем индукции апоптоза остеокластов и ингибирования NF-κB-зависимой активации остеокластов [25–28].
Наиболее изученная функция витамина К в формировании костной ткани – участие в активации остеокальцина (основной неколлагеновый белок), который синтезируется остеобластами в биологически «неактивной» форме и требует посттрансляционной модификации. Не полностью карбоксилированный или недокарбоксилированный остеокальцин характеризуется низкой аффинностью к кристаллам гидроксиапатита, вследствие чего обладает меньшим сродством к костной ткани и циркулирует в крови. Переход в «активную» форму происходит под действием витамин К-зависимого фермента гамма-глутамилкарбоксилазы. Карбоксилированный остеокальцин связывает ионы кальция и выступает ключевым «цементирующим» фактором при связывании коллагена с минеральными компонентами кости.
Также установлено, что «активные» формы витамин К-зависимых протеинов, в первую очередь матриксные GLA белки, препятствуют отложению солей кальция в сосудистой стенке и способствуют перераспределению Ca2+ в костную ткань. Таким образом, помимо непосредственного влияния на костную ткань, достаточный уровень витамина К может не только снижать риск нежелательных явлений терапии препаратами кальция, но и улучшать их поступление в костные структуры [23].
Распространенность и частота дефицита и недостаточности витамина К в популяции зависят от региона проживания, возрастной структуры населения, характера питания, заболеваемости хроническими неинфекционными заболеваниями, приема лекарственных препаратов (в первую очередь антагонистов витамина К и многих других условий). По результатам голландского исследования PREVEND (Prevention of Renal and Vascular End-Stage Disease), в которое вошли все жители г. Гронингена в возрасте 28–75 лет с данными об уровне дефосфонекарбоксилированного матричного GLA-белка (n=4275, исключая беременных и больных сахарным диабетом 1 типа), частота недостаточности витамина К составила 30%. При этом среди лиц пожилого возраста или с коморбидными патологиями (артериальная гипертензия, сахарный диабет 2 типа, хроническая болезнь почек и сердечно-сосудистые заболевания) частота этого состояния была еще выше и составила 50%. Авторы исследования отметили, что чем выше была полиморбидность, тем больше встречался недостаточный уровень витамина К (>50%) [29]. Связь уровня непрямых маркеров витамина К с возрастом и коморбидностью была обнаружена и в других исследованиях [30].
В целом ряде исследований также установлено, что дефицит и недостаточный уровень витамина К в организме ассоциируется с более низкой минеральной плотностью кости (МПК), нарушением ее качества и более высоким риском развития основных остеопоротических переломов [31–34]. На основании результатов РКИ и метаанализов, большинство из которых были выполнены в Японии, в 2011 г. Японское общество по остеопорозу (Japan Osteoporosis Society) выпустило национальные клинические рекомендации, предписывающие ежедневный прием витамина К в дозе 250–300 мкг совместно с препаратами кальция и витамина D3 для профилактики и лечения ОП [35].
Справедливости ради следует отметить, что в других исследованиях [36–37] не установлено значимого влияния витамина К на минеральную плотность кости и риск переломов, поэтому во многих клинических гайдлайнах отсутствуют упоминания о целесообразности его приема. Впрочем, большинство исследований по данной теме имело значительные ограничения – небольшие размеры выборок, разные методы определения концентрации витамина К, разные дозы и формы этого витамина, что затрудняет их сравнение и общую оценку. В литературе нет единого мнения о влиянии пероральных антагонистов витамина К (в первую очередь варфарина) на риск развития переломов. Однако прием прямых оральных антикоагулянтов, механизм действия которых не связан с витамином К, ассоциируется с меньшим риском развития переломов по сравнению с варфарином, и рекомендован больным с установленным диагнозом ОП, факторами риска ОП и переломов [38].
ВЛИЯНИЕ НА КОСТНУЮ ТКАНЬ МАКРО- И МИКРОЭЛЕМЕНТОВ
При изучении остеогенеза и условий качественного формирования максимальной пиковой костной массы установлено, что значительно влияние на них оказывает обеспеченность организма не только витаминами и белком, но и макро- и микроэлементами [39–41]. Субклинический дефицит этих веществ, обусловленный их недостаточным поступлением с пищей или пониженной абсорбцией, может стать фактором снижения МПК. Особая роль при этом отводится таким эссенциальным микроэлементам, как медь, цинк, марганец, и условно эссенциальному микроэлементу бору.
Медь, марганец, цинк как кофакторы ферментов, ответственных за синтез коллагена и гликозаминогликанов, непосредственно участвуют в синтезе костного матрикса [42]. Кроме того, цинк входит в состав более 300 ферментов и вовлечен в процессы синтеза и распада углеводов, белков, жиров, нуклеиновых кислот. Недостаточное его потребление приводит к анемии, вторичному иммунодефициту, циррозу печени, половой дисфункции, наличию пороков развития плода. В комплексе с аминокислотой цистеином цинк принципиально важен для экспрессии генов, поскольку так называемые цинковые пальцы образуют центральную структуру ДНК-связывающих доменов рецепторов гормональной формы витамина D, эстрогенов, прогестерона. Инсулин, кортикотропин, соматотропин и гонадотропин являются цинк-зависимыми гормонами [43].
Костная ткань содержит основной запас (около 30%) цинка всего организма [44, 45]. Концентрация этого микроэлемента в костной ткани быстро снижается при недостаточном его поступлении или усвоении. Поэтому не удивителен тот факт, что дефекты развития костной системы человека обусловлены дефицитом цинка, а также энтеропатическим акродерматитом – наследственным врожденным нарушением его абсорбции [46].
Среднее потребление (поступление в организм) цинка составляет от 7,5 до 17,0 мг/сут, при этом физиологическая потребность для взрослых составляет 12 мг/сут, а для детей – от 3 до 12 мг/ сут. Пищевыми источниками цинка служат говядина, печень, морские продукты (устрицы, сельдь, моллюски), зерновая завязь, морковь, горох, отруби, овсяная мука, орехи [18].
Значение меди для организма состоит не только в определении активности ферментов, обладающих окислительно-восстановительной активностью и участвующих в метаболизме железа, стимулировании усвоения белков и углеводов, но и в процессах обеспечения тканей организма человека кислородом. Медь выступает кофактором для лизилоксидазы и необходима для межмолекулярной связи коллагена и эластина; как основной компонент миелиновой оболочки, он участвует в образовании коллагена, минерализации скелета, синтезе эритроцитов, образовании пигментов кожи. К клиническим проявлениям недостаточного потребления меди относятся нарушения формирования и функции сердечно-сосудистой системы, скелета, развитие дисплазии соединительной ткани. Дефицит меди влечет за собой угнетение роста кости и ОП, что наблюдается при болезни Менкина, заключающейся во врожденной неспособности поглощать медь [47].
Суточная потребность в меди колеблется от 0,9 до 3,0 мг/сут. Физиологическая потребность для взрослых составляет 1,0 мг/сут, для детей – от 0,5 до 1,0 мг/сут. Пищевые источники меди – шоколад, какао, печень, орехи, семечки, грибы, моллюски, лосось, шпинат [18].
Недостаточное потребление и поступление в организм марганца сопровождается замедлением роста, нарушениями в репродуктивной системе, повышенной хрупкостью костной ткани, расстройствами углеводного и липидного обмена. Связано это с тем, что марганец принимает непосредственное участие в образовании костной и соединительной ткани, входит в состав ферментов, включающихся в метаболизм аминокислот, углеводов, катехоламинов, необходим для синтеза холестерина и нуклеотидов.
Пищевыми источниками марганца являются зеленые листовые овощи, продукты из неочищенного зерна (пшеница, рис), орехи, чай. Среднее потребление микроэлемента с продуктами питания колеблется от 1–10 мг/сут. Установленные уровни потребности в марганце составляют 2–5 мг/ сут, физиологическая потребность для взрослых – 2 мг/сут [18].
Роль бора в процессах остеогенеза определяется непосредственным влиянием на метаболизм витамина D, а также регуляцией активности паратиреоидного гормона, который, как известно, ответственен за обмен кальция, фосфора, магния. Это позволяет полагать, что воздействие бора на метаболизм костной ткани сопоставимо с витамином D. Суточная потребность в нем составляет 2–3 мг/ сут, бор содержится в корневых овощах, винограде, грушах, яблоках, орехах, пиве [18].
МИКРОЭЛЕМЕНТЫ И ЗАБОЛЕВАНИЯ КОСТНОЙ СИСТЕМЫ: ДОКАЗАТЕЛЬНАЯ БАЗА
Круг исследований, посвященных изучению уровня микроэлементов при патологии костной системы, к настоящему времени довольно узок. Сообщается о корреляции содержания минералов в костях предплечья с усвоением цинка у женщин в постменопаузе, что свидетельствует о влиянии Zn2+ на сохранение костной массы [47]. Другие исследователи показали, что усвоение этого микроэлемента снижается с возрастом, особенно у женщин, и отрицательно коррелирует с потерей костной массы в постменопаузе [48]. Выявлено повышение экскреции цинка с мочой у женщин с ОП по сравнению с женщинами контрольной группы соответствующего возраста [49, 50]; это может быть связано с повышенной резорбцией кости [51], которая ведет к освобождению цинка из костной ткани. Lowe N.M. et al. [52] сообщили о том, что концентрация Zn2+ в крови (а также относительная его абсорбция) у пожилых женщин с ОП была статистически значимо ниже (р <0,05), чем у молодых женщин. Другие авторы обнаружили, что уровень цинка в сыворотке крови был ниже у пациенток с постменопаузальным ОП относительно контрольной группы [53, 54].
Особый интерес представляет работа коллектива соавторов из 4 центров (Франции, Италии и Северной Ирландии) по изучению взаимосвязи между показателями нутритивного статуса цинка и биохимических маркеров ремоделирования кости у европейцев в возрасте 55–87 лет. Двойное слепое многоцентровое проспективное РКИ ZENITH продолжительностью 6 мес включало 387 здоровых мужчин и женщин. У всех пациентов определялась концентрация цинка в крови и моче, костно-специфическая щелочная фосфатаза и остеокальцин в сыворотке крови (маркеры формирования костной ткани), пиридинолин и дезоксипиридинолин в моче (маркеры резорбции кости). Результаты показали, что у большинства пациентов ремоделирование было нормальным, без признаков патологического разделения процессов формирования кости и резорбции кости. Усвоение цинка отрицательно коррелировало с концентрацией пиридинолина и дезоксипиридинолина в моче (r=-0,298 и -0,304 соответственно; р=0,0001), не было установлено корреляции с маркерами формирования кости. Прослеживалась тенденция отрицательной корреляции цинка в сыворотке с дезоксипиридинолином в моче (r=-0,211; р=0,080). Цинк в эритроцитах имел отрицательную корреляцию с остеокальцином в сыворотке (r= -0,090; р= 0,0001). После учета вмешивающихся факторов (возраст, пол и исследовательский центр) осталась единственная статистически значимая корреляция между остеокальцином в сыворотке и цинком в эритроцитах (ß =-0,124; р=0,011).
Таким образом, были получены некоторые данные о взаимосвязи между нутритивным статусом цинка и ремоделированием кости у здоровых взрослых [55].
Исследование турецких ученых было посвящено изучению содержания магния, цинка и меди в сыворотке крови женщин с постменопаузальным ОП, остеопенией и нормальной МПК шейки бедра [56]. Было установлено, что концентрация магния и цинка у женщин с ОП значимо ниже, чем у женщин с остеопенией и у здоровых женщин; при этом концентрация магния и цинка у женщин с остеопенией также была статистически значимо ниже, чем у здоровых женщин. Статистически значимого различия между группами по концентрации меди не получено. Высказано мнение о том, что поступление микроэлементов, особенно магния, цинка и, вероятно, меди, может оказать благоприятное воздействие на плотность костной ткани.
В других исследованиях не обнаружено значимого различия концентрации магния, цинка, селена и марганца в крови и эритроцитах постменопаузальных женщин как с ОП, так и без него [57, 58]. Bureau I. et al. сообщили о том, что нет статистически значимого различия в уровне селена в сыворотке крови у женщин в постменопаузе, которые принимают гормонозаместительную терапию, и у женщин, которые не получают лечение [59].
Во многих странах уровень магния, меди, цинка, марганца, селена и бора у пациенток с ОП не имеет точного значения и определения. Некоторые исследователи сообщают о снижении уровня этих микроэлементов, в то время как другие утверждают обратное. Концентрацию того или иного вещества в плазме или сыворотке крови принято рассматривать в качестве показателя его уровня в организме. Однако известно, что такой показатель не надежен, поскольку может наблюдаться одновременное воздействие нескольких факторов, которые не имеют отношения к содержанию веществ в организме, например, приема лекарственных средств (гормонозаместительной терапии, диуретиков, слабительных препаратов и др.). Подобная ненадежность объясняет противоречивость информации в литературе относительно уровня микроэлементов в плазме крови у пожилых людей.
ПОТЕНЦИАЛ ИСПОЛЬЗОВАНИЯ ИСТОЧНИКОВ ОСТЕОТРОПНЫХ МИКРОЭЛЕМЕНТОВ В КОРРЕКЦИИ ОСТЕОПОРОЗА
Интерес к изучению связи между остеотропными микроэлементами, характеристикой костной ткани и возможностью использования для коррекции ОП препаратов, в состав которых входят эти микроэлементы, очевиден. Так, отечественными педиатрами проведено изучение статуса микроэлементов и показателей МПК различных отделов скелета у 100 подростков [60]. При обследовании были обнаружены сдвиги в содержании бора, меди, марганца и цинка в сыворотке пациентов, а у 46 подростков была выявлена остеопения. Авторам удалось установить связь между содержанием микроэлементов в волосах и МПК, проанализировать возможность воспроизведения состояния МПК через комплекс исследуемых микроэлементов. Была предпринята попытка коррекции микроэлементоза и кальциевого обмена с помощью витаминно-минерального комплекса, применявшегося в стандартной суточной дозировке (1000 мг кальция, 400 МЕ холекальциферола, 80 мг магния, 15 мг цинка, 2 мг меди, 3,6 мг марганца и 500 мкг бората натрия) или в индивидуально подобранной суточной дозе в зависимости от суточного потребления кальция с продуктами питания, возрастной суточной потребности, а также наличия факторов риска остеопении и степени лабораторно подтвержденного микроэлементоза. Продолжительность приема препарата составляла не менее 8–12 мес. Исследование микроэлементов проводилось до назначения препарата и после окончания приема. Авторы сделали вывод, что для коррекции остеопении и для профилактики ее развития целесообразно назначение комбинированных препаратов, содержащих не только кальций и витамин D3, но и микроэлементы.
Другое российское исследование было посвящено изучению эффективности и переносимости витаминно-минерального комплекса при остеопении у женщин в постменопаузе. В многоцентровое открытое контролируемое исследование вошли 100 женщин в возрасте от 45 до 65 лет. Пациентки были случайно разделены на 2 сопоставимые по основным показателям группы:
- первая (основная) группа (n=50) получала витаминно-минеральный комплекс из расчета 1000 мг кальция/сут, 400 МЕ холекальциферола/ сут, 80 мг магния/сут, 15 мг цинка/сут, 2 мг меди/сут, 3,6 мг марганца/сут и 500 мкг бората натрия/сут;
- вторая (контрольная) контрольная (n=50) не получала терапию, но выполняли рекомендации по питанию.
Продолжительность исследования составила 1 год.
Анализ МПК через 12 мес наблюдения показал, что в группе, получавшей терапию, отмечалось стабильное состояние костной ткани, тогда как в контрольной группе МПК уменьшилась во всех исследуемых участках скелета, особенно в поясничном отделе позвоночника. Авторы сделали вывод, что препарат оказывает стабилизирующее влияние на МПК скелета, не вызывает гиперкальциемии и повышения экскреции кальция с мочой при длительном использовании, хорошо переносится и может быть рекомендован для коррекции постменопаузального ОП и восполнения дефицита микроэлементов [61].
В России зарегистрирован новый витаминно-минеральный комплекс Кальцирен (биологически активная добавка) с апельсиновым и лимонным вкусом, в состав которого входят витамины D и К, кальций, магний, марганец, цинк, бор и медь. Кальцирен может применяться при недостаточном поступлении кальция и/или витамина D3 с пищей, при повышенной потребности организма в кальции и витамине D3, травмах опорно-двигательного аппарата, а также в составе комплексной программы коррекции ОП у женщин в период менопаузы и лиц пожилого возраста. Витаминно-минеральный комплекс Кальцирен принимают по 1–2 табл. 2 раза/сут, разжевывая во время еды; продолжительность курса приема для взрослых составляет 1 мес. Рекомендуется/возможно проведение нескольких курсов в год.
Соблюдение рекомендаций по режиму дозирования витаминно-минерального комплекса Кальцирен (4 табл. в сутки) позволит обеспечить ежедневное поступление 15 мгк (600 МЕ) витамина D, 250 мкг витамина К, 1000 мг кальция, 150 мг магния, 5 мг марганца, 15 мг цинка, 2 мг бора и 1,5 мг меди, что в значительной мере восполнит суточную потребность организма в витаминах и минералах без превышения допустимого уровня потребления. Важной особенностью комплекса является то, что он содержит кальций в форме цитрата, который обладает большей (в 2,5 раза) биодоступностью по сравнению с карбонатом и не только способствует более высокому пику подъема уровня кальция в крови, но и существенно уменьшает выброс Ca2+ с мочой [62].
Отдельно следует отметить, что у лиц старшего возраста, когда особенно высока потребность в препаратах кальция для профилактики и лечения ОП, кислотность желудка, как правило, пониженная (у 40% людей после 50 лет) или нулевая. В этих условиях усвоение карбоната кальция падает до 2%, так как для его растворения в желудке необходима соляная кислота. В то же время усвоение цитрата кальция составляет 44%, поскольку для его растворения в желудке соляная кислота не требуется. Таким образом, в условиях пониженной кислотности из цитрата кальция в организм поступает в 11 раз больше кальция, чем из карбоната [63, 64].
ЗАКЛЮЧЕНИЕ
Учитывая вышеизложенное, можно предположить, что применение Кальцирена в комплексной коррекции ОП будет способствовать нормализации минерального гомеостаза, улучшению состояния структуры костной ткани, стабилизации и увеличению минеральной плотности кости, предупреждению возникновения переломов. По мере накопления и расширения опыта использования витаминно-минерального комплекса в клинической практике появится возможность проведения дополнительного анализа.



