Кальцинирующая болезнь аортального клапана (КБАК) – хроническое, прогрессирующее заболевание, в основе которого лежит фиброз и кальцификация створок аортального клапана. На начальных стадиях происходит утолщение аортальных полулуний и отложение в них микрокальцинатов (этап аортального склероза), в дальнейшем створки клапана деформируются и создают препятствие трансаортальному кровотоку – формируется аортальный стеноз. Заболевание широко распространено среди людей пожилого возраста и нередко патогенетически ассоциируется с атеросклерозом [1, 2]. Однако, согласно данным рандомизированных клинических исследований, липидснижающая терапия статинамии и фибратами не замедляет прогрессирование КБАК [3], что диктует необходимость поиска новых звеньев патогенеза и терапевтических мишеней.
Нарушения минерального метаболизма распространены среди людей старшего возраста и потенциально задействованы в формировании КБАК [4]. В частности, при хронической болезни почек, когда электролитные расстройства особенно выражены, высокие уровни кальция и фосфатов значимо повышают риск развития клапанной сердечной патологии [5]. Кроме того, первичный гиперпаратиреоз ассоциируется с риском аортального стеноза [6]. Эти данные позволяют предположить, что некоторые особенности кальциевого обмена могут определять предрасположенность к КБАК и в общей популяции пациентов, не страдающих тяжелой сопутствующей патологией.
Целью исследования явилась проверка гипотезы о возможной взаимосвязи уровней ряда индикаторов кальциевого метаболизма (паратиреоидного гормона, витамина Д и ионизированного кальция) с развитием КБАК.
МАТЕРИАЛ И МЕТОДЫ
Исследование по принципу «случай–контроль» проведено на базе Краевого клинического кардиологического диспансера г. Ставрополя. Протокол исследования соответствовал принципам Хельсинской декларации и был одобрен локальным этическим комитетом. Скринингу подверглись 2086 больных, находившихся на стационарном лечении в 2012–2013 гг. В исследование были включены 108 пациентов с кальцинозом трехстворчатого аортального клапана в возрасте старше 65 лет (47% мужчин, средний возраст 71±7,3 года). Кальциноз аортального клапана верифицировали с помощью трансторакальной эхокардиографии. Диагноз аортального стеноза устанавливали в соответствии с международными рекомендациями [7]. Критериями исключения являлись врожденные аномалии аортального клапана и/или хирургическая коррекции пороков в анамнезе, хроническая ревматическая болезнь сердца, хроническая почечная недостаточность, заболевания паращитовидных желез, онкологическая патология. В качестве группы сравнения обследованы 58 пациентов без признаков поражения аортального клапана, сопоставимые с основной группой по полу, возрасту и клинико-анамнестическим характеристикам, а также по распространенности сердечно-сосудистой патологии и получаемой медикаментозной терапии. Все участники исследования подверглись стандартному клинико-лабораторному и инструментальному кардиологическому обследованию. Сывороточную концентрацию человеческого интактного паратиреоидного гормона (ПГ), 25-гидрокси витамина Д, определяли методом ИФА при помощи диагностических наборов GenWay hPTH-EASIA (DiaSource, USA) и HUMAN FETUIN-A ELISA (BioVendor Laboratory Medicine, USA), IDS OCTEIA 25-Hydroxy Vitamin D (IDS, USA) согласно прилагаемым инструкциям.
Статистический анализ выполняли при помощи IBM SPSS Statistics 21,0 for Windows (IBM SPSS Inc., USA). При нормальном распределении значений в вариационном ряду признаки представляли в виде среднего арифметического и стандартного отклонения (M±σ), межгрупповые различия оценивали при помощи однофакторного дисперсионного анализа с вычислением критерия Фишера. В случае ненормального распределения данные представляли в виде медианы и интерквартильного размаха (Me (Q1–Q3)), различия между группами анализировали при помощи U-критерия Манна–Уитни. Вычисляли ранговый коэффициент корреляции Спирмена r. Качественные признаки представляли в виде абсолютного значения и доли в процентах. При сравнении долей использовали критерий χ2 и точный критерия Фишера. Статистически значимыми считали различия при р <0,05.
РЕЗУЛЬТАТЫ
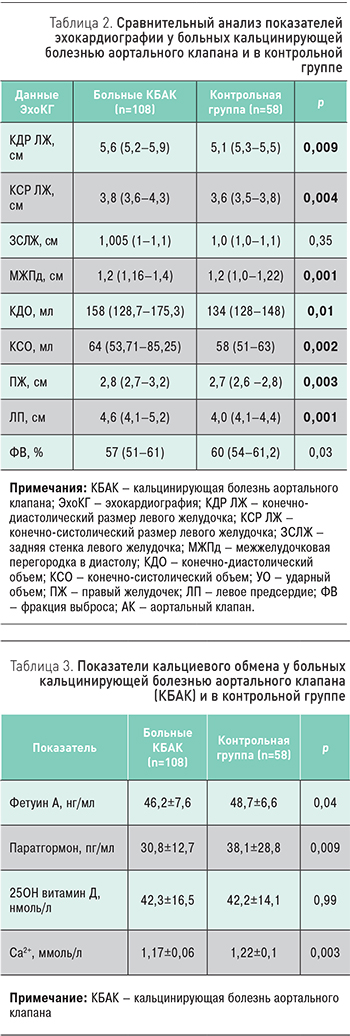
Распространенность сердечно-сосудистой патологии и факторов риска сердечно-сосудистых заболеваний в исследованных группах не различались (табл. 1), за исключением фибрилляции предсердий, которая достоверно чаще встречалась при КБАК (р=0,04), как правило, в виде коротких, самокупирующихся бессимптомных пароксизмов, по данным суточного мониторирования ЭКГ.
По данным ЭхоКГ, в основной группе были значимо большими размеры и объемы левого желудочка, толще межжелудочковая перегородка, а также отмечалось увеличение правого желудочка и левого предсердия. Фракция выброса левого желудочка при КБАК была ниже, чем в контроле (табл. 2).
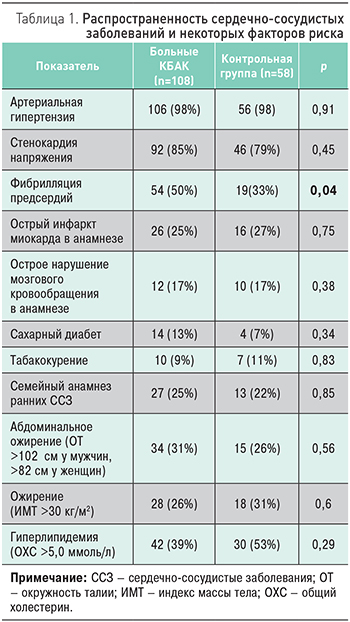
У больных КБАК были достоверно ниже сывороточные концентрации паратгормона и ионизированного кальция. Уровни же 25ОН витамина D значимо не различались (табл. 3). Уровень 25ОН витамина D был достоверно ниже у женщин, чем у мужчин, как в основной (39,3±14,0 против 45,8±18,5, р=0,04), так и в контрольной (37,0±14,2 против 45,6±13,14, р=0,02) группах.
По данным корреляционного анализа, уровни паратгормона и 25ОН витамина D не были ассоциированы с параметрами ЭхоКГ и лабораторными показателями.
ЗАКЛЮЧЕНИЕ
Таким образом, в исследованной нами выборке больных сердечно-сосудистыми заболеваниями наличие кальцинирующей болезни аортального клапана ассоциировалось с более низкими сывороточными концентрациями паратгормона, фетуина А и ионизированного кальция, что может свидетельствовать об их патогенетической роли при данном заболевании.