ВВЕДЕНИЕ
Хронические заболевания зачастую сопровождаются комплексной недостаточностью эссенциальных микронутриентов, в т. ч. витаминов. Одни заболевания негативно сказываются на количестве потребляемой пищи (например, из-за отсутствия аппетита, трудностей, связанных с приемом пищи и др.), вследствие чего поступление витаминов падает. Другие заболевания сопровождаются снижением усвоения витаминов (гастрит, гастродуоденит, патологии печени, дисфункция поджелудочной железы, кишечные инфекционные заболевания). Существуют также патологические состояния, приводящие к значительной потере витаминов (хроническая диарея, хроническая почечная недостаточность, гипертермия, инфекции) или к повышению потребности в них (травмы, ранения, послеоперационный период). Кроме того, многие фармацевтические препараты негативно влияют на обмен витаминов (антибиотики, противоопухолевые препараты, эстрогены, антиконвульсанты, иммуносупрессанты и др.) [1].
В настоящей работе представлены результаты систематического анализа практически всей имеющейся научной литературы (зарегистрированной в базе данных PUBMED) по использованию витаминов в условиях многопрофильного стационара. Следует отметить, что данная область исследований по витаминам в настоящее время накопила большой массив данных доказательного характера, но эти данные требуют систематизации.
В тоже время, мало исследован даже сам вопрос о распространенности дефицитов витаминов среди пациентов, поступающих в стационар и выписывающихся из него. В одном исследовании пациентов, находившихся в критическом состоянии, которые поступили в отделение интенсивной терапии (ОИТ; n=129), собирались данные о них, включая диагноз, тяжесть болезни, концентрации С-реактивного белка, витаминов А, Е, В1, В12 и фолатов в артериальной крови. У 55 пациентов (43%) был установлен дефицит, по крайней мере, одного из 5 витаминов. Корреляции между более высокими концентрациями С-реактивного белка и дефицитами витаминов были продемонстрированы для витаминов В12, А и Е (р <0,007) [2].
Эффекты воздействия тех или иных терапевтических процедур на дефициты витаминов также остаются практически не систематизированными. Например, что сочетанный дефицит нескольких витаминов является известным осложнением у пациентов, перенесших оперативное вмешательство на желудке [3]. Достаточная обеспеченность витамином С ассоциирована со снижением смертности в гериатрической больнице [4] и др.
Фармакоэкономическое исследование, включившее данные о 44 млн эпизодов госпитализации взрослых, проводимое ретроспективно в течение 11 лет, показало целесообразность использования микронутриентной поддержки пациентов стационара. У пациентов, получавших микронутриентную поддержку, длительность госпитализации снижалась на 2,3 сут. (95% доверительный интервал 2,2-2,4), а средняя стоимость пребывания в госпитале уменьшалась на 22% [5].
Следует отметить, что исследования по медицинским и биологическим эффектам витаминов и других микронутриентов проводятся уже более 80 лет. В результате, получен огромный массив научно-исследовательских публикаций по биологическим и медицинским эффектам витаминов, в т. ч. при их использовании в условиях госпиталя. Например, в базе данных PUBMED общее число публикаций, рубрицированных с использованием термина «vitamin», превышает 500 000, по исследованиям эффектов дефицитов витаминов по отношению к многопрофильному стационару – более 50 100 (например, запрос «vitamin AND (hospital OR adjunctive therapy OR trauma)»). Анализ всего это массива результатов научных исследований «вручную» не представляется возможным даже для большой группы экспертов. Поэтому, в настоящей работе анализ массива из 50 100 публикаций был проведен с использованием современных методов компьютерного обучения, развиваемых в рамках алгебраического подхода к распознаванию для целей систематического анализа научной литературы.
МАТЕРИАЛ И МЕТОДЫ
Для выделения релевантных публикаций в таком достаточно большом массиве данных были использованы математические методы распознавания и машинного обучения, разрабатываемые в научной школе академика Ю.И. Журавлева. Системы машинного обучения оперируют со множествами прецедентов, представляющих собой материал обучения алгоритма. Отдельный прецедент (в нашем случае, абстракт научной публикации или ее полный текст) состоит из признакового описания (т. е. слов в составе текста) и информации о принадлежности этого объекта к определенному классу объектов (допустим, класс К1 «тексты по использованию витаминов в условиях многопрофильного стационара» и класс К2 «контрольная выборка», т. е. тексты, не имеющие непосредственного отношения к изучаемой теме). Классы принадлежности объектов, естественно, задаются экспертом-медиком.

Был проведен анализ массива из абстрактов 50 100 публикаций, найденных в PUBMED по запросу «vitamin AND (hospital OR adjunctive therapy OR trauma)». Данная выборка абстрактов сформировала класс К1 («тексты по теме»); в качестве контрольной выборки (класс К2 , «контроль») были использованы абстракты, найденные по запросу «hospital OR adjunctive therapy OR trauma» (всего 4 726 113 ссылок, случайно выбраны 50 000 абстрактов).
Для оценки ассоциаций ключевых слов с изучаемой темой (т. е. использование витаминов в условиях многопрофильного стационара) были применены математические методы анализа разрешимости [6-8]. Под разрешимостью задач понимается непротиворечивость множеств прецедентов (т. е. существования решения у задачи).
В целом, использованный для анализа научных статей алгоритм выглядит следующим образом:
(А) Экспертом создаются выборки публикаций (абстрактов) из множества всех публикаций, имеющихся в базах данных, соответствующие исследуемым классам К1 и К2. Например, текстами в классе К1 являлись абстракты публикаций, найденных в PUBMED (http://www.ncbi.nlm.nih.gov/pubmed/) по запросу «vitamin AND (hospital OR adjunctive therapy OR trauma)»; текстами в классе К2 – случайно выбранные абстракты из множества абстрактов, найденных по запросу «hospital OR adjunctive therapy OR trauma».
(Б) В абстрактах отсеиваются общезначимые слова (в английском тексте, артикли, частицы, общие термины и т.д.) и термины, использованные при создании выборок текстов К1 и К2 (в нашем случае, это термины «vitamin», «hospital» и др.) и формируется терминологический словарь. Для настоящего исследования, терминологический словарь был сформирован из всех терминов предложений из класса К1. Затем проводится тестирование критерия и устанавливаются наиболее информативные значения признаков (т. е. определенные специальные термины). Для каждого из терминов вычисляется ряд параметров, описывающих его информативность относительно классов К1 и К2: Dинф – значение оценки информативности ключевого слова для различения выборок К1 и К2, α – порядковый номер ключевого слова при упорядочении всех слов по значениям Dинф.
(В) Полученный список наиболее информативных ключевых слов (которые принципиально необходимы для отличения каждого текста из К1 от каждого текста из К2) анализируется и рубрицируется экспертом-медиком, анализируются парные взаимодействия терминов, применяются дополнительные терминологические фильтры.
(Г) Проводится новый поиск литературы с использованием установленных уточненных наборов наиболее информативных ключевых слов.
РЕЗУЛЬТАТЫ
В результате анализа установленных информативных терминов (таблица) были составлены уточненные поисковые запросы, на основе которых был сформирован список из 35 репрезентативных исследований, описывающих различные аспекты использования витаминов в условиях многопрофильного стационара.
Полученный набор информативных ключевых слов позволил рубрицировать все имеющиеся публикации по использованию витаминов в условиях многопрофильного стационара и выделить 9 основных направлений исследований:
- адъювантная фармакотерапия (терапия, дозировка лекарств, побочные эффекты, антинеопластическая, химиотерапия, осложнения, профилактика, выживание пациентов);
- эффекты витамина D (витамин D, кальций, кальцитриол, холекальциферол, кость, остеопороз, переломы);
- эффекты витаминов группы В (фолиевая кислота, гомоцистеин, ниацинамид, ниацин, пиридоксин, кобаламин, рибофлавин, тиоктовая кислота, тиамин, пантотеновая кислота);
- эффекты микронутриентов-антиоксидантов (антиоксидант, селен, аскорбат, альфа-токоферол);
- профилактика анемии (железо, анемия, паратироидная железа);
- профилактика сахарного диабета и его осложнений (диабет, инсулин, магний, цинк);
- профилактика сердечнососудистой патологии (фибрилляция предсердий, коагуляция);
- поддержка систем детоксикации организма (печень, почки);
- снижение системного воспаления (псориаз, астма, ранения).
Охват всего массива имеющихся публикаций по использованиям витаминов в условиях многопрофильного стационара не представляется возможным в рамках одной статьи. Далее, мы последовательно рассмотрим наиболее важные, на наш взгляд, примеры применения определенных витаминов в условиях стационара.
Витамин D
Более 50 лет витамин D используется для стационарного лечения пациентов с переломами, остеопорозом, рахитом и др. Однако он также является одним из важнейших микронутриентов для поддержки иммунной системы [9]. Витамин D ограничивает пролиферацию факторов приобретенного иммунитета (T-клетки, β-клетки) при одновременном стимулировании деления клеток врожденного иммунитета (например, моноцитов). Дотации витамина D с успехом используются в терапии пациентов с туберкулезом, гепатитом С, RS-инфекцией и другими инфекциями [10].
 Помимо терапии туберкулеза, перспективны и многие другие применения витамина D в условиях стационара. В частности, лучшая обеспеченность витамином D соответствует сокращению средней длительности срока пребывания в госпитале (в среднем на 1 неделю; р=0,002) и средней стоимости пребывания в госпитале (на 54%; р=0,027) [11].
Помимо терапии туберкулеза, перспективны и многие другие применения витамина D в условиях стационара. В частности, лучшая обеспеченность витамином D соответствует сокращению средней длительности срока пребывания в госпитале (в среднем на 1 неделю; р=0,002) и средней стоимости пребывания в госпитале (на 54%; р=0,027) [11].
Высокодозная терапия витамином D3 способствует снижению длительности пребывания в госпитале пациентов в критическом состоянии с дефицитом витамина D (n=492, 25(ОН)D ≤20 нг/ мл). Группа пациентов была рандомизирована на назначение витамина D3 (n=249) либо плацебо (n=243). Поскольку ожидалось, что пероральный прием витамина D в дозах до 4000 МЕ/сут не позволит достаточно быстро компенсировать его дефицит у пациентов в ОИТ, то способ введения витамина D3/плацебо был следующим: вводили однократно, через назогастральную трубку, в дозе 540000 МЕ в 15 мл арахисового масла, с ежемесячными поддерживающими дозами 90 000 МЕ в течение 5 месяцев. Больничная смертность была значительно ниже для группы пациентов, проходивших терапию витамина D3 (29%, 95% ДИ 19-38%) по сравнению с плацебо (46%, 95% ДИ 36-56%), поэтому риск смертности был на 44% ниже (отношение рисков 0,56, 95% ДИ 0,35-0,90, р=0,04) [12].
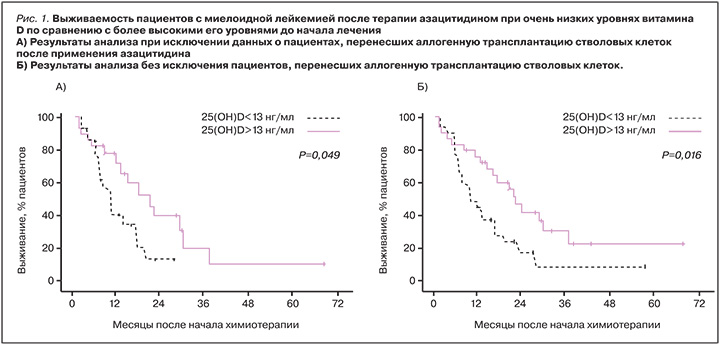
Дотации витамина D являются важным элементом адъювантной терапии опухолевых заболеваний [13, 14]. Низкий уровень витамина D в сыворотке крови ассоциирован с меньшей продолжительностью жизни пациентов с миелодиспластическим синдромом и вторичной олигобластной острой миелоидной лейкемией после лечения азацитином (n=58). Еще до начала применения азацитина средние уровни 25(OH)D у пациентов были крайне низки (13 нг/мл, 95% ДИ 4-25 нг/ мл). Оценочная вероятность выживания пациента в течение 2-х лет составила 14% в подгруппе с тяжелым дефицитом витамина D (≤13 нг/мл, n=29) и 40% в подгруппе со средним его дефицитом (>13 нг/мл; n=29, р <0,05; рис. 1). Добавление наномолярных концентраций 25(OH)D к азацитидину приводило к потенцированию активности противоопухолевого препарата. Таким образом, терапия миелоидной лейкемии обязательно должна сопровождаться дотациями витамина D, особенно при лечении азацитидином [15].
Перспективно применение витамина D и на фоне использования других противоопухолевых препаратов для снижения вызываемых ими побочных эффектов. Например, в эксперименте были продемонстрировано, что совместное использование витамина D и блеомицина снижает блеомицин-индуцированный легочный фиброз и накопление воспалительных клеток [16].
Дотации витамина D модулируют активацию иммунной системы при муковисцидозе. Считается, что стойкий воспалительный ответ в дыхательных путях играет центральную роль в прогрессировании повреждения легких при этом заболевании. Дотации витамина D представляют собой важное направление противовоспалительной терапии, которая может замедлять прогрессирование этого муковисцидоза с минимальными побочными эффектами. Три месяца лечения пациентов (n=16) витамином D было ассоциировано суменьшением частоты встречаемости активированных CD8+ Т-клеток, ко-экспрессирующих активационные маркеры CD38 и лейкоцитарный D-антиген человека (HLA-DR). Таким образом, витамин D обладает сильным плейотропным иммуномодулирующим действием при муковисцидозе [17] и рекомендуется для использования в стационаре.
Эпидемиологические и экспериментальные данные свидетельствуют о том, что низкий уровень витамина D связан с повышенным риском прогрессирования рассеянного склероза и, также, с неблагоприятным течением заболевания. В первую очередь, это обусловлено иммуномодулирующими и нейропротекторными эффектами витамина D. Кроме того, пациенты с рассеянным склерозом склонны к развитию остеопороза и, соответственно, характеризуются повышенным риском переломов. Поэтому, у пациента, поступающего в стационар с обострением данного заболевания, необходимо определить концентрацию 25(OH)D в сыворотке крови и, посредством приема витамина D, вывести ее на уровень не ниже чем 30 нг/мл [18]. Пероральные дозы витамина D при этом не должны превышать 4000 МЕ/сут (за исключением начального лечения очень тяжелого дефицита, 25(OH)D <10 нг/ мл). У пациентов с рассеянным склерозом дотации 3000 МЕ/сут холекальциферола повышают уровни 25(OH)D, в среднем до 44 нг/ мл (Финляндия, Норвегия) [19, 20].
Перспективно использование витамина D в адъювантной терапии астмы, т. к. его дефицит ассоциирован с повышенной гиперчувствительностью дыхательных путей, сниженной легочной функцией, ухудшением контроля над астмой и снижением реакции на стандартную антиастматическую терапию [21].
Дотации витамина D усиливают эффекты лечения анемии у пациентов в терминальной стадии почечной недостаточности на гемодиализе, находящихся в отделении искусственной почки (n=64, 18-76 лет). С целью лечение анемии этим пациентам был назначен эритропоэтин. Установлена статистически достоверная взаимосвязь между дотациями витамина D и снижением потребности пациента в эритропоэтине (р=0,013) [22].
 Дотации витамина D перспективно использовать для лечения вторичного гиперпаратиреоза у пациентов с хроническим заболеванием почек. Вторичный гиперпаратиреоз ассоциирован с повышенным риском сердечнососудистой заболеваемости и смертности. Для пациентов с хроническим заболеванием почек характерна высокая распространенность гиповитаминоза D. При назначении витамина D в адекватных дозах и достаточным по длительности курсом повышается эффективность лечения вторичного гиперпаратиреоза [23].
Дотации витамина D перспективно использовать для лечения вторичного гиперпаратиреоза у пациентов с хроническим заболеванием почек. Вторичный гиперпаратиреоз ассоциирован с повышенным риском сердечнососудистой заболеваемости и смертности. Для пациентов с хроническим заболеванием почек характерна высокая распространенность гиповитаминоза D. При назначении витамина D в адекватных дозах и достаточным по длительности курсом повышается эффективность лечения вторичного гиперпаратиреоза [23].
Клиническое исследование указало на эффективность применения витамина D3 при лечении преэклампсии у женщин в отделении патологии беременных (n=74, в т. ч. 43 с тяжелой преэклампсией). Витамин D3 выступает в качестве конкурентного ингибитора плацентарного цитохрома P450scc, препятствующего перекисному окислению липидов и избыточному синтезу прогестерона (оба фактора лежат в основе патогенеза преэклампсии) [24].
Витамин D эффективен в терапии пациентов с болезненной диабетической невропатией (n=143, возраст 52±12 лет). Была введена однократная доза витамина D (600000 МЕ внутримышечно), оценивалось ее влияние на оценки невропатической боли в течение 20 недель. Введение витамина D приводило к значительному увеличению уровней 25(OH)D (до 46±10 нг/ мл, p <0,0001), снижению болевых симптомов по шкале Douleur Neuropathique 4 (p <0,0001), общей шкале боли (p <0,0001) и опроснику Макгилла (p <0,0001) [25]. Таким образом, коррекция витамина D является важной технологией, повышающей эффективность лечение пациентов в стационаре.
Витамины группы В
Витамины группы B (в частности, витамины B1, B2, РР, B6, фолаты и B12) участвуют в метаболизме белков, липидов и углеводов. Поэтому дефициты этих витаминов приводят к ухудшению энергетического метаболизма и могут способствовать развитию анемии [26], замедлению заживления ран [27], гипергомоцистеинемии и многим другим негативным процессам, замедляющим реабилитацию пациентов. Дотации фолиевой кислоты и витамина B12 способны повышать эффективность лечения пациентов с шизофренией в стационаре [28].
Дотации фолиевой кислоты и витамина В12 нормализуют уровни гомоцистеина у пациентов, госпитализированных в ОИТ для прохождения перитонеального диализа (n=25). Гипергомоцистеинемия присутствовала у 83% пациентов. Дотации фолиевой кислоты и витамина В12 позволили достигнуть снижения уровней гомоцистеина в среднем с 20 до 15 мкмоль/л. Добавление к терапии витамина B6 приводило к дополнительному снижению уровней гомоцистеина (в среднем, до 12,8 мкмоль/л), причем у 72% пациентов его уровень достиг диапазона нормы [29].
Дотации витаминов B12, B6 и фолиевой кислоты в течение 8 месяцев улучшали функцию гематоэнцефалического барьера у пациентов с гипергомоцистеинемией и легкой когнитивной недостаточностью (n=30). Ни одного из пациентов в течение периода лечения в отделении неврологии не отмечалось прогрессирования деменции. Уровни тау-белка в цереброспинальной жидкости несколько снизились, хотя изменение не было статистически значимым [30].
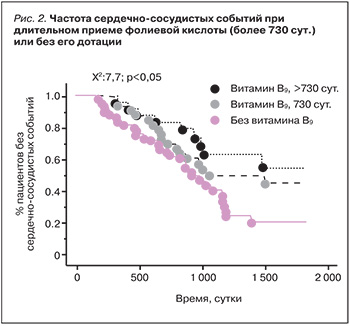
Гомоцистеин-снижающее действие дотаций витаминов группы B способствует снижению сердечнососудистого риска у пациентов, находящихся в ОИТ на гемодиализе (который достаточно высок). Дотации 5 мг/сут фолиевой кислоты в течение 2 лет больным на гемодиализе (n=114) достоверно снизило риск сердечнососудистых событий (41 против 63% в контроле, p=0,05). Анализ кривых Каплана-Мейера подтвердил, что сердечнососудистые события у пациентов, получавших фолиевую кислоту (витамин В9), были достоверно реже (p <0,0001, рис. 2) [31].
Хотя введение цианокобаламина внутримышечно, по-прежнему, является стандартной терапией для компенсации дефицита витамина В12 в условиях стационара, пероральный его прием также оказался эффективен для компенсации его дефицита, например, при болезни Крона. Многоцентровое ретроспективное когортное исследование включило пациентов с болезнью Крона (n=94). У 82% больных прием цианокобаламина (1 мг/сут) позволил нормализовать его уровень в крови. При этом, как показали результаты последующего опроса пациентов, основной причиной отсутствия эффекта от приема цианокобаламина являлось отсутствие комплаентности соответствующих больных. Таким образом, пероральный прием цианокобаламина обеспечивает эффективную компенсацию витамина B12 у пациентов с болезнью Крона, как с резекцией, так и без резекции подвздошной кишки [32].
Дотации витамина B6 значительно снижали показатели тошноты при токсикозе беременных (n=64; от 5,3±2,1 до 3,3±2,1 балла, p <0,001) и количество эпизодов рвоты (от 1,7±1,71 до 1,2±1,2, p <0,01) [33].
Хорошо известно, что дотации витамина B1 (тиамина) улучшают когнитивные способности у госпитализированных алкоголиков, проходящих интенсивную терапию абстиненции (n=45). Группа пациентов была рандомизирована: 23 пациента получали 300 мг/сут тиамина, 22 - плацебо. Прием тиамина не только повышал обеспеченность пациентов витамином В1, но и снижал процент наихудших результатов в когнитивных тестах [34].
Витамин Е
Витамин E является мощным антиоксидантом, особенно в комбинации с витамином C и микроэлементом селеном. Он эффективен в адъюнктивной терапии острого отравления фосфидом алюминия. Последний обычно используется в качестве фумиганта, а отравление этим соединением сопровождается окислительным стрессом. Пациенты, поступившие в стационар с отравлением фосфидом алюминия, получали стандартные антидоты. Дополнительные дотации витамина E (400 мг, 2 раза в сутки, внутримышечно) уменьшили необходимость интубации и механической вентиляции (30 против 62%, р <0,05), продолжительность этой процедуры (р <0,05), существенно снизили смертность (15 против 50%, р <0,05) [35].
Пероральный прием витамина E также повышает эффективность лечения пациентов в стационаре. Например, его дотация (400 МЕ/сут, 12 нед.) эффективно снижает встречаемость мышечных судорог у пациентов, находящихся в ОИТ на гемодиализе (n=19). К концу терапии частота мышечных судорог значительно снижалась (на 68%, р=0,0001). Уменьшение количества приступов мышечных спазмов не имело существенной корреляции с возрастом, полом, этиологией или продолжительностью почечной недостаточности. Не было обнаружено побочных эффектов, связанных с витаминами E [36].
Витамин С
Дотации витамина С способствуют уменьшению продолжительности пребывания в стационаре и снижению объема дренажа после кардиохирургических вмешательств (n=290). Пациенты были рандомизированы в две группы: интервенционная группа, которым проводились дотации витамина С (2000 мг внутривенно, непосредственно перед операцией, затем 1000 мг/сут перорально, в течение 4 суток после операции) и группа плацебо. Продолжительность пребывания в больнице была достоверно ниже (10±4,6 против 12±4,5 сут. в группе плацебо, р=0,01). Отмечено достоверное снижение времени интубации и объема дренажа в ОИТ и в первые 24 послеоперационных часа (р <0,003) [37].
Введение витамина С внутривенно (7500 мг/50 мл, 2 нед.) в дополнение к стандартной терапии эффективен у пациентов с симптоматическим опоясывающим лишаем (n=67). Адъюнктивная терапия витамином С снижала балл боли по шкале ВАШ, количество дерматом, выцветов и геморрагических везикул через 2 недели терапии; эффект сохранялся, по меньшей мере, через 12 недель после окончания терапии [38].
Клинический опыт показал целесообразность включения витамина С в протоколы лечения опухолевых заболеваний. При этом пациенты проходят начальный курс введения аскорбата натрия внутривенно (10-30 г/сут) для достижения концентрации аскорбат-аниона в плазме не менее 3 мг/дл с последующей поддерживающей пероральной дозой пожизненно (1000-5000 мг/ сут). Важно отметить необходимость непрерывного приема витамина; прерывания курса (например, вследствие низкой комплаентности пациента) негативно сказываются на клинических исходах [39].
Применение этого протокола у пациентов с солидными опухолями показало улучшение их самочувствия уже через 5-7 суток после начала введения витамина С внутривенно. Этот эффект обусловлен, в частности, восстановлением эндогенного биосинтеза карнитина, который способствует улучшению метаболизма липидов. При наличии у пациента болезненных метастазов в костной ткани, облегчение боли наблюдалось также через 5-7 дней, что позволяло полностью исключить прием обезболивающих опиатов, причем без возникновения абстиненции. Кроме того, костные и висцеральные метастазы ассоциируются с повышенной экскрецией гидроксипролина с мочей, что указывает на интенсивный распад коллагеновых волокон соединительнотканной основы органов. В течение 5-7 суток после начала терапии аскорбатом отмечалось резкое и устойчивое снижение экскреции гидроксипролина. Также, отмечено снижение СОЭ и уровней белков-маркеров опухолей (CEA и др.). Радиологические признаки хорошего ответа включали медленное превращение остеолитических метастазов в плотные остеосклеротические поражения в течение нескольких месяцев после начала терапии витамином С. В благоприятных случаях, наблюдалась резорбция злокачественных выделений плевры и уменьшение размеров легочных метастазов [39].
Совместное применение гидрокортизона, витамина С и витамина В1 внутривенно эффективно для лечения тяжелого сепсиса и септического шока. Глобальное бремя сепсиса составляет 15-19 млн случаев ежегодно, уровень смертности может достигать 60%. Сравнение клинического течения сепсиса у пациентов, получавших витамин С, гидрокортизон и тиамин внутривенно в течение 7 месяцев (n=47) с контрольной группой (n=47) показало выраженное снижение больничной смертности (8,5 против 40,4%): риск летального исхода был в 7 раз ниже (ОР 0,13; 95% ДИ 0,04-0,48, р=0,002). У пациентов в группе лечения вазопрессоры были отменены в течение 18±10 часов после начала лечения по протоколу (в контрольной группе - через 55±28 часов, р <0,001) [40].
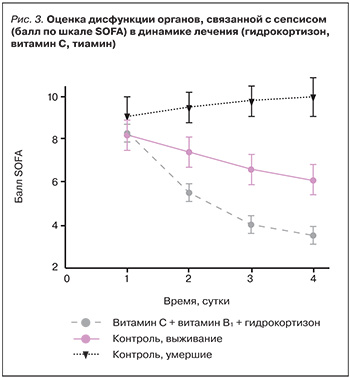
Совместное применение гидрокортизона, витамина С и тиамина внутривенно также предотвращает развитие дисфункции органов при сепсисе. У всех участников исследования была проведена оценка по шкале SOFA (Sepsis-related Organ Failure Assessment) в течение 4 суток. Балл по шкале SOFA достоверно снизился у всех пациентов в группе лечения (на 4,8±2,4 против 0,9±2,7 в контрольной группе, p <0,001, рис. 3). Ни у одного из пациентов в группе лечения не развилась прогрессирующая органная недостаточность, требующая эскалации терапии.
Таким образом, своевременное использование витамина С вместе с кортикостероидами и тиамином эффективно снижает смертность пациентов с тяжелым течением сепсиса и септическим шоком, а также предотвращает прогрессирующую полиорганную недостаточность [40].
ЗАКЛЮЧЕНИЕ
Госпитализация пациентов осуществляется при определенной тяжести течения заболевания. Обострение хронических заболеваний, требующее стационарного лечения, как правило, сопровождается наличием тяжелого полигиповитаминоза. Тем не менее, при госпитализации внимание уделяется исключительно основному диагнозу (туберкулез, муковисцидоз, рассеянный склероз, алкоголизм и др.) и тяжести состояния пациента в соответствии с этим диагнозом. Поэтому такие диагнозы, как E54 - недостаточность аскорбиновой кислоты, E64.2 - последствия недостаточности витамина C, E56.0 - недостаточность витамина E, E50 - недостаточность витамина A, E64.1 - последствия недостаточности витамина A, D51 - витамин-B12-дефицитная анемия, E55 - недостаточность витамина D, E55.9 - недостаточность витамина D неуточненная, E53 - недостаточность других витаминов группы B и др., остаются, образно выражаясь, «в тени». В то же время, как показывают цитируемые в настоящем аналитическом обзоре исследования, учет этих диагнозов реально позволяет сохранить жизнь многим пациентам. Также отметим, что компенсация недостаточности витаминов является чрезвычайно простой в организационном плане мерой повышения эффективности лечения пациентов в стационаре.



