Фибрилляция предсердий (ФП) – одно из наиболее часто встречаемых клинически значимых нарушений ритма сердца, осложняющих течение всех кардиологических и многих некардиологических заболеваний. В нашей стране, как и во всем мире, ее распространенность очень высока, что делает вопросы ведения пациентов с ФП чрезвычайно актуальными [1–3].
В последние годы во врачебную практику прочно вошло наднозологическое понятие «хроническая болезнь почек» (ХБП), объединяющее хронические повреждения почек различной природы на основе единства патогенетических механизмов, общности факторов риска и прогрессирования и, главное, способов первичной и вторичной профилактики [4]. Учитывая большое количество больных, у которых можно диагностировать ХБП, понятно, что эта популяция будет частично пересекаться с популяцией пациентов, страдающих ФП. Вероятность сочетания этих двух состояний весьма высока: считается, что распространенность ХБП в общей популяции достигает 10% [4], а ФП встречается у 15–20% больных с ХБП [5].
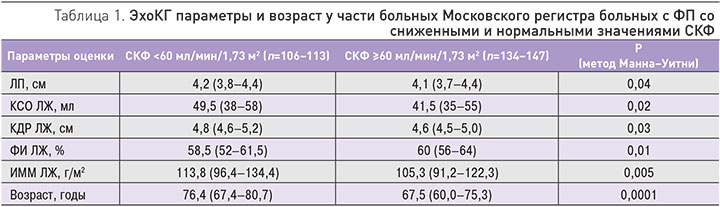
В созданном нами Московском регистре больных с ФП [6] для 388 пациентов, госпитализированных в 2014–2015 гг. (преимущественно в связи с неустойчивыми формами ФП), были доступны значения скорости клубочковой фильтрации (СКФ). Ее медиана и интерквартильный размах оказались равны 64,6 (51,0–85,0) мл/мин/1,73м2, распределение этого параметра представлено на рисунке. Как видно, 39,9% больных имели СКФ <60 1="" 73="" 2="" 3-="" p="">
 Двусторонняя связь ФП и почечной дисфункции показана в ряде исследований, продемонстрировавших, что наличие мерцательной аритмии увеличивает вероятность ХБП и, наоборот, у пациентов с нарушением почечной функции увеличивается вероятность развития ФП [7, 8]. Ассоциация ФП и ХБП объясняется существованием общих факторов риска (ожирение, артериальная гипертензия, сахарный диабет, метаболический синдром и сердечно-сосудистая патология) и механизмов развития (воспаление, оксидативный стресс, гиперактивация ренин-ангиотензин-альдостероновой системы). Одним из механизмов патофизиологической связи ФП и ХБП являются изменения эхокардиографических (ЭхоКГ) параметров, прежде всего тех, которые характеризуют анатомию и функцию левого предсердия (ЛП). Ранее мы публиковали данные о взаимосвязи ФП и дисфункции почек у больных с хронической сердечной недостаточностью и ЭхоКГ характеристиками этих пациентов [9]. У вышеописанных больных Московского регистра ФП удалось показать, что пациенты с СКФ <60 1="" 73="" 2="" 1="" p="">
Двусторонняя связь ФП и почечной дисфункции показана в ряде исследований, продемонстрировавших, что наличие мерцательной аритмии увеличивает вероятность ХБП и, наоборот, у пациентов с нарушением почечной функции увеличивается вероятность развития ФП [7, 8]. Ассоциация ФП и ХБП объясняется существованием общих факторов риска (ожирение, артериальная гипертензия, сахарный диабет, метаболический синдром и сердечно-сосудистая патология) и механизмов развития (воспаление, оксидативный стресс, гиперактивация ренин-ангиотензин-альдостероновой системы). Одним из механизмов патофизиологической связи ФП и ХБП являются изменения эхокардиографических (ЭхоКГ) параметров, прежде всего тех, которые характеризуют анатомию и функцию левого предсердия (ЛП). Ранее мы публиковали данные о взаимосвязи ФП и дисфункции почек у больных с хронической сердечной недостаточностью и ЭхоКГ характеристиками этих пациентов [9]. У вышеописанных больных Московского регистра ФП удалось показать, что пациенты с СКФ <60 1="" 73="" 2="" 1="" p="">
Наши данные соответствуют результатам исследования ЭхоКГ параметров у пациентов без сердечно-сосудистых заболеваний [10]. Оказалось, что при наличии у них ХБП ЭхоКГ параметры, характеризующие резервуарную функцию ЛП, выраженность гипертрофии миокарда ЛЖ и его диастолическую функцию, были хуже, чем при сохранной функции почек. Пациенты с ХБП в этом исследовании также были старше.
В отечественных рекомендациях по ведению пациентов с ФП 2012 г. [2] отдельного раздела, посвященного сочетанию ФП и ХБП, нет. В европейских рекомендациях 2016 г. эта коморбидность обсуждается в особом (хоть и коротком) разделе [3]. Представлены две позиции: 1. оценка почечной функции по сывороточному креатинину или клиренсу креатинина рекомендована всем больным с ФП для выявления патологии почек и правильного дозирования лекарственных препаратов (I А); 2. всем пациентам с ФП, получающим оральные антикоагулянты, почечная функция должна оцениваться не реже 1 раза в год для выявления ХБП (IIa, B).
Наиболее значимые в практическом отношении особенности сочетания ФП и ХБП связаны с изменением фармакокинетики антиаритмических препаратов и антикоагулянтов у больных со сниженной почечной функцией, что может требовать коррекции дозы лекарств. Кроме того, ХБП увеличивает вероятность инсульта и кровотечений [11–13]. Хотя нарушение функции почек не входит в список факторов риска инсульта, оцениваемых шкалой CHA2DS2Vasc, известно, что протеинурия или снижение СКФ у больных с ФП также увеличивает и риск развития тромбоэмболических эпизодов [11].
Однако фокус внимания практических врачей обычно смещен на тот факт, что почечная дисфункция является одним из пунктов шкалы HAS-BLED, т.е. ее наличие у больного с ФП увеличивает риск геморрагических осложнений и влияет на принятие решений о назначении антикоагулянтов. Надо отметить, что при оценке вероятности кровотечений с помощью этой шкалы нарушение функции почек определяют как повышение уровня креатинина сыворотки выше 200 мкмоль/л (а не снижение СКФ), постоянный гемодиализ или трансплантация почки.
Считается, что безопасно можно применять антикоагулянты у больных с ФП и ХБП до 4-й стадии включительно (СКФ >15 мл/мин), доказательная база для этого накоплена внушительная. Так, у 805 из 1936 рандомизированных в исследование SPAF (Stroke Prevention in Atrial Fibrillation) пациентов расчетные значения СКФ были <59 1="" 73="" 2="" 3-="" 2="" 0="" 3="" 0="" 14="" 0="" 76="" 95="" 0="" 72="" 0="" 80="" 15="" 16="" p="">
Мета-анализ 6 ретроспективных и 5 проспективных исследований, включивших более 48 500 пациентов с ФП и ХБП, 11 600 из которых получали варфарин, подтвердил, что вплоть до 4-й стадии ХБП использование варфарина снижало риск тромбоэмболических событий и смертности, не повышая вероятность больших кровотечений. У больных с ФП в терминальной стадии ХБП (получающих заместительную почечную терапию) варфарин не снижал риск инсульта и смертность, но повышал вероятность геморрагических осложнений [17]. При этом в ретроспективном когортном исследовании данных 14 892 пациентов старше 66 лет с ФП за год наблюдения достижение первичной композитной конечной точки (смерть по любой причине, ишемический инсульт или транзиторная ишемическая атака) наступало реже в группе получающих варфарин, независимо от степени снижения СКФ (диапазон значений в изучаемой популяции от <30>90 мл/мин/1,73 м2). Увеличение риска больших кровотечений на фоне приема варфарина отмечено только в подгруппе больных с СКФ 60–89 мл/мин/1,73 м2 [18].
Мета-анализ основных исследований с новыми оральными антикоагулянтами (НОАК) показал, что пациенты с ФП и легкой или умеренной ХБП, получавшие НОАК, имели меньшие риски инсультов, системных эмболий или больших кровотечений, чем пациенты, получающие терапию варфарином [19]. При сравнении эффективности и безопасности четырех имеющихся сегодня НОАК с варфарином у больных с ФП и умеренной ХБП в ходе мета-анализа 5 исследований с 13 878 пациентами была высказана гипотеза, что оптимальный клинический профиль имеют апиксабан и эдоксабан в высоких дозах [20].
В британском руководстве по ведению больных с ХБП при снижении СКФ до 30–50 мл/ мин/1,73 м2 для тромбопрофилактики при ФП предпочтительным считается использование апиксабана, а не варфарина [21].
Использование НОАК при снижении почечной функции имеет следующие особенности: дабигатран применяют в дозе 150 мг 2 раза/сут вплоть до снижения СКФ до <30 1="" 73="" 2="" 20="" 1="" 15="" 1="" 15="" 49="" 1="" 73="" 2="" 5="" 2="" 5="" 2="" :="" 80="" 60="" 133="" 15="" 1="" 73="" 2="" 2="" 3="" 15="" 29="" 1="" 73="" 2="" 22="" p="">
Следует отметить, что для прогнозирования качества терапии варфарином в последнее время предлагается использовать шкалу SAMe-TT2R2. В нее, наряду с женским полом (1 балл), возрастом менее 60 лет (1 балл), курением более 2-х лет (2 балла), неевропеоидной расой (2 балла) и приемом препаратов, влияющих на метаболизм варфарина (например, амиодарона, 1 балл), входят такие факторы риска, как артериальная гипертензия, сахарный диабет, инфаркт миокарда, застойная сердечная недостаточность, периферический атеросклероз, заболевание легких, печени или почек (любые два компонента из этого списка дают 1 балл). При получении суммы баллов >2 предполагается, что время нахождения в целевом диапазоне МНО при приеме варфарина будет недостаточным, и, следовательно, у этого больного предпочтительно применение НОАК [23, 24].
При разделении больных Московского регистра ФП по значению СКФ (выше и ниже 60 мл/ мин/1,73 м2) существенных отличий в частоте применения варфарина, НОАК и антиагрегантов в этих подгруппах обнаружено не было как до поступления в стационар, так и к моменту выписки из него и через год после выписки (данные получены при телефонном контакте). Это говорит о том, что в реальной клинической практике на принятие решения при выборе препарата для тромбопрофилактики при ФП в большей степени влияют другие, прежде всего финансовые факторы.
Доказательных данных по применению оральных антикоагулянтов, в т.ч. новых, у больных с ФП, получающих лечение программным гемодиализом, или после трансплантации почки на сегодняшний день нет [25]. Результаты проведенных работ у диализных больных противоречивы [26, 27], что обуславливает необходимость в проведении проспективных контролируемых исследований в этом направлении [28].
Неожиданные данные были получены в ретроспективном когортном исследовании особенностей прогноза у пожилых больных с ХБП и ФП. В группе из 6544 пациентов с ХБП (СКФ 45 мл/мин/1,73 м2, стадии ХБП 3б–5) старше 66 лет антикоагулянты были назначены 1475 из них. Использовались все группы антикоагулянтов – прямые, варфарин, НОАК. Оказалось, что их применение не снижало риск ишемического инсульта, повышало риск кровотечений, но при этом снижало общую смертность. Отсутствие влияния приема антикоагулянтов на частоту инсульта авторы объясняют тем, что в исследование вошли больные, не изучавшиеся ранее в крупных рандомизированных контролируемых исследованиях, в т.ч. с низким риском тромбоэмболических осложнений. В этой работе не исследовалась приверженность к приему лекарств и качество достигнутой антикоагуляции. Снижение смертности авторы связывают с профилактикой венозного тромбоэмболизма при приеме антикоагулянтов [29].
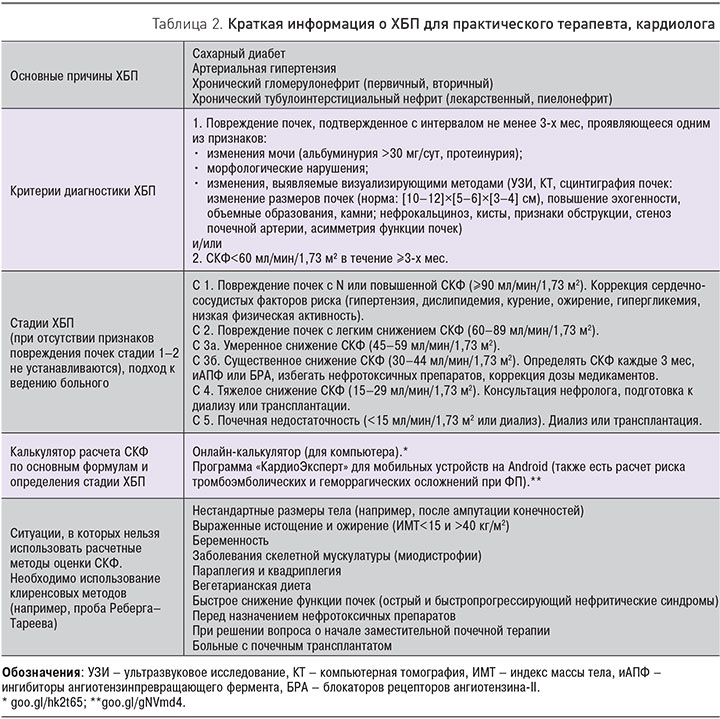
С практической точки зрения чрезвычайно важно напомнить несколько аспектов, касающихся диагностики и ведения больных с ХБП (табл. 2). Важно, что для диагностики ХБП необходимо доказательство персистирования маркеров почечного повреждения в течение более 3-х мес. В реальной клинической практике это состояние нередко неправильно диагностируется на основании однократного выявления сниженной СКФ. При этом большое количество клинических ситуаций, сопровождающихся острой почечной дисфункцией, завершаются выздоровлением или существенным улучшением и не приводят к клиническим, лабораторным или инструментальным признакам хронизации процесса. При ФП, напротив, СКФ со временем имеет тенденцию к снижению [30]. Таким образом, обосновать существование ХБП можно при подтверждении наличия маркеров почечного повреждения как минимум двумя исследованиями с 3-месячным интервалом. Однократного исследования может оказаться достаточно, только если оно однозначно указывает на необратимые структурные изменения почки (данные визуализирующих инструментальных методов или прижизненного морфологического исследования – нефробиопсии).



