Остеопороз (ОП) является широко распространенным заболеванием скелета, обусловленным снижением плотности и ухудшением качества кости и проявляющимся переломами на фоне минимальной травмы или спонтанно. По данным эпидемиологических исследований, в России ОП страдают 30–33% женщин и 22–24% мужчин в возрасте 50 лет и старше [1]. ОП – это болезнь не только пожилых людей, но и лиц более молодого возраста, особенно тех из них, у кого имеются различные заболевания, например, ревматоидный артрит или инсулинозависимый сахарный диабет, или получающих лекарственные препараты, негативно влияющие на костный обмен. В зависимости от пола, возраста, сопутствующей патологии и принимаемой лекарственной терапии, наличия или отсутствия переломов пациент с ОП может оказаться в поле зрения врача любой специальности. Врач, в свою очередь, должен быть готовым оказать этому больному квалифицированную помощь, подобрав в каждом конкретном случае необходимое лечение и определив его продолжительность.
Сегодня в клинической практике используются препараты, доказавшие свою эффективность в отношении снижения риска переломов в длительных многоцентровых плацебо-контролируемых клинических испытаниях. В России, как и во всем мире, для лечения ОП применяются азотсодержащие бисфосфонаты (БФ), деносумаб, терипаратид и стронция ранелат [2]. Выбор терапии зависит от конкретной клинической ситуации, а при назначении отдельных препаратов – также и от предпочтительного пути введения (перорально или внутривенно).
БИСФОСФОНАТЫ
На протяжении последних двух десятилетий для лечения ОП препаратами первого выбора остаются БФ (алендронат, ризедронат, ибандронат и золедроновая кислота), которые ингибируют опосредованный остеокластами процесс костной резорбции, в результате чего увеличивается костная масса и улучшается прочность кости, снижается риск переломов различной локализации.
В настоящее время алендронат представлен как оригинальным препаратом, так и целым рядом дженерических аналогов различного производства. Он назначается внутрь в дозе 70 мг 1 р/нед, и показаниями для его назначения служат ОП у женщин в постменопаузе, ОП у мужчин, ОП, вызванный использованием глюкокортикоидов (ГК) у лиц обоего пола. Кроме лечения ОП, алендронат может применяться для профилактики переломов у женщин в постменопаузе и у больных с глюкокортикоидным ОП, но это показание зарегистрировано только для ежедневного приема в дозе 10 мг.
Другой БФ, ризедронат, доступен в таблетках по 35 мг для приема 1 р/нед в виде двух дженерических препаратов. Он имеет те же показания для назначения, что и алендронат.
Ибандронат – единственный БФ, который выпускается в двух лекарственных формах: таблетка 150 мг для приема 1 раз/мес и раствор для внутривенного введения 3 мг/3 мл 1 р/3 мес. Препарат может быть рекомендован женщинам с постменопаузальным ОП.
Золедроновая кислота применяется для лечения постменопаузального ОП, ОП у мужчин, профилактики последующих новых остеопоротических переломов у мужчин и женщин с переломами проксимального отдела бедренной кости, профилактики и лечения ГК ОП, а также 1 раз в 2 года – у пациенток с остеопенией для профилактики постменопаузального ОП. Она назначается 1 раз в год только в дозе 5 мг в виде внутривенной инфузии в течение 15 мин. В России доступны оригинальный препарат и отечественный аналог.
Основными противопоказаниями для назначения любых БФ являются гипокальциемия, тяжелые нарушения функции почек (клиренс креатинина менее 35 мл/мин), повышенная чувствительность к этой группе лекарственных средств, беременность, лактация и, дополнительно для таблетированных форм: стриктура пищевода, ахалазия, неспособность больного стоять или сидеть прямо по крайней мере 30 мин после приема препарата. Это связано с тем, что бисфосфонаты при пероральном приеме имеют прямое негативное действие на слизистую оболочку верхних отделов желудочно-кишечного тракта (ЖКТ), вызывая диспепсию, тошноту и боли в области эпигастрия. Определенное значение играет и кислотность желудочного сока. В постмаркетинговых исследованиях выявлялись случаи эрозивного и язвенного поражения пищевода, а также желудка и двенадцатиперстной кишки на фоне лечения таблетированными бисфосфонатами. Частота нежелательных явлений с поражением ЖКТ была выше среди лиц, у которых в анамнезе были эзофагит и/или язвенная болезнь, и у тех, кто принимал нестероидные противовоспалительные препараты.
Сегодня на нашем фармакологическом рынке появилась новая форма алендроната – шипучие таблетки, содержащие 70 мг препарата (Биносто, производства СвиссКо Сервисез АГ, Швейцария), при растворении которых в воде получается буферный раствор с относительно высоким уровнем рН и высокой способностью нейтрализации кислоты желудочного сока. Буферный раствор Биносто позволяет снизить до минимума контакт между частицами алендроната и слизистой оболочкой верхних отделов ЖКТ, что, в свою очередь, ведет к уменьшению числа нежелательных явлений со стороны пищевода и желудка. Данный препарат подтвердил свою биоэквивалентность оригинальному алендронату. В 2012 г. он был одобрен FDA для лечения больных с остеопорозом в США, а с 2016 г. применяется и в странах Европы, Азии и Африки.
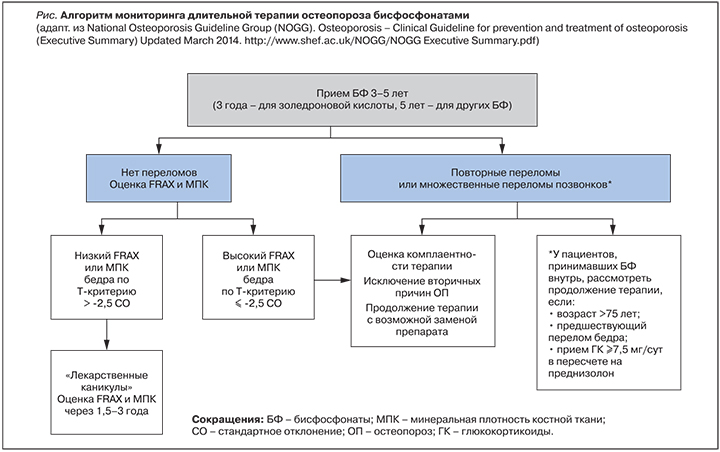
Продолжительность терапии алендронатом, ризедронатом, ибандронатом должна быть не менее 5 лет, а золедроновой кислотой – не менее 3 лет (рисунок). В отдельных случаях в течение этого срока может возникнуть необходимость в пересмотре назначенного лечения, например, при плохой переносимости определенного препарата или при подозрении на отсутствие ответа на проводимую терапию. Последнее можно предполагать, когда у больного, получающего БФ, произошли два и более низкоэнергетических перелома любой локализации, кроме костей кистей, стоп и черепа, или было выявлено снижение минеральной плотности костной ткани (МПК) на 5% и более в позвоночнике или 4% и более в проксимальном отделе бедренной кости при двух последовательных измерениях, а также не было отмечено достоверного снижения маркеров костного обмена через 6 мес лечения на 25% от первоначального уровня [3]. Решение о смене терапии таким пациентам должно быть принято врачом после оценки приверженности больного лечению (пропуски и несоблюдение режима приема препарата), а также исключения других, ранее не выявленных факторов, негативно влияющих на костную ткань.
Если у больного, получавшего в течение 3–5 лет БФ, не было новых переломов, а показатели МПК в проксимальном отделе бедра достигли остеопенических или даже нормальных значений, то можно рассмотреть возможность так называемых лекарственных каникул – перерыва в терапии ОП на 2–3 года [4]. У больных с высоким риском остеопоротических переломов целесообразно продолжить лечение пероральными БФ до 10 лет, а при использовании золедроновой кислоты – до 6 лет [5]. Это пациенты в возрасте старше 75 лет, лица с показателями Т-критерия бедренной кости менее -2,5 стандартных отклонений (СО) или с высоким 10-летним риском основных переломов, рассчитанным по алгоритму FRAX®; больные, имевшие ранее перелом бедра или множественные переломы позвонков или принимающие ГК в дозе 7,5 мг/сут и более в пересчете на преднизолон [6].
В качестве мониторинга риска переломов у пациента на лекарственных каникулах через 1–3 года после приостановки лечения БФ могут быть использованы такие параметры, как определение уровня маркеров костного метаболизма, измерение МПК и оценка по алгоритму FRAX [7–9]. Рекомендовано рассмотреть вопрос о возобновлении антиостеопоротической терапии при выявлении следующих состояний: 1) значимое увеличение уровня маркеров костной резорбции или достижение показателей костного обмена, которые были у пациента до начала лечения БФ; 2) снижение МПК до уровня ОП, особенно в проксимальном отделе бедренной кости; 3) показатель риска перелома по FRAX®, рассчитанный с учетом данных МПК шейки бедра, выше порога терапевтического вмешательства. Вне зависимости от показателей маркеров костного обмена и МПК лекарственные каникулы могут быть прерваны в любой период, если произошел новый перелом.
Для предупреждения снижения МПК во время лекарственных каникул возможно назначение активного метаболита витамина D – альфакальцидола, который показал свою эффективность у пациентов после остановки лечения БФ [10].
ДЕНОСУМАБ
Альтернативой БФ может служить генно-инженерный биологический препарат деносумаб, являющийся полным человеческим моноклональным антителом, для подкожного введения с режимом дозирования 1 раз в 6 мес, который также относится к антирезорбтивным средствам. Механизм действия деносумаба связан с ингибицией лиганда рецептора активатора ядерного фактора каппа В (RANKL), в результате чего не происходит его связывания с самим рецептором активатора ядерного фактора каппа В (RANK), находящимся на незрелых остеокластах, что предотвращает их созревание. Кроме того, он снижает функционирование и выживание зрелых остеокластов, что ведет к уменьшению резорбции костной ткани, при этом его воздействие на костную ткань обратимо [11].
Показаниями для назначения деносумаба являются лечение постменопаузального ОП и сенильного ОП у мужчин, а также профилактика потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и у мужчин с раком предстательной железы, получающих гормондепривационную терапию. Кроме этого, деносумаб может быть рекомендован пациентам с высоким риском переломов, нуждающимся в более длительном назначении терапии ОП, после 3–5 лет лечения БФ или в любой период лечения ОП при неэффективности или плохой переносимости предшествующих препаратов [12]. Препарат противопоказан больным с гипокальциемией и при повышенной чувствительности к любому из компонентов этого лекарства. Лечение деносумабом может проводиться до 10 лет, так как, по данным продленной фазы международного исследования FREEDOM, на протяжении этого времени отмечается продолжающееся увеличение МПК и сохраняется более низкий риск переломов [13]. Однако терапия может быть приостановлена при достижении денситометрического показателя Т-критерия проксимального отдела бедра в целом (Total) до уровня -2,0-(-1,5) СО, что является на сегодня «терапевтической целью» лечения деносумабом [14].
Как было сказано ранее, воздействие деносумаба на костную ткань обратимо, поэтому после отмены введения данного препарата отмечается усиление процессов костной резорбции, что ведет к возобновлению потери МПК и увеличению риска переломов [15]. В то же время назначение в течение года алендроната позволяет сохранить показатели МПК на уровне, достигнутом на фоне деносумаба после любого срока его применения [16].
ТЕРИПАРАТИД
Терипаратид – рекомбинантный человеческий паратиреоидный гормон, представляющий собой последовательность из 1–34 аминокислотных остатков, биологическое действие которого осуществляется за счет связывания со специфическими рецепторами на поверхности клеток. Ежедневное однократное подкожное введение терипаратида в дозе 20 мкг стимулирует образование новой костной ткани на трабекулярной и кортикальной (периостальной и/или эндостальной) поверхностях костей с преимущественной стимуляцией активности остеобластов по отношению к активности остеокластов. Это пока единственный препарат в нашей стране, обладающий анаболическим действием. Он зарегистрирован для лечения ОП у женщин в постменопаузальном периоде, у мужчин с первичным ОП или ОП, обусловленным гипогонадизмом, и у лиц обоего пола с ОП и повышенным риском переломов, обусловленным длительной системной терапией ГК. Однако назначение терипаратида предпочтительно у пациентов с тяжелым ОП, имеющих один или более переломов тел позвонков или перелом проксимального отдела бедра, многочисленные повторные переломы костей скелета.
Терипаратид может рассматриваться как препарат выбора у больных с неэффективностью предшествующей антиостеопоротической терапии при возникновении новых переломов или продолжающемся снижении МПК, а также у больных ОП с непереносимостью других препаратов для лечения ОП или при наличии противопоказаний для их назначения.
При планировании лечения необходимо помнить о противопоказаниях к назначению терипаратида, среди которых: предшествующая гиперкальциемия, тяжелая почечная недостаточность, метаболические заболевания костей, включая гиперпаратиреоз и болезнь Педжета, за исключением первичного ОП, повышение активности щелочной фосфатазы неясного генеза, предшествующая лучевая терапия костей и метастазы и опухоли костей в анамнезе, беременность и кормление грудью, детский и подростковый возраст до 18 лет, повышенная чувствительность к препарату. Длительность терапии терипаратидом не должна превышать 24 мес. Принимая во внимание, что у пациентов, прекративших лечение этим препаратом, через 18 мес отмечалось снижение МПК и увеличение риска новых переломов [17], в настоящее время для закрепления достигнутого результата, полученного на фоне назначения анаболической терапии, рекомендовано после окончания применения терипаратида назначать препараты, обладающие антирезорбтивным действием (БФ или деносумаб), а продолжительность лечения ими должна составлять не менее года [6].
СТРОНЦИЯ РАНЕЛАТ
Стронция ранелат – препарат с предполагаемым двойным механизмом действия, в результате которого баланс между образованием и разрушением костной ткани изменяется в сторону процессов анаболизма кости. Он выпускается в виде саше, содержащего 2 г препарата, для приготовления суспензии для приема внутрь ежедневно. Препарат имеет доказанную эффективность в отношении снижения риска переломов и зарегистрирован для лечения ОП у женщин в постменопаузе и мужчин с высоким риском переломов.
Стронция ранелат может применяться продолжительностью до 10 лет для лечения тяжелого ОП (один или более переломов тел позвонков или перелом проксимального отдела бедра, многочисленные повторные переломы костей скелета) у пожилых женщин и мужчин [18]. Препарат не должен назначаться пациентам с ишемической болезнью сердца, неконтролируемой артериальной гипертензией, заболеваниями периферических артерий и цереброваскулярной болезнью, а также при склонности к тромбозам и тромбоэмболиям. У больных, не имеющих противопоказаний к его назначению, он рассматривается как препарат выбора в случае неэффективности предшествующей антиостеопоротической терапии, при возникновении новых переломов или продолжающемся снижении МПК, а также у пациентов с непереносимостью других препаратов для лечения ОП.
Любой из вышеперечисленных препаратов назначается на фоне применения препаратов кальция и витамина D, при этом доза кальция зависит от суточного потребления данного макроэлемента с продуктами питания. В настоящее время доза кальция для женщин до 50 лет и мужчин до 60 лет составляет 1000 мг/ сут, а для людей более старшего возраста – 1200 мг/ сут. Витамин D рекомендуется в дозе 800–1000 МЕ/ сут, а при приеме ГК она может быть увеличена до 2000 МЕ [19].
Таким образом, в клинической практике при выборе терапии ОП перед врачом стоит нелегкая задача в определении тактики ведения пациента, страдающего этим заболеванием. Для достижения максимально возможного результата по снижению риска будущих переломов необходимо сделать не только обоснованный выбор лекарственного средства и определить длительность его применения, но и убедить пациента следовать рекомендациям.



