ОСТЕОПОРОЗ
Остеопороз (ОП) представляет собой системное метаболическое заболевание скелета, характеризующееся снижением прочности кости и приводящее к переломам, которые возникают при низкоэнергетической травме. Нередко первым симптомом ОП становится боль в спине – грудном отделе позвоночника, пояснично-крестцовой области или крестце. В отсутствие переломов причиной болей могут быть микропереломы трабекулярной зоны тел позвонков, а также раздражение надкостницы деформирующейся порозной массой. Характерные симптомы при ОП – уменьшение роста больных (на 1–3 см при переломе одного позвонка), ограничение движений в поясничном отделе позвоночника и др. [1].
Диагностика остеопороза
Общим рентгенологическим признаком для всех форм ОП является снижение плотности тени исследуемых отделов скелета. Однако в связи с тем, что рентгенографические изменения появляются при потере не менее 30–40% минеральных веществ, содержащихся в костной ткани, для ранней диагностики ОП, безусловно, необходимо использование иных инструментальных методов диагностики [6].
Прочностные характеристики костной ткани определяются двумя интегративными показателями – плотностью (или массой) и микроархитектоникой. «Золотым стандартом» среди инструментальных методов диагностики состояния костной ткани относительно показателей плотности и частичной оценки микроархитектоники считается двухэнергетическая рентгеновская абсорбциометрия (Dual-energy X-ray Absorptiometry – DXA или DEXA).
Двухэнергетическая рентгеновская абсорбциометрия
DXA – метод денситометрии, в основе которого лежит абсорбция ионами кальция фотонов рентгеновских лучей, что позволяет подсчитать содержание в кости Ca2+ с последующим определением проекционной минеральной плотности кости (содержания кальция на единицу площади кости, г/см2). Использование двух уровней энергии помогает точно измерить минеральную плотность кости (МПК) независимо от толщины мягких тканей.
Основными показателями минерализации костной ткани при обследовании методом DXA служат:
- костный минеральный компонент (bone mineral content, BMC). Показывает количество минерализованной ткани (г) при сканировании костей, обычно определяется длиной сканирующего пути (г/cм);
- МПК (или bone mineral density, BMD). Оценивается количество минерализованной костной ткани в сканируемой площади (г/cм2).

Т-критерий представляет собой стандартное отклонение выше или ниже среднего показателя от пика костной массы молодых женщин в возрасте 20–29 лет, который может использоваться при обследовании женщин в постменопаузе и мужчин старше 50 лет (табл. 1). У женщин до менопаузы, мужчин моложе 50 лет и детей диагностическая классификация по Т-критерию не может быть применима. Также в настоящее время в стандартном DXA исследовании необходимо учитывать результат трабекулярного костного индекса (Trabecular Bone Score, TBS) [3], полученный в ходе стандартного исследования поясничного отдела позвоночника. Этот показатель рекомендуется использовать для одномоментного включения в алгоритм FRAX (Fracture Risk Assessment Tool) у пациентов, проходящих скрининг по поводу ОП, с целью повышения чувствительности метода выявления больных, имеющих повышенный риск переломов [3]. ОП диагностируется при Т-критерии -2,5 SD и более. При Т-критерии от -1,0 до -2,5 SD устанавливают диагноз «остеопения». Показатель свыше -1,0 SD считается нормой. Снижение Т-критерия на одно стандартное отклонение в шейке бедра увеличивает риск перелома этой локализации в 2,6 раза, а переломов других локализаций – в 1,6 раза. Высокая точность и воспроизводимость результатов DXA позволяют использовать ее, наряду с прочим, для оценки динамики МПК в процессе лечения. Широкому применению DXA в клинической практике в России противостоит слабая оснащенность необходимым оборудованием диагностических отделений медицинских учреждений различного звена. Это обусловлено не только высокой стоимостью оборудования, но и необходимостью специализированного обустройства помещения, в котором оно будет эксплуатироваться, с учетом норм радиационной безопасности. Таким образом, DXA имеет определенные недостатки, к которым относят использование рентгеновских лучей, недостаточную портативность, необходимость в высокоспециализированном техническом персонале, а также в специальном помещении, оснащенном с учетом норм радиационной безопасности [4].
Кроме организационных сложностей, следует учитывать и другие факторы, ограничивающие использование DXA: присутствие артефактов, таких как остеофиты, появляющихся вторично на фоне остеоартрита, наличие кальцификации аорты и переломов костей, которые могут завысить показатели МПК и привести к получению ограниченной информации о микроструктуре кости, не говоря уже о неадекватном контроле качества при получении скана с помощью DXA, где могут появляться дефекты до и после обработки полученных данных исследования. Поэтому осуществляется поиск альтернативных методов, дополняющих или заменяющих DXA.
Количественное ультразвуковое исследование костной ткани (Quantitative Ultrasound, QUS)
В качестве одной из альтернатив рентгеновской денситометрии предлагалось использовать количественное ультразвуковое исследование костной ткани (QUS) [5]. В отличие от DXA при проведении этого метода диагностики не используется ионизирующая радиация. Оборудование для него значительно дешевле и более портативно, не требует специально оборудованного помещения и привлечения высококвалифицированных специалистов. Однако для данного исследования доступны только периферические участки скелета, поэтому зачастую результаты QUS и центральной DXA не совпадают.
Практическим специалистам не следует устанавливать диагноз ОП на основании данных ультразвуковой денситометрии периферических отделов скелета, измерения МПК не аксиального скелета (например, МПК пяточной кости, лучевой кости и т.д.), а также применять нестандартные, не одобренные производителем денситометров способы укладки пациентов (например, денситометрия лежа на боку) и другие локализации исследования МПК, измеренные при рентгеноденситометрии (например, треугольник Варда). Эти методы не были валидизированы подобно стандартной DXA [5].
Радиочастотная эхографическая мультиспектрометрия
Все вышесказанное об ультразвуковых методиках оценки состояния костной ткани послужило основой для разработки группой европейских ученых новой технологии, получившей название «радиочастотная эхографическая мультиспектрометрия» (Radio frequency Echographic Multi-Spectrometry – радиочастотная эхографическая мультиспектрометрия, REMS) [6].
REMS представляет собой неионизирующий портативный метод оценки поясничных позвонков/шейки бедра, основанный на анализе спектров неотфильтрованных ультразвуковых волн. Их получают при эхографическом сканировании с использованием изображений, сделанных в B-режиме, для идентификации интерфейса целевых костных структур и соответствующих областей исследования поясничных позвонков и шейки бедренной кости, целевых областей исследования при выполнении стандартной DXA. Каждая отдельная эхографическая линия имеет радиочастотный сигнал, который извлекается автоматически, а программное обеспечение способно различить хрящевую ткань, корковый и губчатый слои кости по радиочастотному сигналу. Каждый полученный спектр сигнала сравнивают с созданными ранее референсными моделями для патологических состояний и нормы. Рассчитанный процент проанализированных спектров, которые были классифицированы как «остеопороз», определяется как показатель ОП (числовой параметр). Выходным параметром служит МПК REMS – диагностический индекс, продемонстрировавший значимую корреляцию с соответствующими величинами МПК, получаемыми при DXA-денситометрии. Автоматическая обработка нефильтрованных ультразвуковых сигналов обеспечивает точные значения МПК с учетом оценки риска переломов.
Эта технология была валидирована как в одноцентровых, так и многоцентровых исследованиях по диагностике ОП и оценке прогнозирования переломов. Выполнение REMS не требует специализированно оборудованного помещения, методика является портативной.
Дополнительным перспективным показателем REMS служит показатель Fragility Score (FS) – индекс хрупкости кости. FS выражается в числовом диапазоне от 0 до 100. Значение получают путем сравнения спектра сигналов конкретного пациента с референсными спектральными моделями, полученными у лиц с низкоэнергетическими переломами или без таковых. Перспективным также видится проведение исследований с целью соотнесения показателей TBS при DXA и FS при REMS.
МПК, измеренная с помощью DXA, является сводным показателем для диагностики ОП и оценки риска переломов. Более надежная оценка риска переломов требует более точной оценки трабекулярной прочности кости, включающей также информацию о качестве кости.
Такие методы, как определение TBS на основе DXA и количественное ультразвуковое исследование, полностью не удовлетворяют всем требованиям, необходимым для рутинного применения. Сложности заключаются в излишнем ионизирующем облучении, неясной клинической значимости, доступности или труднодоступности поясничного отдела позвоночника и/или шейки бедренной кости в связи с особенностями телосложения пациента.
REMS технология рассматривается как многообещающая методика, так как является клинически доступной для диагностики ОП и оценки риска переломов посредством определения МПК на контрольных участках осевого скелета. Так, показатель FS на основе REMS – независимый индикатор качества кости, который позволяет оценить риск перелома независимо от МПК [6]. Проведенные исследования доказали высокую точность FS при разграничении пациентов с переломами и без них. FS также статистически значимо коррелировал с десятилетней вероятностью остеопоротического перелома по FRAX, подсчитанной с учетом МПК бедра.
Резюмируя вышеизложенное, можно сказать, что REMS – первый метод, основанный на применении ультразвука и позволяющий измерять МПКТ в центральных участках скелета – позвоночнике и проксимальных отделах бедренной кости. Благодаря своему нерадиационному подходу, REMS может использоваться для массовых исследований населения или программ профилактики, ранней диагностики в клинической практике, краткосрочных терапевтических наблюдений, а также в педиатрической практике. Метод продемонстрировал свою сопоставимость с «золотым стандартом» в диагностике ОП – DXA-денситометрией, хорошую воспроизводимость как при работе одного, так и нескольких операторов. Уникальные дополнительные свойства REMS включают способность отражать прочностные характеристики костной ткани в дополнение к МПК, а также исключать артефакты. Компактные размеры оборудования и мобильная версия делают удобным использование этой методики для маломобильных пациентов, как находящихся в стационаре, так и наблюдающихся на дому. Небольшие размеры и отсутствие каких-либо требований к помещению, в котором устанавливается прибор, делают его более доступным для любого медицинского центра. Мобильная версия REMS может также быть использована при выездных скрининговых исследованиях в удаленных регионах для выявления групп пациентов с высоким риском переломов, нуждающихся в назначении лечения.
САРКОПЕНИЯ
Саркопения – это снижение силы кисти или мышц ног, определяемое в тесте вставания со стула, в сочетании с низким индексом массы скелетных мышц [7]. Отдельно выделяют тяжелую саркопению, которая характеризуется сниженными функциональными способностями (по результатам оценки скорости ходьбы, теста «Встань и иди», краткой батареи тестов физического функционирования и теста ходьбы на 400 м).
Сведения о специфической клинической картине саркопении отсутствуют. Вместе с тем можно выделить пациентов, которые нуждаются в скрининге на саркопению:
- люди, большую часть времени находящиеся в постели;
- люди, не выходящие за пределы своей квартиры (дома);
- люди, не способные встать из положения сидя без посторонней помощи;
- люди, у которых зарегистрировано снижение массы тела ≥5% от исходного значения в течении 6 мес;
- люди с двумя и более падениями за последний год;
- люди, выписавшиеся из стационара;
- люди с коморбидной патологией, приводящей к снижению массы тела (хронической сердечной недостаточностью, хронической обструктивной болезнью легких, хронической болезнью почек, сахарным диабетом, ревматоидным артритом);
- люди со сниженной скоростью ходьбы (менее 0,8 м/с).
Диагностика саркопении
Согласно рекомендациям Европейской рабочей группы по изучению саркопении у пожилых людей (European Working Group on Sarcopenia in Older People) от 2018 г. (EWGSOP2), для постановки диагноза саркопении необходима оценка силы, массы и функции мышц. При уменьшении только мышечной силы устанавливается диагноз «вероятная саркопения», при сочетании такого уменьшения с низкой мышечной массой диагноз саркопении считается подтвержденным [7]. При одновременном снижении мышечной силы, массы и функции устанавливают тяжелую саркопению (рис. 1).
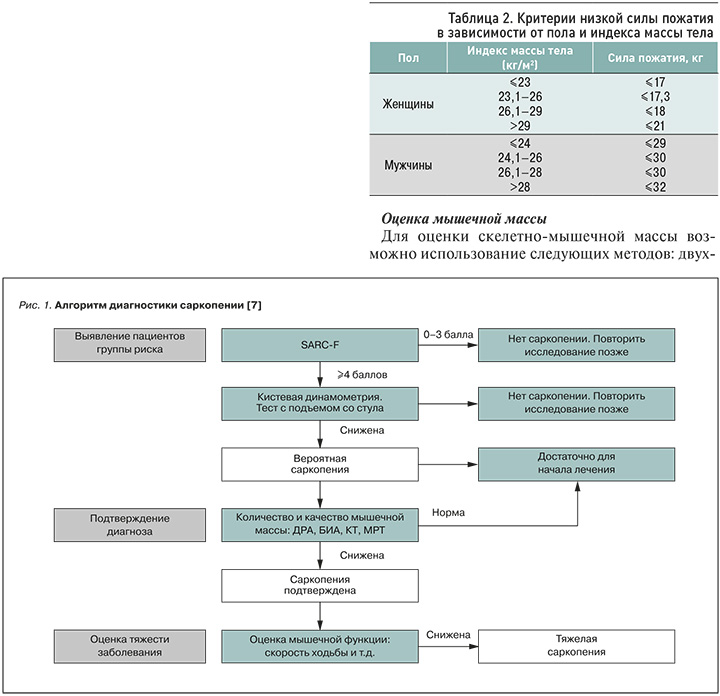
Скрининг
В нашей стране при обследовании и подозрении на саркопению рекомендуется сразу перейти к оценке мышечной силы.
Оценка мышечной силы
Один из наиболее доступных и информативных методов оценки мышечной силы – кистевая динамометрия (табл. 2) [8]. Тест с подъемом со стула, который входит в краткую батарею тестов физического функционирования, может быть использован для оценки силы мышц ног (четырехглавой мышцы бедра). Он позволяет оценить количество времени, которое необходимое пациенту, чтобы встать со стула 5 раз без использования рук. Мышечная сила считается сниженной если на выполнение этого задания затрачено >15 с [9].
Оценка мышечной массы
Для оценки скелетно-мышечной массы возможно использование следующих методов: двухфотонной рентгеновской абсорбциометрии, биоимпедансметрии, антропометрии. Наиболее простым методом, позволяющим получить представление о количестве мышечной массы, среди перечисленных является антропометрия. Однако возрастные изменения в виде перераспределения жировой массы, снижения тургора кожи приводят к ошибкам как при измерении, так и оценке антропометрических показателей у пожилых людей. Предпочтение отдается измерению окружности голени, которое может использоваться как диагностический критерий в условиях, где нет других доступных методов диагностики мышечной массы. Считается, что окружность голени менее 31 см выступает предиктором снижения выживаемости у пожилых людей [10].
Альтернативными методами для определения жировой и тощей массы (в которую входят мышцы, все органы, кости и все жидкости) в клинической практике могут служить DXA с программным обеспечением «Все тело» (Whole body) и биоимпедансометрия. При проведении DXA невозможно получить результаты только по лишь по скелетно-мышечной массе, поэтому предложено измерение тощей массы верхних и нижних конечностей (или аппендикулярной тощей массы): это позволяет получить наиболее точные данные, поскольку именно в конечностях содержится большее количество мышечной массы и меньше других составных компонентов тощей массы.
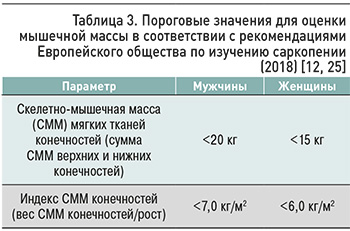
Биоимпедансный анализ дает возможность получить информацию как о количестве общей жировой и тощей массы, так и количестве скелетно-мышечной массы; также возможно определение этих параметров для конечностей [11]. После получения результатов измерения скелетно-мышечной массы в килограммах необходимо провести расчет индекса скелетно-мышечной массы (СММ) по формуле СММ (кг)/рост (м2) или аппендикулярной скелетно-мышечной массы (СММ верхних и нижних конечностей (кг)/рост (м2)) [12]. Пороговые значения для оценки мышечной массы представлены в таблице 3.
Оценка мышечной функции
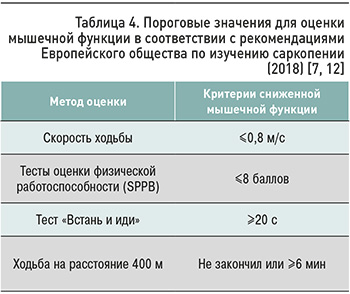
В практической деятельности для оценки мышечной функции может применяться так называемая краткая батарея тестов физического функционирования (Short Physical Performance Battery, SPPB). При проведении SPPB фиксируется время, за которое пациент проходит расстояние 4 м, пять раз встает со стула, а также время, в течение которого он способен удержать равновесие стоя в различных позициях в продолжение 10 с. За выполнение того или иного теста присваивается от 0 до 4 баллов, максимальное количество баллов составляет 12. Сумма баллов ≤8 оценивается как сниженная мышечная функции. [9].
Тест «встань и иди» также позволяет оценить мышечную функцию. В ходе него пациент должен встать со стула без помощи рук, пройти 3 м, вернуться назад и сесть на стул. Еще одним тестом для оценки мышечной функции является измерение скорости ходьбы, например, по коридору. Для этого испытуемому предлагается как можно быстрее пройти 20 кругов по 20 м (т.е. 400 м), разрешены до двух остановок отдыха во время теста. Мышечная функция считается сниженной, если пациент прошел 400 м за 6 мин и более или не закончил задание (т.е. прошел менее 20 кругов; табл. 4).
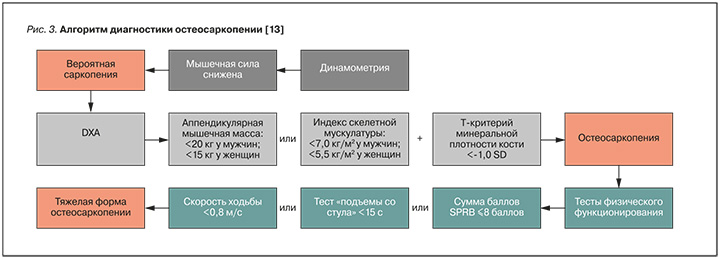
Учитывая приведенные сведения об исследованиях состояния костной и мышечной ткани, для диагностики остеосаркопении следует использовать три основных метода [13]:
- динамометрию. Позволяет установить снижение мышечной силы и выявить наличие вероятной саркопении;
- DXA. Дает возможность выявить сниженную мышечную массу в сочетании с уменьшением мышечной силы, подтверждает саркопению;
- SPPB. Наличие низкого балла при выполнении этого теста позволяет сделать вывод о тяжести саркопении/остеосаркопении.
ОСТЕОСАРКОПЕНИЯ
Остеосаркопения – это сочетание снижения МПК и потери массы, силы и функции мышц.
Исходя из вышесказанного, фенотипические признаки остеосаркопении будут выглядеть следующим образом: пожилой человек → женщина → с низким ИМТ → с низкой МПК → со сниженной мышечной силой → коморбидная → со старческой астенией → с низким индексом Бартеля.
Принимая во внимание, что остеосаркопения, как правило, длительно протекает бессимптомно и может быть заподозрена лишь при возникновении осложнений (переломов), следует как можно раньше обращать внимание на возможные клинические проявления этой патологии у пожилых пациентов и начинать диагностические мероприятия.
Диагностика остеосаркопении
Диагностика остеосаркопении состоит из подтверждения одновременного наличия у пациента обеих ее составляющих – ОП/остеопении и саркопении – и включает два этапа:
- комплексную оценку наличия патологических переломов крупных костей скелета (тел позвонков, проксимального отдела бедренной кости, дистального отдела предплечья, хирургической шейки плечевой кости) в анамнезе и выявление переломов при рутинном обследовании (рентгенография грудного и поясничного отдела позвоночника в боковой проекции), изучение МПК (рентгеновская денситометрия), подтверждение высокой индивидуальной 10-летней вероятности основных патологических переломов;
- оценку силы, массы и функции мышц.
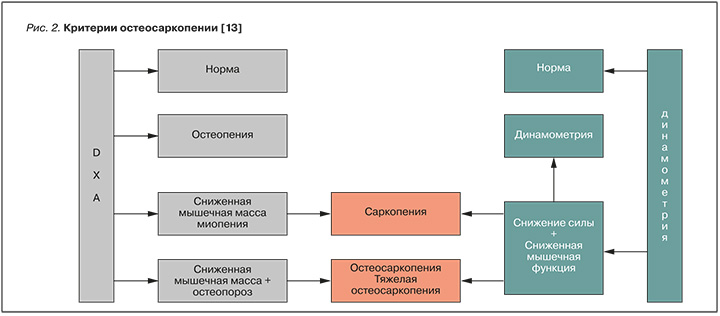
Следует отметить, что если у пациента уже выявлен ОП, то можно сделать вывод о наличии остеосаркопении. В качестве наглядной демонстрации описанного диагностического процесса на рисунках 2 и 3 приведены краткие схемы выявления остеосаркопении.
ОБЩАЯ ХАРАКТЕРИСТИКА REMS
Радиочастотная эхографическая мультиспектрометрия (Radiofrequency Echographic Multi Spectrometry, REMS) – относительно новая технология, которая выполняет анализ плотности костной ткани с помощью неионизирующего метода, основанного на анализе обратного рассеяния ультразвукового сигнала и получения радиочастотных сигналов. Анализ происходит с помощью полностью автоматического алгоритма, который заключается в серии комбинированных спектральных и статистических аналитических алгоритмах, обеспечивая в качестве конечного результата значения МПК и соответствующие величины Т- и Z-критериев костной ткани [14].
Эти показатели рассчитываются путем расширенного сравнения удельного спектра целевой кости пациента с запатентованной базой данных эталонных ультразвуковых спектральных моделей, которая сформирована американской национальной программой социального исследования, проводимой Национальным центром статистики здравоохранения США (NHANES) [15].
С помощью технологии REMS осуществляется обработка первичных данных от 256 линий сканирования с автоматическим удалением необработанных сигналов, которые относятся к кальцинозу, остеофитам и другим артефактам [16].
Анализ также включает расчет показателя FS, обеспечивающий независимую оценку хрупкости кости и риска перелома посредством проведения специального статистического и спектрального анализа. Специальный алгоритм автоматически анализирует полученные ультразвуковые изображения и связанные с ними радиочастотные сигналы внутренней микроархитектоники кости и определяет показатель, описывающий качество кости и хрупкость скелета. FS был разработан как независимый показатель качества кости, позволяющий оценить риск перелома без учета МПКТ. Предварительные исследования показали, что FS имеет хорошую точность в различении субъектов с переломами и без них; кроме того, этот показатель значительно коррелирует с риском перелома, вычисленным с помощью FRAX [17–20].
Особенности методики REMS
Сканирование REMS поясничных позвонков и проксимальной части бедренной кости выполняется с помощью специального эхографического устройства (EchoStation, Echolight Spa, Лечче, Италия), которое оснащено ультразвуковым датчиком абдоминального типа, работающим на номинальной частоте 3,5 МГц и используется в соответствии с рекомендациями производителя.
Для сканирования пациентов с разным ИМТ существуют различные режимы: оператор должен выставить соответствующую глубину сканирования и фокус преобразователя для получения оптимальных изображений. Значения этих переменных определяются с помощью таблицы, которая есть на каждом приборе. Количество кадров, необходимых для правильной диагностики, составляет 1/25 фактически полученных данных: показатели, полученные сверх этого значения, только улучшают диагностическую надежность.
Сравнение REMS с другими методами
В последнее время активно продвигается новая парадигма, заключающаяся в смещении фокуса с определения низкой МПК на оценку риска переломов. При этом костная масса все еще остается основной детерминантой прочности кости. Говоря о недостатках рентгеновской денситометрии, кроме очевидной лучевой нагрузки, нельзя не сказать о сложностях корректного измерения МПК у пациентов с дегенеративными изменениями костной системы [21], а также у больных с металлоконстукциями в интересующих зонах (табл. 5). Кроме того, из-за определенного стандартного устройства рентгеновского денситометра аппарат имеет ограничения по весу и росту пациента – диагностика пациентов выше 196 см и весом более 120 кг невозможна. Метод является операторонезависимым, однако на результат исследования влияет правильность укладки пациента. Также стоит отметить, что в руководствах, которыми комплектуются денситометры, не рассматривается ситуации, когда число поясничных позвонков отлично от 5. Хотя эти аномалии развития встречаются редко, сакроилизация, люмбализация, добавочные ребра, наличие 6 поясничных позвонков затрудняют применение стандартного анализа [22–24].
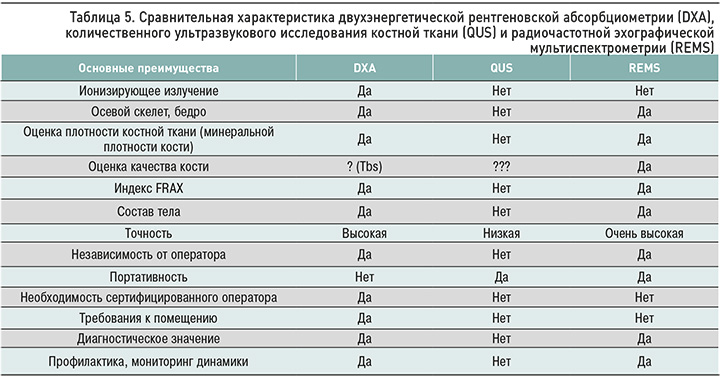
Периферическая костная денситометрия (pDXA) используется для анализа МПК сканированием предплечья, пяточной кости и фаланг пальцев. Соответствующие приборы, в отличие от стационарных, допускают передислокацию. Некоторые преимущества pDXA по сравнению с DXA состоят в том, что применяемые для ее проведения приборы портативны, требуют минимального пространства для работы и обладают более высокой пропускной способностью. К тому же области измерения удалены от органов, чувствительных к радиации, а дозы облучения пациента и персонала еще меньше, чем во время выполнения DXA. Вместе с тем в настоящее время место pDXA в клинической практике определено не до конца. К недостаткам этого метода стоит отнести лучевую нагрузку, несмотря на ее довольно низкую интенсивность, а также существенные проблемы со стандартизацией оценки метода (различные фирмы, производящие периферические денситометры, используют разные референсные базы данных). Кроме того, в различных модификациях приборов отсутствуют стандартные технологические принципы, и это создает определенные проблемы при динамической оценке МПК.
Ультразвуковая денситометрия – методика, которая характеризует костную ткань с точек зрения скорости прохождения ультразвука и его широкополостного ослабления. Метод не сопряжен с рентгеновским облучением, не противопоказан в период лактации и беременности, а также не имеет ограничений по весу и росту пациентов. В то же время у ультразвуковой денситометрии есть ряд существенных недостатков, из-за чего она не получила широкого распространения. Метод является операторозависимым и очень чувствителен к условиям проведения исследования: в частности, на результат могут оказывать влияние такие факторы, как влажность кожи, угол приложения датчика, сила нажатия на датчик. Кроме того, в процессе ее выполнения измеряется плотность лучевой или пяточной кости, а не позвонков и шейки бедра. Наконец, метод имеет гораздо более низкую чувствительность и специфичность по сравнению с двухэнергетической рентгеновской абсорбциометрией [23, 24].
Преимущества REMS
REMS имеет ряд преимуществ, которые определяют клиническое значение и перспективы этого метода:
- компактность и мобильность оборудования;
- отсутствие специальных требований к помещению;
- отсутствие лучевой нагрузки при выполнении исследования;
- более комфортное (в сравнении с другими методами) проведение исследования как для врача, так и для пациента;
- оценка хрупкости скелета на основе качества структуры кости с помощью показателя хрупкости FS, который не зависит от денситометрической оценки;
- технология автоматической идентификации зон интереса при сканировании, короткое время для формирования итогового отчета; продолжительность сканировании бедра 40 с, поясничного отдела позвоночника – 80 с;
- возможность проведения при беременности;
- возможность проведения при установке металлических конструкций, вертебропластики в зоне сканирования;
- возможность выполнения и оценки истинной плотности костной ткани у пациентов, скомпрометированных выраженным денегеративно-дистрофическим процессом в поясничном отделе, кальцификацией брюшного отдела аорты (характерно для пациентов старшей возрастной группы);
- отсутствие ограничений по весу и росту пациента.
Клинические перспективы использования REMS
Диагностическая точность REMS по сравнению с DXA была исследована в европейском многоцентровом клиническом исследовании. Всего в исследование было включено 4307 пациентов, проведено 4271 сканирование шейки бедренной кости и 4245 сканирований поясничного отдела позвоночника. 300 пациентов (8,3%) для набора данных по шейки бедренной кости и 283 пациента (8,2%) для набора данных поясничного отдела позвоночника сообщили об имеющемся в анамнезе остеопоротическом переломе. Полученные результаты показали очень высокую корреляцию (r=0,93 по шейке бедра и r=0,94 по поясничному отделу позвоночника) между результатами измерения МПКТ и Т-показателем методами DXA и REMS в популяции женщин в возрасте от 30 до 90 лет. Наряду с этим результаты выявления пациентов с ОП продемонстрировали высокую чувствительность (91,7%) и специфичность (92,0%) для поясничного отдела позвоночника (91,5%) и шейки бедренной кости (91,8%), положительную прогностическую значимость в диапазоне 82–86% и отрицательную прогностическую значимость более 97% для обоих референтных анатомических участков. Более того, измеренные методом REMS Т-показатели были ассоциированы с обнаружением предыдущих остеопоротических переломов, даже в несколько большей степени, чем соответствующие значения Т-показателей, полученные методом DXA [25].
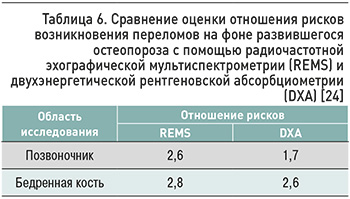
В пятилетнем наблюдательном исследовании Schnitzer T.J. et al. [24] изучалась перспективность использования значений T-критерия, полученного при диагностике методом REMS, для идентификации пациентов с риском возникновения переломов на фоне развившегося ОП. В нем приняли участие 1516 женщин в возрасте 30–90 лет с ИМТ ≤35 кг/м2. Обследование включало денситометрию поясничного отдела позвоночника и проксимального отдела бедра с помощью DXA и REMS. Эффективность обоих методов при прогнозировании переломов была сравнительно оценена путем определения чувствительности и специфичности в идентификации пациентов с переломами с использованием типичного порога МПКТ для диагностики ОП (т.е. T-показатель ≤-2,5). Результаты этого исследования отражены в таблице 6.
Многоцентровое клиническое исследование с участием 7 итальянских центров показало высокую внутри- и межисследовательскую воспроизводимость результатов REMS, что делает этот метод практически операторонезависимым. Внутриисследовательская точность воспроизводимости REMS, выраженная в виде коэффициента вариации корня из среднеквадратных значений (RMS-CV), составила 0,38% (95% доверительный интервал: 0,28–0,48) для поясничного отдела позвоночника и 0,32% (95% доверительный интервал: 0,24–0,40) для шейки бедренной кости [26].
В другом исследовании, посвященном способности REMS идентифицировать остеопорозный статус у пожилых женщин с сахарным диабетом 2-го типа, было установлено, что при использовании этого метода частота обнаружения ОП среди больных диабетом выше по сравнению с DXA (47,0 и 28,0% соответственно). В то же время доля женщин с сахарным диабетом 2-го типа, классифицированных с помощью DXA как пациентки с остеопенией или нормальными показателями костной ткани, была выше, чем при применении REMS (48,8 и 23,2% против 38,6 и 14,5% соответственно) [28].
На экспертном консенсусном совещании, организованном Европейским обществом клинических и экономических аспектов остеопороза, остеоартрита и заболеваний опорно-двигательного аппарата (ESCEO) [30], были утверждены следующие тезисы:
- REMS представляет собой первый доступный метод прямого неионизирующего исследования МПК поясничного отдела позвоночника и бедренной кости;
- имеющиеся научные данные описывают рассчитанную по REMS МПК как точный диагностический параметр, что позволяет прогнозировать риск нового клинического перелома в репрезентативной выборке женщин;
- REMS продемонстрировал дополнительный потенциал в оценке хрупкости скелета на основе определения качества структуры кости через параметр хрупкости FS, который не зависит от денситометрической оценки.
Ожидается, что в ближайшем будущем ввиду вышеназванных преимуществ REMS будет более активно внедряться в рутинную клиническую практику. На настоящий момент REMS может использоваться для описания характеристик костной ткани. Этот метод демонстрирует близкие к рентгеновской DXA (современному стандарту диагностики состояния костной ткани) показатели и имеет перспективы дальнейшего развития. Целесообразно начать внедрение REMS-денситометрии в медицинских организациях России, где применение рентгеновской остеоденситометрии не представляется возможным.



