Известно, что артериальная гипертензия (АГ) является одной из важнейших причин развития хронических форм недостаточности кровообращения головного мозга, геморрагического и ишемического инсультов (первичного и повторного), когнитивных расстройств (КР) и сосудистой деменции [1]. Установлено, что церебральная гемодинамика находится под постоянным контролем системы мозговой ауторегуляции – сложной нейрогуморальной системы, которая снижает мозговой кровоток при избытке притока крови и увеличивает – при его дефиците. Система ауторегуляции контролирует приток крови к головному мозгу в пределах среднего артериального давления (АД) от 60 до 150 мм рт. ст. (среднее АД = систолическое АД [САД] – диастолическое АД + 1/3 пульсового давления). У больных АГ эти пределы смещены вверх вследствие повышения сосудистого сопротивления, и нижняя граница САД составляет 85 мм рт. ст., что создает предпосылки для плохой переносимости гипотензивных состояний.
В структуре цереброваскулярных болезней одно из ведущих мест занимает дисциркуляторная энцефалопатия (ДЭП). Термин ДЭП обозначает медленно прогрессирующее диффузное поражение головного мозга (мозговой паренхимы), обусловленное нарастающим ухудшением мозгового кровообращения (Е.В. Шмид и Г.А. Максудов, 1971). По мнению В.А. Яковлева и А.В. Ягоды (2012), ведущими патоэтиологическими факторами в развитии ДЭП являются: в 42% случаев – атеросклероз церебральных артерий, в 14,5% – АГ, в 39,6% – их сочетание; остальные причины составляют 3,9%.
ГИПЕРТОНИЧЕСКАЯ ЭНЦЕФАЛОПАТИЯ
Хроническая гипертоническая энцефалопатия (ГЭ) – медленно прогрессирующее диффузное и очаговое поражение вещества головного мозга, обусловленное хроническим нарушением мозгового кровообращения, связанным с длительно существующей неконтролируемой АГ (как эссенциальной, так и вторичной), и является вариантом ДЭП. ГЭ имеет свои клинические и патоморфологические особенности, может проявляться в молодом и среднем возрасте, чаще в 30–50 лет. Прогрессирование заболевания может развиваться быстро при значительном колебании АД и повторных гипертонических кризах. Высокое пульсовое АД, характерное для изолированной систолической АГ у лиц пожилого возраста, считается независимым фактором риска развития цереброваскулярных осложнений при АГ.
Впервые ГЭ описали нейрофизиолог И.В. Ганнушкина и невролог Н.В. Лебедева в 1987 г. Авторы подчеркивали, что для ГЭ характерно преимущественное поражение сосудов микроциркуляторного русла. Развивается комплекс острых и хронических изменений интрацеребральных сосудов и артерий поверхности мозга с формированием фибриноидных некрозов стенок сосудов, их плазматического пропитывания, милиарных аневризм, гипертонических стенозов, тромбозов и лакунарных инфарктов. К признакам ГЭ относятся криблюры – расширенные периваскулярные пространства, возникновение которых может быть связано с персистирующим периваскулярным отеком или с повреждением ткани мозга пульсирующими артериями при АГ. Частые кризы приводят к нарушению проницаемости гематоэнцефалического барьера для белков и тканевой жидкости, что способствует прогрессированию лейкоареоза.
Важнейшим принципом диагностики ГЭ является констатация причинно-следственной связи между имеющимися у больного клиническими проявлениями АГ и цереброваскулярным заболеванием. Для постановки диагноза ГЭ обязательным критерием считают АГ >180/90 мм рт. ст. в течение 5–10 лет, а также признаки гипертонической ангиопатии сосудов сетчатки, гипертрофию миокарда, увеличение толщины комплекса интима-медиа и атеросклероз магистральных сосудов головы, усиление II тона на аорте (симптом Сиротинина–Куковерова). Важным следствием изменений структуры сосудистой стенки является нарушение ауторегуляции мозгового кровообращения. Экспериментальные данные свидетельствуют о том, что расстройства ауторегуляции в первую очередь наблюдаются в белом веществе головного мозга и в меньшей степени – в коре больших полушарий. Поэтому следует напомнить прописную истину, что коварство АГ заключается в том, что, протекая длительное время бессимптомно, с эпизодами церебральной симптоматики, в конце концов она оказывает повреждающее действие на сосудистую систему и вещество головного мозга, приводя к формированию клинической картины ГЭ.
В целом можно выделить следующие факторы риска ГЭ:
- неконтролируемая АГ;
- гипертонические кризы (нарушение гематоэнцефалического барьера);
- высокая вариабельность АД;
- высокая ночная АГ;
- избыточное снижение АД, особенно в ночное время (включая ятрогенное);
- высокое пульсовое АД.
Присоединение атеросклеротических процессов к АГ приводит к более быстрому прогрессированию смешанной ДЭП. Существенным отличием ГЭ от атеросклеротической энцефалопатии является преимущественное массивное поражение мелких ветвей сосудов головного мозга диаметром 70–500 мкм, а не крупных экстра- и интракраниальных сосудов, приводящее к нарушению мозгового кровообращения. Однако клинически разделить эти состояния бывает достаточно трудно [2].
СТАДИИ ГИПЕРТОНИЧЕСКОЙ ЭНЦЕФАЛОПАТИИ И КЛИНИЧЕСКИЕ СИНДРОМЫ
Еще В.А. Карлов и соавт. (1987) считали одним из ведущих факторов энцефалопатии у больных АГ тотальный и равномерный застой крови в венозной системе головы, возможно, общую флебопатию и наличие умеренной симметричной гидроцефалии. Клиническим проявлениям энцефалопатии и ее течению посвящено немало работ, и все же четкого представления об этом патологическом состоянии не существует [3]. В настоящее время различают три стадии ГЭ:
- I стадии свойственна преимущественно субъективная симптоматика: быстрая утомляемость, слабость, снижение работоспособности, памяти, внимания, признаки небольшого неврологического дефицита – анизорефлексия, положительные рефлексы орального автоматизма, пирамидные знаки; нарушения праксиса и гнозиса можно выявить при проведении специальных тестов;
- II стадия характеризуется усугублением жалоб и рядом неврологических синдромов – вестибулярным, цефалгическим, пирамидным, дискоординаторным, амиостатическим, атактическим, дисмнестическим. При этом обычно доминирует один из перечисленных синдромов. Данные синдромы обусловлены перенесенными инсультами. Отмечается снижение социальной и профессионоальной адаптации;
- на III стадии возникают грубые парезы и параличи, расстройства чувствительности, нарушения функции тазовых органов, психическая дегенерация; наблюдаются полная утрата трудоспособности, нарушение социальной и бытовой адаптации.
Клиническое ухудшение протекает одновременно с ухудшением церебрального кровотока, часто в соответствии с общесоматическим статусом больных. При развитии различных клинических симптомом и синдромов у больных АГ очаги нарушения мозгового кровообращения образуются преимущественно в области подкорковых узлов и прилегающего белого вещества – во внутренней капсуле, лентикулярном ядре, зрительном бугре. У больных АГ выявляется множество лакун размером от 0,1 до 1,0 см. Их развитие значительно ухудшает прогноз течения ГЭ и снижает возможности медикаментозной терапии, даже при достижении хорошего контроля АГ. Кроме того, лакунарные инсульты являются факторами риска развития геморрагического инсульта [4].
На всех стадиях ГЭ (ДЭП) наблюдаются КР. Важно подчеркнуть, что КР – это прогрессирующее состояние, которое со временем трансформируется в деменцию. Так, если в группе пациентов определяются умеренные КР, то через год у 5–15% из них разовьется деменция, а через 5 лет деменции будут подвержены уже 100% больных [5]. Поэтому очень важно своевременное, еще на ранних стадиях заболевания, выявление КР у больных АГ.
Когнитивные функции – наиболее сложные функции головного мозга, с помощью которых осуществляется процесс рационального познания мира и обеспечивается целенаправленное взаимодействие с ним. Выделяют пять основных функций: гнозис, праксис, интеллект, память, речь (В.В. Захаров, А.Б. Локшина, 2009). Гнозис – это восприятие информации, способность соединять элементарные ощущения в целостные образы; больной при агнозии видит предмет, может его описать, но не узнает его. Праксис – произвольное целенаправленное двигательное действие; больные при апраксии не могут выполнить то или иное действие вследствие утраты навыка, несмотря на отсутствие пареза. Интеллект – способность к анализу информации, выявлению сходств и различий, общего и частного, главного и второстепенного, способность к абстрагированию, решению задач и построению умозаключений. Память – способность запечатлевать, сохранять и многократно воспроизводить полученную информацию. Следует отметить, что субъективные жалобы больных на память не соответствуют истинным ее нарушениям, выявляемым с помощью специальных методов исследования. Речь – способность понимать обращенную речь и выражать свои мысли вербальным способом (словами).
Согласно классификации Н.Н. Яхно (2005), выделяют легкие, умеренные и тяжелые КР. Так, на I стадии ГЭ наблюдаются легкие расстройства (нарушение концентрации внимания, трудности сосредоточения и переключения с одной деятельности на другую, незначительное снижение оперативной памяти), на II стадии – умеренные (снижается мыслительная продукция, отмечается вязкость мышления, сужается круг интересов, продолжается дальнейшее усугубление КР), на III стадии – выраженные (тяжелые) КР (формирование грубых когнитивных нарушений, снижение критики, изменения личности, немотивированные поступки, неадекватные реакции и изменения психики, вплоть до социальной дезадаптации и деменции).
Факторами риска развития КР и деменции, кроме АГ, являются сахарный диабет, дислипопротеидемия, курение и наследственная предрасположенность.
Таким образом, важнейшим клиническим проявлением ГЭ являются когнитивные нарушения и деменция. Как справедливо отмечают Е.В. Ощепкова (2004) и С.А. Румянцева (2010), изменения, происходящие при ГЭ, представляют собой «церебро-сосудистый континуум», причем при ГЭ I стадии они соответствуют поражению органов-мишеней при АГ II стадии, а II–III стадии ГЭ представляют собой ассоциированное клиническое состояние (АГ III стадии) [6, 7].
Все вышесказанное подчеркивает значимость раннего выявления ГЭ не только неврологами, но и кардиологами, терапевтами и врачами общей практики. Для оценки КР рекомендуется проводить нейропсихологическое тестирование, позволяющее выявить и оценить эти нарушения. Для этого используется наиболее оптимальный тест Мини-Ког (S. Borson, 2000), представляющий собой комбинацию тестов на запоминание трех слов и рисование часов: 1) повторить за врачом и запомнить три слова (например: яблоко, стул, ромб); 2) нарисовать циферблат со стрелками и поставить время (например, без десяти час); 3) назвать три слова, которые запоминались в начале теста. Тест интерпретируется следующим образом: если пациент назвал три слова, то грубых КР нет, если не вспомнил ни одного, то КР есть. Если больной вспомнил одно или два слова, то анализируется рисунок часов. Если рисунок правильный, то КР нет, если неправильный, то КР есть. Чувствительность теста составляет 99%, специфичность – 93%. Тест можно использовать у больных с нарушением речи и языковым барьером [8].
С учетом выявленных факторов риска и неврологических изменений у больных АГ необходимо определить специфические подходы к лечению таких больных. В целом алгоритм диагностики ГЭ проводится согласно стандартам ведения больных АГ с цереброваскулярными заболеваниями. Хотелось бы отметить важность проведения исследований: электроэнцефалографии, магнитно-резонансной (МРТ) и компьютерной (КТ) томографии головного мозга. Так, на электроэнцефалограмме при ГЭ чаще регистрируются дезорганизованный альфа-ритм, большое количество быстрых волн, билатеральные пароксизмы тета- или дельта-волн. Доказана взаимосвязь между прогрессированием АГ и изменениями функционирования неспецифической системы головного мозга. При нарастании тяжести заболевания диффузно снижаются мощностные характеристики биопотенциалов всех отделов головного мозга, что указывает на прогрессивное ослабление обменных процессов в головном мозге и активности водителей ритмов биоэлектрической активности (З.В. Зверева и соавт., 2010). На МРТ у больных ГЭ определяются расширенная желудочковая система, уменьшение контрастности между белым и серым веществом, снижение сигнала от хвостатого ядра и скорлупы и точечные очажки ликворного сигнала в области базальных ганглиев, соответствующие расширенным периваскулярным пространствам Вихрова–Робена. На КТ головного мозга выявляются множественные мелкие лакунарные очаги – участки низкой плотности в белом веществе мозга, особенно в его паравентрикулярных зонах.
При ГЭ (ДЭП) у пациентов с легкой или умеренной степенью церебральной ишемии отмечается активация механизмов синаптической пластичности. Маркерами развития и течения процессов нейропластичности являются определяемые в цереброспинальной жидкости многофункциональный белок S100, глиальный кислый фибриллярный белок, нейротрофины. Белки семейства S100 принимают участие в механизмах транскрипции и дифференциации клеток, энергетическом метаболизме, осуществляют внутри- и внеклеточное регулирование многих процессов, участвуют в регуляции клеточного цикла. Наиболее специфичный для мозга белок S100В через фосфорилирование других белков участвует в передаче сигнала, обеспечивая тем самым пластические процессы. При тяжелой хронической церебральной ишемии пластичность реализуется в основном посредством механизмов реорганизации сохранившихся функционально активных синапсов, что, вероятно, является недостаточным для оптимального обеспечения эффективной интеграции [9, 10].
ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ ГИПЕРТОНИЧЕСКОЙ ЭНЦЕФАЛОПАТИИ
Основными принципами лечения ГЭ являются:
- коррекция сосудистых факторов риска с нормализацией АД;
- восстановление мозгового кровотока;
- улучшение церебрального метаболизма.
Лечение ГЭ у больных разных возрастных групп с разными стадиями заболевания должно проводиться индивидуально с учетом сопутствующей соматической патологии. Исходя из патогенеза имеющихся нарушений, оно должно включать в себя антигипертензивную, гиполипидемическую терапию (по показаниям), курсовое назначение цереброваскулярных, антиагрегантных, нейрометаболических и нейропротективных препаратов, антиоксидантов.
Для лечения АГ рекомендуется использовать основные группы антигипертензивных лекарственных средств: ингибиторы ангиотензинпревращающего фермента (иАПФ), диуретики, β-адреноблокаторы (БАБ), блокаторы рецепторов ангиотензина II (БРА), пролонгированные антагонисты кальция и агонисты имидазолиновых рецепторов. АД необходимо снижать постепенно, избегая эпизодов гипотонии. Особый контроль целесообразен в ночные часы. Доказана значимость адекватного снижения АД, в первую очередь САД, для снижения риска инсульта. В начальный период терапии АГ при наличии ГЭ основная задача состоит в нормализации АД, предупреждающей повреждение сосудов, и его стабилизации, возможно, на несколько повышенном уровне, обеспечивающем оптимальную перфузию мозга в условиях нарушенной ауторегуляции мозгового кровообращения. Следует стремиться к стабилизации АД на верхней границе нормы (САД должно поддерживаться на уровне 135–150 мм рт. ст.). Необходимо избегать приема антагонистов кальция короткого действия (например, нифедипина), провоцирующих резкие колебания АД. Положительное действие иАПФ, БРА, диуретиков и пролонгированных антагонистов кальция на мозговое кровообращение и структурные изменения сосудов головного мозга приводит к уменьшению частоты развития повторных инсультов на 30–40% [11–14]. Согласно клиническим рекомендациям ВНОК (2010) и РМАОГ (2013), больным АГ с признаками симпатикотонии предпочтительно назначать высокоселективные БАБ второго (бисопролол, метопролола сукцинат замедленного высвобождения) и третьего (небиволол и карведилол) поколения, имеющие дополнительные терапевтические свойства. В клинической практике предпочтение отдается β1-селективным БАБ, которые лишены неблагоприятных побочных эффектов, обусловленных влиянием на β2-адренорецепторы (бронхоспазм, вазоконстрикция, повышение общего сопротивления с развитием неблагоприятных метаболических эффектов: нарушение углеводного и липидного обмена) [12].
Агонисты имидазолиновых рецепторов (моксинидин, рилменидин) являются современными лекарственными средствами с центральным механизмом действия – снижают активность сосудодвигательного центра продолговатого мозга. Доказано, что при длительной терапии моксонидином у пожилых больных с АГ 1–2 степени обеспечивается оптимальное снижение АД в ночное и дневное время. По мнению Л.Н. Максимовой и М.Л. Максимова (2014), монотерапия моксонидином в течение 24 нед оказывает положительное влияние на когнитивные функции.
На всех стадиях ГЭ к лечению основного заболевания – АГ – необходимо добавлять препараты, улучшающие мозговой кровоток и метаболизм нервной ткани, а также действующие на внутренние факторы, способные повлиять на прогрессирование энцефалопатии. С целью предупреждения нарастания атеросклеротического процесса необходима нормализация жирового обмена: снижение индекса массы тела, диета с низким содержанием жира, показано назначение статинов при дислипопротеидемии (общий холестерин >5,2 ммоль/л, липопротеиды низкой плотности >3,0 ммоль/л) в сочетании с гемодинамически значимым стенозом сонной или других брахиоцефальных артерий, атеросклерозом периферических артерий, аневризмой брюшной аорты, сахарным диабетом, а также перенесенным атеротромботическим инсультом.
С целью улучшения реологических свойств крови показаны антиагреганты (ацетилсалициловая кислота, тиклопидин, клопидогрел, дипиридамол).
На всех стадиях ГЭ применение препаратов, действующих на сосудистую стенку, улучшающих метаболизм мозговой ткани и обладающих нейропротективными свойствами, является обязательным. Пациентам с клиническими проявлениями венозной энцефалопатии рекомендуются препараты с венотоническим эффектом: эуфиллин, экстракт гинкго билоба и т.д. (А.И. Федин, 2012).
В России ассортимент нейропротекторов достаточно широк, однако только единицы имеют доказательную базу, показанную в клинических исследованиях [15]. Кроме того, современная задача медикаментозной терапии – это поиск не только эффективности и безопасности лекарственного препарата, но и возможности применения комбинации препаратов с различными механизмами действия [16]. Т.е. фармакотерапия ГЭ должна быть направлена не только на восстановление кровотока, но и устранять ряд патологических реакций: нейрометаболических, нейромедиаторных, нейротрофических и др.
Известно, что функции головного мозга напрямую зависят от непрерывной доставки к нему кислорода и глюкозы, поэтому наблюдаемые нарушения мозгового кровообращения при ГЭ приводят к постепенному ишемическому повреждению мозговой ткани. При ишемии наблюдаются нарушения процессов липолиза, поступления ионов кальция в цитозоль, активируется протеинкиназа С, значительно возрастает перекисное окисление липидов. Развивается каскад сложных патофизиологических реакций с чрезмерным образованием кислородных радикалов в митохондриях, растет оксидативный стресс, и, как следствие, развиваются отек и разрушение органелл, повреждается целостность мембран и происходит некроз клеток [17]. Исходя из патогенетической роли гипоксии и оксидативного стресса, в качестве одного из перспективных методов терапии ГЭ рассматривается применение антиоксидантов и ноотропных препаратов, являющихся специфическими корректорами метаболизма головного мозга.
В современной литературе наиболее широко обсуждается применение этилметилгидроксипиридина сукцината (Нейрокс) и его комбинации с цитиколином (Нейпилепт). Нейрокс (ЗАО «Сотекс») свои фармакологические свойства реализует на трех уровнях: нейрональном, сосудистом и мембранопротективном. Препарат обладает мощным антиоксидантным эффектом, способен проходить гематоэнцефалический барьер, характеризуется высокой биодоступностью. Его фармакотерапевтические и фармакодинамические свойства подробно представлены в публикациях [16, 17]. Проведенные клинические исследования констатируют терапевтическую эквивалентность Нейрокса с оригинальным препаратом. Нейрокс не имеет значимых побочных эффектов, является низкотоксичным и хорошо переносится пациентами. Препарат не влияет на системную гемодинамику, улучшает метаболизм и кровоснабжение головного мозга. В повышенных концентрациях обладает антиамнестическим действием. Кроме того, отмечено положительное влияние Нейрокса на микроциркуляторное русло, реологические показатели крови, тромбоцитарное звено гемостаза. Отмечено положительное влияние на метаболические процессы в ишемизированном миокарде [18], что указывает на его полисистемное действие.
Другой препарат – цитиколин (Нейпилепт, ЗАО «Сотекс») – ЦДФ-холин, широко применяется в Европе, США, Японии при различных формах цереброваскулярных заболеваний. Нейпилепт производится из изготовленной в Италии субстанции высокого качества. Результаты сравнительных многоцентровых исследований показали его высокую клиническую эффективность, безопасность, минимальное количество побочных явлений и совместимость с другими лекарственными средствами. Препарат обладает высокой (100%) биодоступностью при пероральном и внутривенном применении. После всасывания он распадается на холин и цитидин, которые проникают через гематоэнцефалический барьер, и в головном мозге вновь синтезируется цитиколин. С целью предупреждения постинсультных КР доказана его безопасность и эффективность длительного применения [16, 17, 19]. С современных позиций цитиколин как естественный продукт биохимических процессов следует рассматривать в качестве универсального мембранопротектора, способствующего сохранению свойств биологических мембран у больных с тяжелой соматической патологией, в остром и в периоде восстановления ишемического инсульта, черепно-мозговой травмы, болезнью Паркинсона, в том числе и ГЭ с КР.
Таким образом, Нейрокс и Нейпилепт реализуют свои эффекты на разных уровнях ишемических нарушений и оказывают взаимодополняющее действие.
Для коррекции когнитивных расстройств применяется еще один нейропротектор – холина альфосцерат. Препарат Церетон (ЗАО «Сотекс») содержит 40% холина, который в организме превращается в активный метаболит – фосфорилхолин, активизирующий синтез ацетилхолина в пресинаптических терминалях нейрона. По мнению И.Ф. Белиничева и соавт. (2009), основными механизмами действия Церетона являются: 1) восстановление межнейронной связи и улучшение нейротрансмиссии за счет донорства ацетилхолина; 2) участие в репарации мембран нейронов; 3) уменьшение выраженности дегенерации свободных жирных кислот. Церетон является парасимпатомиметиком центрального действия. Кроме восполнения дефицита холинергической системы при ишемии, препарат обладает анаболическим эффектом, способствуя стимуляции синтеза глицеролипидов за счет предшественников фосфолипидов мембран из продуктов его распада [20].
Алгоритм применения нейропротекторов в клинической практике представлен в рисунке.
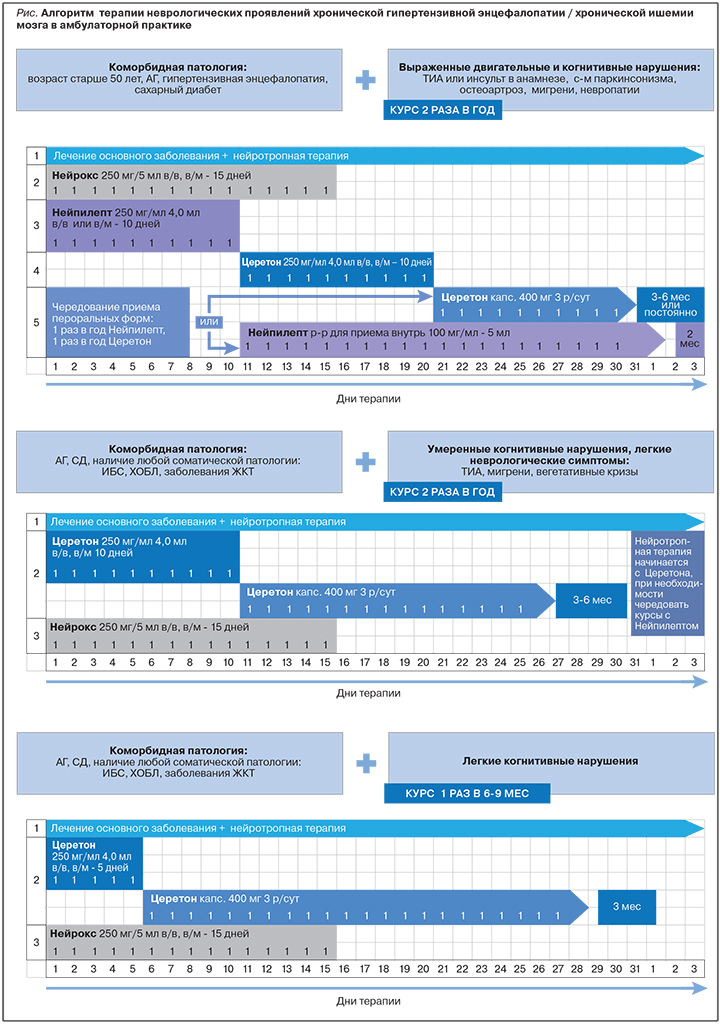
ЗАКЛЮЧЕНИЕ
При ведении больных с цереброваскулярной патологией (ГЭ) необходимо использовать рациональную комплексную терапию для коррекции сосудистых факторов риска с нормализацией АД и церебрального метаболизма. С учетом различных механизмов действия: Нейрокса – как мощного антиоксиданта и мембранопротектора, Нейпилепта – репаратора нейрональных мембран, уменьшающего дегенерацию свободных жирных кислот, и Церетона – повышающего продукцию и выделение из терминалей ацетилхолина, приводящего к значимому улучшению нейротрансмиссии, весьма разумно использовать комбинированную терапию с применением указанных нейропротекторов для достижения более выраженного клинического эффекта. Рекомендуется назначать нейропротективную терапию у больных с АГ на ранних этапах заболевания с минимальными клиническими проявлениями для профилактики когнитивных нарушений.



