Хроническая обструктивная болезнь легких (ХОБЛ) и хроническая сердечная недостаточность (ХСН) часто сопутствуют друг другу. Оба заболевания имеют общие факторы риска и патогенетические механизмы, включая курение, преклонный возраст и системное воспаление. Вероятность развития ишемической болезни сердца выше у пациентов с умеренной или тяжелой обструкцией воздушного потока и высокой концентрацией циркулирующего C-реактивного белка (СРБ). Системное воспаление ускоряет прогрессирование коронарного атеросклероза, что способствует увеличению риска сердечно-сосудистой заболеваемости и смертности у больных ХОБЛ [1].
Механизмы взаимоотношений кардиоваскулярной патологии и ХОБЛ изучены недостаточно. Обсуждается патогенетическая роль системного воспаления, оксидативного стресса, эндотелиальной дисфункции (ЭД), повреждения сосудистой стенки, формирующегося под влиянием гипоксемии, сигаретного дыма. Дисбаланс между высвобождением вазоактивных веществ из эндотелия в виде снижения концентрации оксида азота и повышения концентрации эндотелина 1 приводит к увеличению ригидности артерий, усугубляющему сосудистую дисфункцию [2]. Повышенная жесткость, с одной стороны, отражает далеко зашедшие изменения структуры и функции артерий, а с другой – существенно влияет на гемодинамику, увеличивая постнагрузку на миокард и ухудшая коронарную перфузию у лиц с ХОБЛ [3]. В настоящее время скорость распространения пульсовой волны по сосудам эластического типа рассматривается как один из значимых прогностических критериев и является независимым маркером сердечно-сосудистого риска [4].
В доступных литературных источниках мы не нашли работ, посвященных изучению жесткости магистральных артерий в комплексе с уровнем СРБ и сосудистым компонентом эндотелиальной функции у пациентов с ХСН и ХОБЛ, что и послужило целью исследования.
МАТЕРИАЛ И МЕТОДЫ
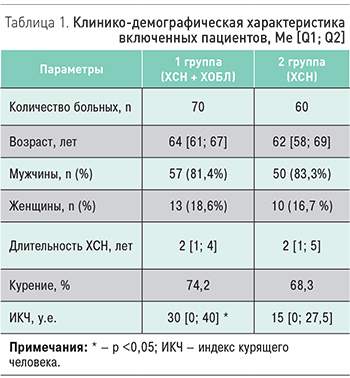 В исследование включены 130 больных с ХСН ишемического генеза (перенесенный острый инфаркт миокарда давностью от 1 года до 5 лет) в возрасте 45–70 лет обоего пола: 70 больных с ХСН II–III функционального класса (NYHA) и ХОБЛ I–III стадии по классификации GОLD (2018) [5], 60 больных с ХСН без сопутствующей ХОБЛ. Группы были сопоставимы по основным клинико-демографическим показателям и терапии ХСН (табл. 1).
В исследование включены 130 больных с ХСН ишемического генеза (перенесенный острый инфаркт миокарда давностью от 1 года до 5 лет) в возрасте 45–70 лет обоего пола: 70 больных с ХСН II–III функционального класса (NYHA) и ХОБЛ I–III стадии по классификации GОLD (2018) [5], 60 больных с ХСН без сопутствующей ХОБЛ. Группы были сопоставимы по основным клинико-демографическим показателям и терапии ХСН (табл. 1).
Всем больным проводили стандартное клиническое обследование.
Для анализа жесткости сосудистой стенки использовали сфигмографическую приставку АПК «Поли-Спектр-8/Е». Оценивали СРПВ по сосудам эластического (Сэ) и мышечного (См) типа. После проведения окклюзионной пробы изучали сосудистый компонент функции эндотелия.
Концентрацию С-реактивного белка в крови оценивали с помощью турбидиметрического метода (Витал), референсные значения 0–8 мг/ мл.
Статистическую обработку данных проводили с использованием программы STATISTICA 6.0. Нормальность распределения значений в вариационном ряду оценивали по критерию Шапиро–Уилка. Критерию нормальности не соответствовал ни один из исследуемых показателей. Данные представлены в виде Me [Q1; Q3], где Me – медиана, [Q1; Q3] – 25 и 75 процентили соответственно, для качественных величин – частоты встречаемости (%). Сравнение признаков двух независимых выборок проводили с помощью критерия Манна–Уитни. В случае дихотомических показателей значимость различий долей оценивалась с использованием точного метода Фишера. Корреляционный анализ выполняли по методу Спирмена. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p <0,05.
Исследование проводилось в соответствии с этическими принципами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации (2008), трехсторонним соглашением по надлежащей клинической практике (ICH GCP), Конституцией РФ, Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
Проведение клинического исследования одобрено региональным этическим комитетом. Письменное информированное согласие получено у всех участников исследования до начала выполнения любых процедур исследования.
 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
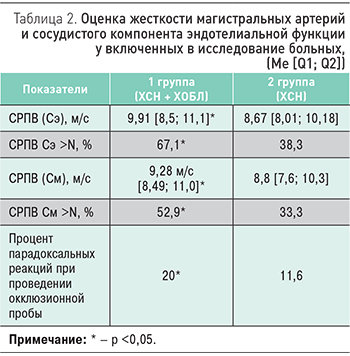
У больных ХСН и ХОБЛ выявлено достоверное увеличение СРПВ по сосудам как эластического, так и мышечного типа в сравнении с больными ХСН без ХОБЛ (9,91 [8,5; 11,1] vs 8,67 [8,01; 10,18] м/с) (табл. 2). Повышение СРПВ (Сэ) и СРПВ (См) выше нормы достоверно чаще встречалось у пациентов с коморбидной патологией, чем у больных с ХСН без сопутствующей ХОБЛ (67,1 vs 38,3% и 52,9 vs 33,3% соответственно), что свидетельствует о более выраженном ремоделировании сосудов у лиц 1 группы.
При проведении окклюзионной пробы парадоксальная реакция достоверно чаше встречалась у пациентов с ХСН и ХОБЛ в сравнении с лицами с ХСН без ХОБЛ (20,0 vs 11,6%), что является показателем более выраженной ЭД по сосудистому компоненту. В экспериментальных и клинических исследованиях показано, что дисфункция эндотелия обнаруживается уже на доклинической стадии атеросклероза коронарных артерий и по мере ее прогрессирования нарастает тяжесть клинических проявлений заболевания [3, 6].
Уровень СРБ крови был достоверно выше у пациентов с ХСН и ХОБЛ в сравнении с больными ХСН без сопутствующей ХОБЛ (18 [10; 34] vs 5,85 мг/мл) (табл. 3).
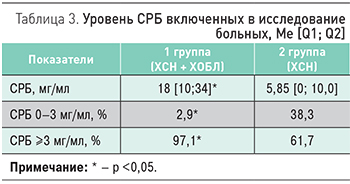 Процент больных с СРБ более 3 мг/мл был статистически значимо выше в группе 1 по сравнению с группой 2 (97,1 vs 61,7%), что свидетельствует о высоком риске сердечно-сосудистых осложнений у коморбидных больных. Хроническое системное, локальное и периваскулярное воспаление и эндотелиальная дисфункция являются потенцирующими друг друга факторами, способствующими прогрессированию жесткости крупных артерий, их ремоделированию [7].
Процент больных с СРБ более 3 мг/мл был статистически значимо выше в группе 1 по сравнению с группой 2 (97,1 vs 61,7%), что свидетельствует о высоком риске сердечно-сосудистых осложнений у коморбидных больных. Хроническое системное, локальное и периваскулярное воспаление и эндотелиальная дисфункция являются потенцирующими друг друга факторами, способствующими прогрессированию жесткости крупных артерий, их ремоделированию [7].
Корреляционный анализ выявил достоверные (p <0,05) связи между уровнем СРБ крови и СРПВ Сэ (r=0,18), длительностью ХОБЛ (r=0,26), давностью ХСН (r=0,3), а также между СРПВ Сэ и возрастом (r=0,31), СРПВ Сэ и ИКЧ (r=0,18).
Длительное воздействие сигарет приводит к повреждению легких и хроническому воспалению, которые сохраняются даже после прекращения курения. Активация системного воспаления поддерживает и увеличивает местное воспаление дыхательных путей, что ускоряет прогрессирование ХОБЛ. Также при ХОБЛ происходит активация таких воспалительных факторов, как фибриноген, IL-6, лейкоциты и тромбоциты, которые являются основными медиаторами для развития атеросклероза и сердечно-сосудистых заболеваний [8].
Таким образом, указанные патологические процессы, происходящие как при ХСН, так и при ХОБЛ, тесно связаны между собой, потенцируют друг друга при сочетании этих двух заболеваний и приводят к активному повреждению сосудистого русла, увеличивая сердечно-сосудистый риск у данной категории пациентов.
ЗАКЛЮЧЕНИЕ
У пациентов с сочетанием ХСН и ХОБЛ отмечается достоверное увеличение жесткости магистральных артерий по артериям как эластического, так и мышечного типов в сравнении с пациентами с ХСН без ХОБЛ.
У больных с коморбидной патологией более выражена эндотелиальная дисфункция (сосудистый компонент) в отличие от больных с ХСН без сопутствующей ХОБЛ, что подтверждается статистически значимым увеличением количества парадоксальных реакций при проведении окклюзионной пробы.
У пациентов с ХСН и сопутствующей ХОБЛ, в отличие от больных с ХСН без ХОБЛ, отмечено достоверное увеличение уровня СРБ в сыворотке крови.
Выявлены статистически значимые связи между параметрами, характеризующими жесткость сосудистой стенки магистральных артерий, и степенью выраженности воспаления.



