Стабильная стенокардия как проявление ИБС и ее осложнения остаются одной из наиболее важных проблем кардиологии. С возрастом распространенность стабильной стенокардии возрастает как у мужчин, так и у женщин. Ежегодная заболеваемость стенокардией составляет ≈1 % у мужчин в возрасте 45–65 лет, при этом заболеваемость среди женщин в возрасте <65 лет несколько выше. С возрастом этот показатель значительно увеличивается и достигает среди мужчин и женщин в возрасте 75–84 лет ≈4% [1].
Лечение больных стабильной стенокардией направлено на улучшение прогноза и в равной степени на повышение качества жизни (КЖ), т.е. на уменьшение количества ангинозных приступов и увеличение толерантности к физической нагрузке (ТФН). Несмотря на значительное возрастание количества новых хирургических методов лечения ИБС и современных стратегий медикаментозной терапии, у значительной части больных число приступов стенокардии напряжения сохраняется на высоком уровне. В настоящее время предложены и альтернативные методы лечения ИБС, направленные на уменьшение приступов стенокардии и повышение ТФН за счет улучшения перфузии миокарда. Однако эти методы апробированы пока лишь в доклинических исследованиях [2–4].
Экстракорпоральная ударно-волновая терапия (УВТ) сердца – относительно новый неинвазивный метод лечения ИБС, основанный на механическом воздействии низкоинтенсивной акустической волны в зоне ишемии миокарда. В свою очередь, механическое воздействие вызывает в стенках коронарных артерий, расположенных в зоне ишемии, «эффект сдвига» (shear stress), который запускает каскад реакций, приводящих к их вазодилатации и созданию условий для неоангиогенеза [5]. В ряде исследований было показано, что УВТ существенно сокращает зону ишемии миокарда за счет синтеза ангиогенных факторов роста (VEGF – Vascular endothelial growth factor) и привлечения эндотелиальных клеток-предшественников, а также снижает продукцию провоспалительных цитокинов, таких как фактор роста фибробластов и интерлейкин-8, тем самым обеспечивая неоангиогенез [6, 7].
В ряде исследований УВТ продемонстрировала свою эффективность и безопасность при лечении стабильной стенокардии. При этом было показано, что ее проведение в сочетании со стандартным медикаментозным лечением значительно уменьшало количество приступов стенокардии и потребность в применении нитратов, а также повышало ТФН [8].
В настоящее время в научных исследованиях активно используется перспективная технология количественной оценки сократительной функции миокарда Speckle Tracking Imaging – 2D Strain: она основана на отслеживании движения черных и белых пятен – пятнистых структур (или пикселей), выявляемых при проведении стандартной двухмерной эхокардиографии в толще миокарда левого желудочка (ЛЖ). Эта технология позволяет оценивать деформацию (Strain) и скорость деформации (Strain rate) миокарда ЛЖ. Деформация – это изменение длины изучаемого объекта (в данном случае ЛЖ или отдельных его сегментов) относительно исходного значения, а скорость деформации – время, в течение которого происходит эта деформация.
В середине 90-х гг. XX в. бурно развивалась технология цветной тканевой допплерэхокардиографии, которая представляла собой достаточно трудоемкий процесс, занимала достаточно продолжительное время и требовала высокой квалификации специалиста. Отслеживая перемещения уникальных пятнистых структур с помощью специального программного обеспечения, можно получить данные о деформации и скорости деформации (Strain rate) миокарда в автоматическом режиме независимо от угла измерения и смещения сердца во время сердечного цикла [9,10].
Сведения о возможностях, репрезентативности, точности и клиническом применении деформации миокарда стремительно нарастают. Методика Speckle Tracking Imaging – 2D Strain позволяет оценить как глобальную деформацию ЛЖ, так и деформацию каждого его сегмента в отдельности. Информацию, полученную в результате определения деформации миокарда ЛЖ по двухмерному изображению, предлагается использовать как альтернативу фракции выброса ЛЖ, при этом значительно повышается воспроизводимость этого метода [11, 10].
Наиболее изученным показателем, вошедшим в повседневную практику, является глобальная продольная деформация ЛЖ (GLS – Global longitudinal strain), который характеризует среднее значение деформации для всех сегментов ЛЖ. У разных производителей нормативы различаются, но находятся в диапазоне от -19 до -21%.
В последних рекомендациях по количественной оценке камер сердца определение деформации миокарда позиционируется как стандарт для характеристики сократительной функции ЛЖ [12].
МАТЕРИАЛ И МЕТОДЫ
В исследование включены 89 пациентов (66 мужчин и 23 женщины), средний возраст которых составил 67,9±8,1 лет. Все участники имели в анамнезе документировано подтвержденную ИБС. Из них 62 (69,7%) перенесли острый инфаркт миокарда, 43 (48,3%) была проведена ангиопластика коронарных артерий со стентированием, 45 (50,6%) – аортокоронарное шунтирование.
Также у всех больных в анамнезе были выявлены факторы риска ИБС: артериальная гипертензия наблюдалась у 84 (94,4%) пациентов, гиперхолестеринемия – у 64 (71,9%), курение – у 15 (16,9%), ожирение – у 37 (41,6%), сахарный диабет – у 25 (28,1%). У 35 (39,3%) пациентов выявлен отягощенный семейный анамнез. 3 пациента (3,4%) имели в анамнезе нарушение мозгового кровообращения, 17 пациентов (19,1%) – пароксизмальную форму фибрилляции предсердий.
Критериями включения в исследование были стенокардия II–IV функционального класса (ФК) по CCS (Canadian Cardiovascular Society) на фоне оптимальной медикаментозной терапии в течение не менее 1 мес до включения в исследование и стабильное течение ИБС >3 мес (отсутствие сердечно-сосудистых событий) до включения в исследование. Все пациенты не менее 4 нед до включения в исследование и на протяжении всего наблюдения получали оптимальную медикаментозную терапию, которая включала ингибиторы АПФ/антагонисты рецепторов ангиотензина II (АРА), бета-блокаторы, статины и ацетилсалициловую кислоту.
В исследование не включали пациентов с активным воспалительным процессом, тяжелыми нарушениями ритма и проводимости сердца, внутрисердечными тромбами, онкологическими заболеваниями.
Всем больным при включении в исследование и через 6 мес проводили измерение артериального давления (АД), частоты сердечных сокращений (ЧСС), антропометрических данных, электрокардиографию (ЭКГ), эхокардиографию (ЭхоКГ), пробу с физической нагрузкой (по модифицированному протоколу Bruce).
После включения в исследование все пациенты были рандомизированы на три группы. Первой группе (n=37) назначалась оптимальная медикаментозная терапия (ОМТ) в сочетании с УВТ по стандартному модифицированному протоколу (9 сеансов в течение 9 нед; воздействие ударной волной оказывалось на все сегменты ЛЖ). Вторая группа (n=16) получала ОМТ в сочетании УВТ по ускоренному модифицированному протоколу (9 сеансов в течение 3 нед; воздействие ударной волной оказывалось на все сегменты ЛЖ). В третьей группе (группе плацебо, n=36) применяли ОМТ в сочетании с плацебо УВТ (9 сеансов в течение 9 нед; воздействие оказывалось на все сегменты ЛЖ с имитацией ударной волны).
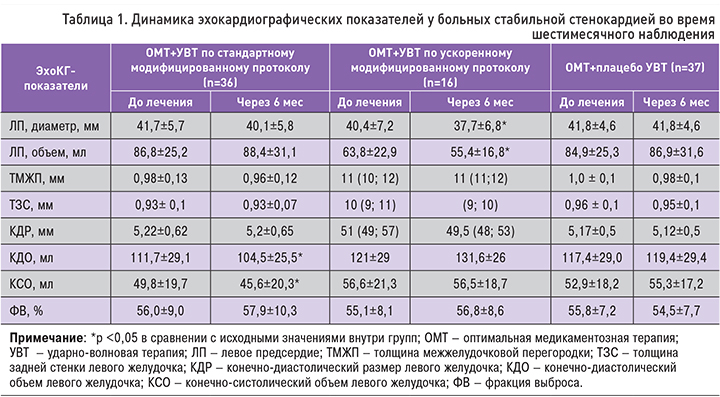
Двумерная ЭхоКГ проводилась всем пациентам при включении в исследование и через 6 мес после завершения курса УВТ. Это процедура проводилась в соответствии с рекомендациями по количественной оценке структуры и функции камер сердца у взрослых Американского общества эхокардиографии и Европейской ассоциации визуализации сердечно-сосудистой системы (EACVI) в пересмотре 2015 г. [13]. Оценивались конечно-диастолический размер (КДР, мм) и конечно-систолический размер (КСР, мм) ЛЖ, а также толщина межжелудочковой перегородки (ТМЖП, мм) и задней стенки (ТЗС, мм) ЛЖ с расчетом индекса относительной толщины, определяемого по формуле: (2×ТЗСд)/КДР. Конечно-диастолический объем (КДО, мл) и конечно-систолический объем (КСО, мл), а также ударный объем (мл) определялись из четырех- и двухкамерной позиций (Biplane) с использованием «метода дисков». Все измерения индексировались на площадь поверхности тела (ППТ) по формуле DuBois: ППТ=0,007184×ВЕСкг0,425 × РОСТсм0,725. Фракция выброса ЛЖ определялась по формуле (КДО – КСО)×100/КДО.
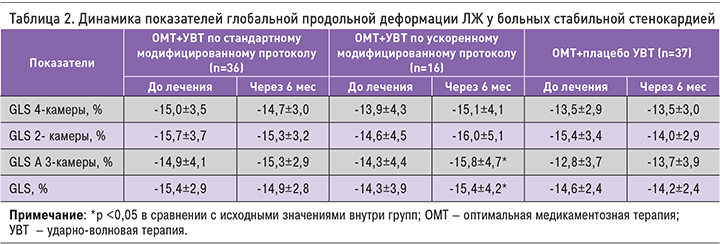
Оценка сегментарной глобальной продольной систолической деформации ЛЖ по его двумерному изображению проводилась посредством технологии 2D strain с использованием программного обеспечения EchoPAC v 7.1, GE (США). Эта технология основывается на анализе перемещения ультразвуковой серошкальной картины миокарда, записанной в В-режиме. Перед началом анализа проводилось определение границ эндокарда и эпикарда ЛЖ с последующем их обведением в четырех-, двух- и трехкамерной апикальных позициях. Далее компьютерная программа в каждой апикальной позиции выделяла шесть сегментов ЛЖ, каждый из которых был проанализирован отдельно; таким образом, проводилась оценка сегментарной деформации ЛЖ. Значение глобальной продольной систолической деформации ЛЖ высчитывалось как среднее арифметическое систолической продольной деформации его всех сегментов. Кроме того, путем анализа апикальных позиций в автоматическом режиме мы получали полярную диаграмму ЛЖ, которая отражает его сократимость на базальном, среднем и апикальном уровнях. Оператором проводилась оценка качества автоматического отслеживания с коррекцией контура при необходимости.
Статистическая обработка результатов исследования проводилась с помощью программ Statistica 10.0. При выборе метода сравнения данных учитывалась нормальность распределения признака в подгруппах с учетом критерия Шапиро–Уилкса. В случае отклонения распределения от нормального при описании использовались медиана, а также 25 и 75% процентили, а при нормальном распределении – среднее значение и стандартное отклонение. Нулевая гипотеза при сравнении групп отклонялась при уровне значимости менее 0,05. При сравнении зависимых групп использовался критерий Вилкоксона или парный t-критерий.
РЕЗУЛЬТАТЫ
Основные клинические результаты нашего исследования подробно опубликованы ранее [14–16]. УВТ сердца сопровождалась уменьшением частоты приступов стенокардии, приема короткодействующих нитратов и повышением ТФН, однако аналогичные изменения отмечались и в группе плацебо. В исходном состоянии сформированные группы достоверно не различались по основным клинико-инструментальным показателям.
При оценке ЭхоКГ-показателей через 6 мес наблюдения в группе ОМТ+УВТ по ускоренному модифицированному протоколу было выявлено достоверное уменьшение диаметра левого предсердия с 40,4±7,2 до 37,7±6,8 мм (p <0,01), объема левого предсердия с 63,8±22,9 до 55,4±16,8 мл (p=0,001), а также КСР с 31 (27; 39) до 29,5 (28; 31) мм (p=0,04). При оценке объемных показателей и фракции выброса ЛЖ значимых изменений не выявлено. В группе ОМТ+УВТ по стандартному модифицированному протоколу отмечено достоверное снижение КДО с 111,7±29,1 до 104,5±25,5 мл (p=0,003), а также значимое уменьшение КСО с 49,8±19,7 до 45,6±20,3 мл (p=0,01). Кроме того, отмечена тенденция к повышению фракции выброса ЛЖ с 56±9 до 57,9±10,3% (p=0,07). В группе плацебо достоверных изменений ЭхоКГ показателей в процессе наблюдения не выявлено (табл. 1).
Нами была проведена оценка глобальной продольной деформации миокарда ЛЖ по двухмерному изображению (Speckle tracking). Исходно во всех группах было отмечено снижение глобальной продольной деформации ЛЖ, несмотря на сохраненную фракцию выброса. Через 6 мес наблюдения в группе ОМТ+УВТ по ускоренному модифицированному протоколу выявлено достоверное улучшение глобальной продольной деформации ЛЖ: с -14,3±3,9 до -15,4±4,2% (p=0,02). При этом в группах ОМТ+УВТ по стандартному модифицированному протоколу и в группе плацебо подобных изменений выявлено не было (табл. 2).
ОБСУЖДЕНИЕ
В проведенном исследовании при 6-месячном наблюдении после курса УВТ сердца в сочетании с ОМТ ИБС отмечена лишь тенденция к улучшению параметров внутрисердечной гемодинамики. При этом фракция выброса ЛЖ имела более выраженную, достоверную динамику в группах, где пациенты в сочетании с ОМТ получали УВТ по стандартному и ускоренному модифицированному протоколу. В группе плацебо динамика была менее выражена. Отметим, что в исследовании, проведенном японскими учеными, у пациентов с перенесенным инфарктом миокарда к 6-му месяцу наблюдения УВТ сердца привела к достоверному улучшению фракции выброса ЛЖ в отличие от группы контроля (66±7 и 58±12%, р <0,05 соответственно). Также было отмечено уменьшение КДР ЛЖ в сравнении с группой контроля (47,5±4,6 и 50,0±5,9 мм, р=0,29 соответственно) [17]. Эти данные подтверждаются еще одним исследованием, которое провели С.Т. Мацкеплишвили с соавт.: в нем у 34 пациентов c верифицированным диагнозом «ИБС с исходно сохраненной фракцией выброса ЛЖ» после курса УВТ сердца этот показатель достоверно увеличивался с 51,1±1,02 до 57±1,7% (p <0,05) [18].
В сравнении с группой плацебо УВТ сердца, проведенная как по стандартному, так и по ускоренному модифицированному протоколу, привела к достоверному увеличению фракции выброса ЛЖ и глобальной продольной деформации ЛЖ. Наши данные совпадают с результатами исследования Ю.А. Васюка и соавт., впервые применивших экстракорпоральную УВТ в сочетании с базовой медикаментозной терапией у больных с хронической сердечной недостаточностью (ХСН) ишемического генеза, перенесших инфаркт миокарда. Через 6 мес у 24 таких пациентов (20 мужчин и 4 женщины, средний возраст 63,3±6,1 лет) фракция выброса ЛЖ достоверно возросла с 32,2 до 37,7%. При оценке глобальной продольной деформации миокарда ЛЖ, проведенной по технологии Speckle tracking, в целом по группе был отмечен ее достоверный прирост уже через 3 мес наблюдения; к 6-му месяцу этот прирост достиг 28% [19].
ЗАКЛЮЧЕНИЕ
Таким образом, проведенное исследование показало, что глобальная продольная деформация миокарда ЛЖ служит более эффективным методом оценки систолической функции ЛЖ, чем фракция выброса ЛЖ. У больных ИБС УВТ в сочетании с ОМТ повышала сократимость миокарда ЛЖ, тогда как в группе плацебо на фоне 6-месячной оптимальной медикаментозной терапии систолическая функция ЛЖ достоверно снижалась.



