В Римских критериях IV пересмотра подчеркивается разнообразие патофизиологических механизмов синдрома раздраженного кишечника (СРК) [1, 2]. СРК рассматривают как расстройство взаимодействия «головной мозг – желудочно-кишечный тракт». Определенное значение имеют воспаление минимальной степени активности (low-grade mucosal inflammation) в слизистой оболочке толстой кишки и морфологические особенности компонентов диффузной эндокринной системы (ДЭС) [3].
СРК нередко диагностируют при «синдроме перекреста функциональных нарушений». Последний обозначают в Римских критериях IV пересмотра как синхронное течение нескольких функциональных состояний либо переход одного в другое [1, 2].
Рефрактерность при СРК – это непрерывное течение заболевания более 6 мес, отсутствие эффекта от терапии, рекомендованной стандартами [4]. Установлено, что к рефрактерности при СРК располагают функциональная коморбидность, высокий уровень депрессии и тревоги [3, 5].
Описана роль компонентов диффузной эндокринной системы в развитии как СРК, так и «синдрома перекреста» СРК с функциональной диспепсией и ГЭРБ, в частности изменение синтеза мотилина, мелатонина, грелина, серотонина, ВИП-гормона, субстанции P [5, 6, 7, 8]. Ряд публикаций посвящен исследованию компонента ДЭС – белка сиртуина-1, который оказывает разнообразные метаболические и противовоспалительные эффекты, участвует в регуляции процессов клеточного обновления, циркадных ритмов, канцерогенеза [9, 10, 11]. Вместе с тем исследований сиртуина-1 в кишечнике при СРК не проводилось. Отсутствуют данные о предикторах рефрактерного течения СРК с учетом коморбидной функциональной патологии, психологических особенностей, признаков минимального воспаления в стенке кишки и нарушений функционирования компонентов ДЭС.
Цель исследования – изучить особенности течения рефрактерного варианта СРК с учетом психологических характеристик пациентов, а также морфометрических особенностей компонентов диффузной эндокринной системы.
МАТЕРИАЛ И МЕТОДЫ
В исследование был включен 101 пациент – 32 мужчины и 69 женщин (соотношение мужчин и женщин 1:2,2, средний возраст 25,34±6,76 лет). Критерии включения в исследование: пациенты с различными вариантами СРК и функциональным расстройством желчного пузыря, письменное добровольное информированное согласие и достаточный уровень комплаентности согласно опроснику Мориски–Грина (Morisky DE, Green LW, 1986).
Критерии исключения: опухоли различной локализации, острые и хронические кишечные инфекции и инвазии, воспалительные заболевания и дивертикулярная болезнь кишечника, прием антибиотиков, нестероидных противовоспалительных препаратов (НПВП), антипаразитарных средств в течение 2 мес до начала исследования, возраст старше 55 лет, желчнокаменная болезнь (ЖКБ), холецистэктомия в анамнезе, хронические заболевания в фазе декомпенсации.
Базой исследования стало отделение гастроэнтерологии ГУЗ «Саратовская городская клиническая больница № 5» (клиническая база кафедры терапии, гастроэнтерологии и пульмонологии ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России). Общеморфологическое, иммуногистохимическое и морфометрическое исследования биоптатов проводили на базе отдела патоморфологии ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им Д.О. Отта» (Санкт-Петербург). Авторы выражают благодарность руководителю отдела, з.д.н. РФ д.м.н. профессору И.М. Кветному. Исследование было одобрено этическим комитетом Саратовского государственного медицинского университета им. В.И. Разумовского (протокол от 06.12.2016 № 4).
При верификации СРК учитывали форму кала по Бристольской шкале [12]. СРК с диареей (СРК- Д) был выявлен у 32 пациентов (11 мужчин, 21 женщина), СРК с запором (СРК-З) – у 69 пациентов (21 мужчина, 48 женщин).
Группу контроля составили 35 здоровых добровольцев (14 мужчин и 21 женщина), проходивших профилактическое обследование в рамках скрининга опухолей желудочно-кишечного тракта (ЖКТ).
С учетом варианта течения СРК пациенты были разделены на 2 подгруппы: с рефрактерным (СРКр) и нерефрактерным (СРКн) течением.
Рефрактерную форму заболевания определяли на основании данных анамнеза (непрерывное течение обострения более 6 мес либо более 32 нед в течение года) и отсутствия эффекта от соматотропной терапии при достаточной приверженности к лечению [3, 4].
У части пациентов (43 человека – 42,5%) был обнаружен перекрест СРК с функциональным расстройством желчного пузыря, верифицированным с учетом Римских критериев IV пересмотра и рекомендаций Российской гастроэнтерологической ассоциации [2, 13]. Пациенты с функциональной коморбидностью вошли в каждую из анализируемых групп.
Субъективную выраженность абдоминальной боли оценивали по визуально-аналоговой шкале (ВАШ), градуированной от 0 (отсутствие боли) до 10 (невыносимая боль) баллов [14].
Для оценки дистресса, депрессии, тревоги и соматизации было выполнено психометрическое тестирование с применением русскоязычного варианта четырехмерного опросника – 4ДДТС [15].
Колобиоптаты получали в процессе колоноскопии из слизистой оболочки средней трети сигмовидной кишки (колоноскоп Оlympus-CF-EL и набор инструментов к нему).
Колобиоптаты фиксировали в 10%-ным нейтральном формалине в течение 24 ч. Последующую обработку проводили в изопропиловом спирте по стандартной методике с изготовлением парафиновых блоков. С каждого блока были выполнены срезы толщиной 4 мкм и окрашены гематоксилином и эозином. Общеморфологическое исследование проводилось по общепринятой методике [16].
Иммуногистохимическое (ИГХ) исследование проводили на депарафинизированных и дегидратированных срезах (2–4 мкм). После промывки наносили первичные антитела к мотилину (Anti-motilin (PA5-76926) Th.Fi.Sc. 1:100, сиртуину-1 (Anti-SIRT1 antibody [E104] (ab32441) abcam 1:150). В качестве вторичных антител использовали антитела, коньюгированные с полимером, маркированным пероксидазой (универсальный набор DAKO EnVision TM + System). Визуализацию окрасок проводили с применением комплекса DAB+ и субстратного буфера. Изучение препаратов проводилось на микроскопе Nikon Ѐ400 с использованием камеры Nikon DXM 1200. Для оценки результатов иммуногистохимического окрашивания проводили морфометрическое исследование с использованием системы компьютерного анализа микроскопических изображений Морфология 5.2. В каждом случае анализировали 5 полей зрения при увеличении в 400 раз. Относительную площадь экспрессии рассчитывали как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения. Оптическую плотность экспрессии выявленных продуктов измеряли в условных единицах. Указанные параметры отражают интенсивность синтеза или накопления исследуемых молекул в клетках ДЭС.
Обработка данных проводилась с использованием статистических программ Statistica 6.0 и Gretl, для создания базы данных использовался редактор электронных таблиц Excel. Проверка на нормальность распределения проводилась при помощи тестов Шапиро–Уилка и Лиллифорса.
Для сравнения групп данных с нормальным распределением применялся t-критерий Стъюдента. Для сравнения долей и средних в выборках с нормальным распределением использовался z-критерий Фишера. При распределении данных, отличном от нормального, использовался критерий Манна–Уитни. Для установления наличия и уровня значимости взаимосвязи номинальных признаков проводился анализ таблиц сопряженности с использованием критерия χ2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рефрактерное течение заболевания (СРКр) было диагностировано у 73 (72,3%) пациентов: у 20 человек (19,8%) с СРКр-Д, у 53 (52,5%) – с СРКр-З. Нерефрактерный вариант заболевания (СРКн) имели 28 пациентов (27,7%): 12 человек (11,9%) с СРКн-Д, 16 (15,8%) с СРКн-З.
Признаки функционального билиарного расстройства были обнаружены у 43 (42,6%) пациентов. Полученные результаты согласуются с опубликованными в литературе данными о нарушении функции желчного пузыря у пациентов с СРК. Очевидно, имеется общность патогенеза функциональных расстройств [17]. Функциональная коморбидность чаще встречалась при рефрактерном течении заболевания (СРКр-Д – 13 (65%), СРКр-З – 24 (45,3%) пациента), чем при нерефрактерном (СРКн-Д – 2 (16,7%), СРКн-З – 2 (12,5%) пациента). Взаимосвязи между СРК-Д и СРК-З и функциональными билиарными расстройствами обнаружены не были, что также подтверждает сведения других исследований [17].
Абдоминальная боль (связанная с кишечником) у пациентов локализовалась в подвздошных областях (больше слева) и соответствовала характеристикам боли при СРК: ноющая (41 человек – 40,6%), схваткообразная (23 – 22,8%), жгучая (10 – 9,9%), выкручивающая (7 – 6,9%), неопределенная (20 – 19,8%), связанная с едой (35 – 34,7%), с эмоциональным стрессом (27 – 26,7%) и менструацией у женщин (28 – 40,5%), сопровождающаяся вздутием живота (42 – 41,5%).
При оценке по ВАШ абдоминальная боль при СРКн была неинтенсивной, в среднем 3,28±0,45 баллов, значимых различий по полу и варианту течения заболевания не обнаружили. При СРКр среднее значение этого показателя было выше (5,90±0,41) и оценивалось как умеренный болевой синдром. Интенсивность абдоминальной боли при СРКр-Д (6,85±0,51) была больше, чем при СРКр-З (4,94±0,31) (р <0,01).
Были обнаружены корреляционные связи интенсивности абдоминального болевого синдрома с рефрактерным течением СРК-Д (r=0,6230, р=0,0001) и функциональной коморбидностью (r=0,3151, р=0,0013). Наши данные согласуются с опубликованными в литературе [17].
Результаты психологического тестирования пациентов представлены в таблице 1.
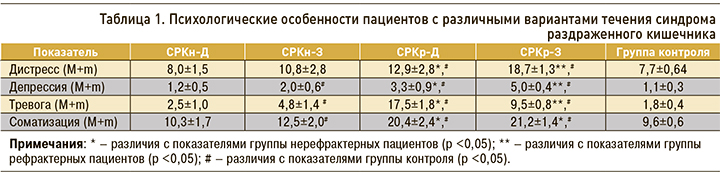
В группе пациентов с СРКн-Д показатели не отличались от группы контроля. При СРКн-З уровень депрессии, тревоги, соматизации был значимо выше, чем у здоровых.
Отмечено повышение исследуемых показателей в группе рефрактерных пациентов (p <0,05). При этом значения дистресса и депрессии были выше при СРКр-З; тревоги – при СРКр-Д; по уровню соматизации группы СРКр-З и СРКр-Д значимо не различались. Согласно полученным данным, при СРК-З признаки психологической дезадаптации были более выражены, чем при СРК-Д, и усиливались при рефрактерном течении синдрома. При СРК-Д психологический дискомфорт появлялся только при рефрактерном течении и проявлялся в повышении уровня тревоги. Возможно, высокий уровень соматизации при СРКр-З и СРКр-Д предопределял развитие внекишечной симптоматики и резистентность к терапии. Известно влияние ЦНС на моторику, тонус толстой кишки и абдоминальную боль [3, 18].
Морфологические особенности слизистой оболочки толстой кишки при различных вариантах течения синдрома раздраженного кишечника представлены в таблице 2.
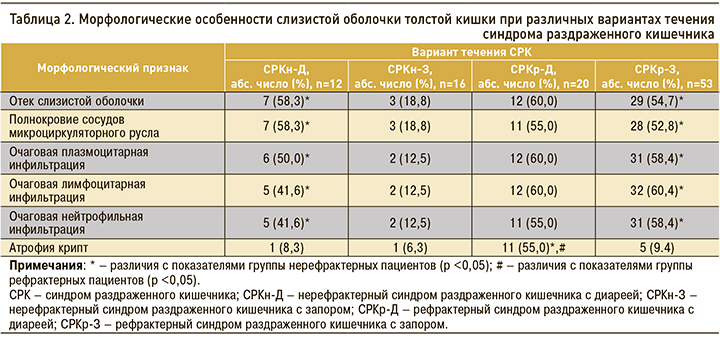
Признаки неспецифического воспаления минимальной активности (отек слизистой оболочки, полнокровие сосудов микроциркуляторного русла, очаговая плазмоцитарная, лимфоцитарная, нейтрофильная инфильтрация) были выявлены в биоптатах у 50,5% пациентов. Признаки атрофии (атрофия крипт) имели 17,8% больных. При СРКн-Д с диареей в колобиоптатах обнаруживались воспалительные изменения минимальной степени активности. При СРКр-Д появлялись признаки очаговой атрофии слизистой оболочки толстой кишки. При СРК с запором признаки воспаления минимальной активности отмечались только при рефрактерном течении, атрофия слизистой оболочки толстой кишки встречалась реже (p <0,05).
Результаты морфометрического исследования компонентов диффузной эндокринной системы толстой кишки при СРК представлены в таблице 3.

Согласно полученным данным, при СРК с запором площадь экспрессии и оптическая плотность клеток, продуцирующих мотилин (Motilin), была снижена в сравнении с группой контроля (p <0,01). При рефрактерном течении заболевания изменения были более значительными. Площадь экспрессии и оптическая плотность клеток, продуцирующих сиртуин-1 (Sirt-1), при СРКн-З и СРКр-З значимо не отличалось от группы контроля (р >0,01).
При СРК с диареей площадь экспрессии и оптическая плотность мотилин-продуцирующих клеток возрастала, тогда как площадь клеток, продуцирующих сиртуин-1, снижалась в сравнении с группой контроля (р <0,01). При рефрактерном течении описанные изменения становились более выраженными (р <0,01).
Полученные данные об изменении оптической плотности и площади экспрессии колоноцитов, иммунопозитивных к мотилину при СРК можно объяснить с учетом физиологической роли этого пептида в регуляции моторики и висцеральной гиперчувствительности.
Нами впервые были получены данные об изменении морфометрических параметров сиртуин-1-позитивных колоноцитов при различных вариантах СРК. Показана их связь с вариантом течения заболевания и рефрактерностью. Уменьшение показателей оптической плотности колоноцитов, иммунопозитивных к сиртуину-1, уменьшало регулирующее противовоспалительное влияние данного пептида и способствовало поддержанию воспаления минимальной степени активности при СРК-Д. Несомненно, данный факт требует уточнения.
Таким образом, у пациентов с рефрактерным вариантом СРК выявлены коморбидность с функциональной патологией желчного пузыря, выраженные психологические особенности (по показателям дистресса, депрессии, тревоги, соматизации), разнонаправленные изменения функциональных характеристик компонентов ДЭС толстой кишки по показателям мотилина и сиртуина-1.
ЗАКЛЮЧЕНИЕ
- При рефрактерном течении СРК функциональное расстройство желчного пузыря встречается чаще, чем при нерефрактерном. Интенсивность абдоминального болевого синдрома выше у пациентов с рефактерным течением СРК-Д и функциональной коморбидностью.
- При рефрактерном течении СРК показатели дистресса, депрессии, тревоги, соматизации значимо повышены. Уровень дистресса и депрессии выше при СРКр-З, тревоги – при СРКр-Д. По уровню соматизации группы СРКр-Д и СРКр-З не различаются.
- Признаки неспецифического воспаления минимальной активности характерны для СРК-Д и рефрактерного течения СРК-З. При рефрактерном течении СРК-Д признаки минимального воспаления сопровождаются очаговой атрофией слизистой оболочки толстой кишки.
- Оптическая плотность и площадь экспрессии колоноцитов, иммунопозитивных к мотилину, при СРК с диареей повышена, при СРК-З снижена. Оптическая плотность и площадь экспрессии колоноцитов, иммунопозитивных к сиртуину-1 при СРК-Д снижена, при СРК-З не отличается от группы контроля. При рефрактерном течении описанные изменения значимо нарастают.


