Целью скрининга ряда заболеваний является выявление пациентов с доклинической или ранней стадией болезни для предотвращения или замедления прогрессирования его течения. Легочная гипертензия (ЛГ) представляет собой серьезное жизнеугрожающее состояние с высоким процентом летального исхода [1, 2]. Скрининговые программы для ранней диагностики ЛГ рекомендованы всем пациентам с системными заболеваниями (склеродермия, системная красная волчанка), при наличии ближайших родственников с подтвержденной идиопатической легочной артериальной гипертензией, перенесенной тромбоэмболией легочной артерии (ТЭЛА) в анамнезе и некоторыми другими патологиями. Ряд исследований продемонстрировал, что ранняя диагностика ЛГ, а соответственно и рано начатое лечение обеспечивали более высокие показатели выживаемости и отдаленного прогноза [1].
Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) – это прекапиллярная форма ЛГ, при которой хроническая обструкция крупных и средних ветвей легочных артерий, а также вторичные изменения микроциркуляторного русла легких приводят к прогрессирующему повышению легочного сосудистого сопротивления и давления в легочной артерии с развитием тяжелой дисфункции правых отделов сердца и сердечной недостаточности [2]. Диагноз ХТЭЛГ может быть установлен как минимум после 3 мес адекватной антикоагулянтной терапии с момента эпизода острой ТЭЛА при наличии следующих критериев:
- среднего давления в легочной артерии (ДЛА) ≥25 мм рт.ст. и давления заклинивания в легочной артерии (ДЗЛА) ≤15 мм рт.ст.;
- несогласованных дефектов перфузии при сцинтиграфии легких и специфических диагностических признаках ХТЭЛГ, выявляемых по данным мультиспиральной компьютерной томографии (МСКТ) – ангиографии [3].
ОСОБЕННОСТИ ДИАГНОСТИКИ ХТЭЛГ
Ранняя диагностика ХТЭЛГ может иметь решающее значение для проведения эффективной терапии и во многом определять дальнейший исход заболевания. В Европейском регистре ХТЭЛГ было показано, что средняя продолжительность постановки диагноза с момента появления первых симптомов составляла около 14 мес, при этом 81% пациентов к этому времени имели III–IV функциональный класс (ФК) по NYHА [4]. Согласно имеющимся в настоящее время рекомендациям, нет четких сроков для дальнейшего наблюдения больных после эпизода перенесенной ТЭЛА. Кроме того, к группе риска по формированию ХТЭЛГ отнесены лишь те пациенты, у которых систолическое давление в легочной артерии (СДЛА) на момент острой ТЭЛА было высоким либо в дальнейшем сохранялись клинические симптомы [2, 3].
В одном из метаанализов было показано, что частота развития ХТЭЛГ после перенесенной острой ТЭЛА составляет от 0,57 до 1,3%. Эти статистические данные основывались на двух больших когортных исследованиях пациентов с анамнезом венозной тромбоэмболии и практически не имели критериев исключения. Авторами также было показано, что только 3% пациентов, выживших после эпизода острой ТЭЛА, попали в поле зрения врачей через 3–6 мес с момента этого эпизода [5, 6, 7, 8].
Основой патобиологических процессов при ХТЭЛГ выступает формирование тромботических масс, не подвергшихся лизису, которые позднее фиброзируются, что приводит к механической обструкции крупных и средних ветвей легочных артерий. Начальное повышение давления в легочной артерии вызывает развитие вторичных сосудистых изменений. Ремоделирование микроциркуляторного русла легких способствует прогрессированию ЛГ даже при отсутствии повторных тромбоэмболических событий. Финалом заболевания, как и при других формах ЛГ, становится тяжелая дисфункция правого желудочка (ПЖ) и сердечная недостаточность. Морфологическим субстратом ХТЭЛГ также служат генерализованный спазм артериол малого круга кровообращения вследствие высвобождения из тромбоцитов и эндотелия вазоконстриктивных субстанций, вторичное тромбообразование, прогрессивное ремоделирование мелких легочных артерий и артериол [2].
Можно выделить определенный алгоритм диагностики ХТЭЛГ, представленный ниже (рис.) [3]. Рассмотрим данный алгоритм более подробно.
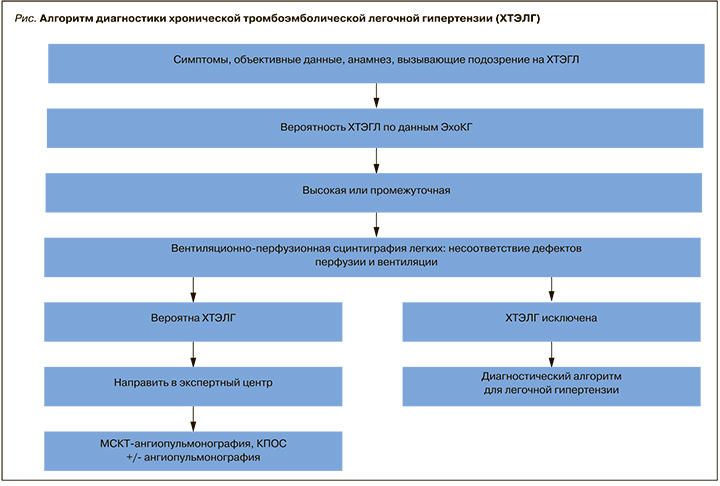
1. Клиническая картина
Сбор анамнеза и жалоб, объективный осмотр пациента – первый этап на пути диагностики ХТЭЛГ. Оценка клинических проявлений заболевания важна как для построения дальнейшего алгоритма обследования, так и определения эффективности проводимой терапии (уменьшение симптомов заболевания, повышение толерантности к физической нагрузке). Наиболее частым проявлением ХТЭЛГ является одышка инспираторного характера. Однако зарубежными авторами показано, что у 36–56% пациентов после перенесенной ТЭЛА может сохраняться этот клинический симптом, и только у небольшой части из них развивается ЛГ [9, 10]. Степень выраженности одышки может варьироваться от минимальной, возникающей при интенсивной нагрузке, до имеющей место в покое и при незначительных усилиях. По данным Российского регистра пациентов с ЛГ, она отмечается у 98% больных на момент установления диагноза ХТЭЛГ [2]. Как правило, с течением болезни одышка прогрессивно нарастает, приступов удушья обычно не наблюдается.
Боли за грудиной отмечаются у 28% пациентов и имеют неопределенный характер: давящие, ноющие, колющие, сжимающие, без четкого начала, продолжительностью от нескольких минут до суток. У ряда пациентов возникают ангинозные приступы, что может маскировать ишемическую болезнь сердца и даже острый инфаркт миокарда.
У 10% больных ХТЭЛГ отмечаются эпизоды головокружений и синкопальных состояний, которые провоцируются физической нагрузкой. Кашель встречается в 38% случаев и, как правило, связан с застойными явлениями или с присоединением воспалительных изменений в легких. Эпизоды кровохарканья могут наблюдаться у 18% больных [2].
Учитывая имеющиеся у пациента клинические проявления, необходимо дифференцировать ХТЭЛГ от хронической тромбоэмболической болезни (ХТЭБ). ХТЭБ представляет собой персистирующую обструкцию легочных артерий без формирования ЛГ. Существуют предположения, что эта форма заболевания может быть «промежуточным звеном» между эпизодом ТЭЛА и формированием истинной ХТЭЛГ (развитие ЛГ возникает только на фоне нагрузки и нормализуется в покое), однако в настоящее время данная проблема остается еще малоизученной. Кроме того, не редко проблемой становится дифференциальная диагностика ХТЭЛГ от повторной острой ТЭЛА [3, 11, 12, 13]. В острый период ТЭЛА можно заподозрить, что больной уже имел ХТЭЛГ, если регистрируются высокие цифры СДЛА (обычно выше 80 мм рт.ст.), так как «нетренированный» ПЖ не способен развивать давление более 70 мм рт.ст. [6].
Согласно имеющимся в настоящее время рекомендациям, пациенты с анамнезом венозной тромбоэмболии (как минимум 3 мес проведения адекватной антикоагулянтной терапии) и проявлениями ПЖ сердечной недостаточности должны быть направлены на скрининг для выявления ХТЭЛГ [2, 3].
 2. Эхокардиография и электрокардиография
2. Эхокардиография и электрокардиография
Основным этапом скрининга ХТЭГЛ служит проведение трансторакальной эхокардиография (ЭхоКГ), которая является простым, неинвазивным диагностическим методом для оценки структурных и функциональных изменений сердца при наличии ЛГ. Расчет СДЛА основывается на определении пиковой скорости трикуспидальной регургитации (СТР) и использовании упрощенного уравнения Бернулли, а также оценке давления в правом предсердии (ПП). Давление в ПП может быть рассчитано путем измерения диаметра нижней полой вены (НПВ) и его изменения в зависимости от фаз дыхания: диаметр НПВ <2,1 см и спадение на вдохе >50% свидетельствует о нормальном давлении в ПП, тогда как диаметр НПВ >2,1 см и спадение на вдохе <50% или <20% при нормальном дыхании говорит о высоком давлении в ПП. Однако, учитывая неточности оценки давления в ПП и увеличение погрешностей измерения с помощью производных переменных, рекомендуется применять постоянно-волновое допплеровское картирование для измерения пиковой СТР, а не расчетное СДЛА. Предложена градация вероятности ЛГ на основании СТР в покое и при наличии дополнительных, ранее определенных ЭхоКГ-параметров, предполагающих наличие ЛГ (табл. 1). Для облегчения и стандартизации выбора уровня вероятности ЛГ используются дополнительные ЭхоКГ-признаки, в дополнение к критериям, основанным на СТР. В таких случаях рекомендуется использование дополнительных критериев, как минимум двух из разных столбцов (табл. 2) [3].
 В 6 когортных исследованиях, включивших максимально до 1045 пациентов, было показано, что на одного пациента с подтвержденным диагнозом ХТЭЛГ, приходилось 3 пациента с признаками ЛГ по данным ЭхоКГ, у которых диагноз не подтвердился (табл. 3) [5, 11, 14, 15, 16, 17, 18].
В 6 когортных исследованиях, включивших максимально до 1045 пациентов, было показано, что на одного пациента с подтвержденным диагнозом ХТЭЛГ, приходилось 3 пациента с признаками ЛГ по данным ЭхоКГ, у которых диагноз не подтвердился (табл. 3) [5, 11, 14, 15, 16, 17, 18].
Электрокардиография (ЭКГ) – простой, доступный и дешевый метод инструментальной диагностики, который обладает небольшой чувствительностью и специфичностью, однако должен быть проведен всем пациентам после перенесенной ТЭЛА для выявления косвенных признаков ЛГ и перегрузки правых отделов сердца. По данным ЭКГ могут быть выявлены признаки гипертрофии и перегрузки ПЖ, дилатации и гипертрофии правого предсердия (p-pulmonale), отклонение электрической оси сердца вправо [2, 3, 18].
3. Вентиляционно-перфузионная сцинтиграфия
При выявлении признаков ЛГ по данным ЭхоКГ и ЭКГ следующим исследованием выбора является вентиляционно-перфузионная сцинтиграфия легких, которая обладает 96–100% чувствительностью и 86–95% специфичностью для выявления признаков ХТЭЛГ и не обладает нефротоксичностью [2, 3, 19, 20, 21]. Множественные дефекты перфузии с сохраненной вентиляционной функцией – характерные признаки ХТЭЛГ.
Изображения, получаемые при острой ТЭЛА и ХТЭЛГ, существенно различаются. Дефекты перфузии при острой ТЭЛА более четко очерчены и резко контрастируют с нормально функционирующей тканью. При ХТЭЛГ дефекты перфузии очерчены не четко и часто не соответствуют зоне кровоснабжения крупной легочной артерии. Кроме того, при ХТЭЛГ нередко можно наблюдать контрастирование центральной части сегмента вдоль пораженной артерии и отсутствие контрастирования периферии. Это может быть вызвано низким давлением крови дистальнее места стенозирования, а не собственно поражением периферических артерий и артериол [2]. В ряде работ показано, что только у 10–30% пациентов после перенесенной ТЭЛА на фоне адекватного приема антикоагулянтов выявляются характерные изменения по данным сцинтиграфии легких.
 Учитывая стоимость и радиационную нагрузку, вентиляционно-перфузионная сцинтиграфия не может быть рекомендована в качестве первой линии в скрининге ХТЭЛГ [8, 22, 23].
Учитывая стоимость и радиационную нагрузку, вентиляционно-перфузионная сцинтиграфия не может быть рекомендована в качестве первой линии в скрининге ХТЭЛГ [8, 22, 23].
4. Мультиспиральная компьютерная томография (МСКТ)
В рутинной клинической практике частой альтернативой сцинтиграфии легких выступает проведение МСКТ-ангиопульмонографии, в особенности в стационарах, где технически невозможно ее выполнение. МСКТ-ангиопульмонография – более доступный и дешевый метод диагностики ХТЭЛГ, позволяющий оценить структуру легочного русла, наличие организованных тромбов и их локализацию. КТ-картина хронической тромбоэмболии может быть представлена окклюзиями и стенозами легочных артерий, эксцентрическими дефектами наполнения вследствие наличия тромбов, в том числе реканализованных [2, 3].
Чувствительность метода, по данным различных авторов, составляет от 51 до 92% [19, 20]. Стоит отметить, что используемые в настоящее время томографы обладают высокой чувствительностью (более 90%) [24]. В исследовании J. He еt al. было показано, что при обследовании 114 пациентов с предполагаемой ХТЭЛГ чувствительность и специфичность перфузионно-вентиляционной сцинтиграфии легких (100 и 93,7%) были сопоставимы с результатами КТ-ангиопульмонографии (92,2 и 95,2%) [19].
 5. Катетеризация правых отделов сердца
5. Катетеризация правых отделов сердца
«Золотым стандартом» диагностики ХТЭЛГ считается выполнение малоинвазивного вмешательства – катетеризации правых отделов сердца (КПОС), которая должна проводиться в рамках экспертного центра по ЛГ. Гемодинамическими критериями ХТЭЛГ как прекапиллярной формы ЛГ, выявляемыми при КПОС, служат среднее ДЛА ≥25 мм рт.ст., ДЗЛА ≤15 мм рт.ст., легочное сосудистое сопротивление >2 ЕД. по Вуду (160 дин. с см-5) при наличии множественных стенозирующих и/или окклюзирующих поражений ветвей легочной артерии различного калибра [2, 3].
КПОС является инвазивной процедурой, информативность и безопасность которой основывается на четырех принципах: рациональном выборе венозного доступа, тщательной калибровке датчика давления, соблюдении правил измерения ДЗЛА и расчете сердечного выброса [2, 3].
6. Оценка лабораторных показателей
Больным ХТЭЛГ необходимо проводить рутинные лабораторные тесты: биохимический (оценка функции почек, печени, содержания белка) и общий (уровень гемоглобина, эритроцитов, гематокрита, лейкоцитов, тромбоцитов) анализы крови, оценку данных коагулограммы и D-димера, исследование гормональной функции щитовидной железы [2]. До настоящего времени не разработаны четкие рекомендации по исследованию системы гемостаза и фибринолиза у больных ХТЭЛГ. Различные аномалии этой системы достаточно широко распространены в популяции, поэтому связать развитие заболевания с изменениями того или иного показателя часто затруднительно. Следует обращать внимание на отклонения от нормы нескольких показателей одновременно. Из всего спектра тромбофилических состояний особое внимание уделяется диагностике присутствия антифосфолипидных антител, повышенного содержания VIII фактора свертывания, дефицита протеинов С и S, антитромбина III, патологические изменения фибриногена и плазминогена, гомоцистеина. Диагностика ряда показателей возможна только после отмены фоновой антикоагулянтной терапии, что подвергает пациента дополнительному риску [2, 3].
Изучается и описано большое количество лабораторных показателей, которые могут служить потенциальными биомаркерами ХТЭЛГ [2, 3, 25]. Однако в настоящее время не существует «эталонного» показателя, который мог бы отражать и оценивать процессы ремоделирования сосудистого русла. Предшественник мозгового натрийуретического пептида (NT-proBNP) – единственный биомаркер, рекомендуемый для оценки степени ПЖ сердечной недостаточности и эффективности проводимой терапии у пациентов с подтвержденной ЛГ [3]. В ряде работ было показано, что результаты неинвазивного теста по определению этого пептида точно отражают тяжесть дисфункции ПЖ. Повышенные уровни мозгового натрийуретического пептида и его предшественника ассоциируются с увеличением смертности пациентов с прекапиллярной ЛГ, а снижение его уровня в процессе лечения – с более высокой выживаемостью [26]. В исследовании S. Surie et al. было показано, что уровень мозгового натрийуретического пептида >48,5 пмоль/л в дальнейшем определял неблагоприятный исход оперативного лечения (легочной тромбэндартерэктомии) и высокую степень вероятности сохранения резидуальной ЛГ [27].
В ряде работ подтверждена клиническая значимость комплексной оценки данных ЭКГ и биомаркеров в диагностике ЛГ. Так, в нескольких исследованиях было показано, что при отсутствии признаков перегрузки правых отделов сердца на ЭКГ и повышения уровня NT-proBNP диагноз предполагаемой прекапиллярной ЛГ в дальнейшем исключался [28, 29]. В литературе опубликовано несколько примеров оценки данных показателей для подтверждения или исключения, в том числе и ХТЭЛГ. В исследовании F.A. Klok et al. было продемонстрировано, что в 77% случаев у пациентов с подтвержденной ХТЭЛГ, в отличие от пациентов без ЛГ, отмечался высокий уровень NT-proBNP в сочетании с тремя паттернами на ЭКГ: отклонение ЭОС вправо; блокада правой ножки пучка Гиса; R:S > 1 в отведении V1 с амплитудой зубца R > 0,5 mV.
В одном из последних метаанализов было изучено 772 пациента, перенесших ТЭЛА (без сопутствующей кардиопульмональной патологии), с целью создания прогностической шкалы развития ХТЭЛГ [30]. Важными для оценки факторами были необъяснимая ТЭЛА, гипотиреоз, сохранение клинических симптомов ТЭЛА более 2 нед, дисфункция ПЖ, подтвержденная данными КТ или ЭхоКГ, установленный диагноз сахарного диабета, тромболизис или тромбэктомия в период острой ТЭЛА (табл. 4). При суммарном балле ≤6 риск развития ХТЭЛГ считается низким (73% пациентов, в 0,38% случаев диагностирована ХТЭЛГ), при показателе >6 – высоким (27% пациентов, в 10% случаев диагностирована ХТЭЛГ). Группой авторов сделано предположение, что эта прогностическая шкала в сочетании с высоким уровнем NT-proBNP и описанными выше ЭКГ-паттернами может служить новым, простым и дешевым алгоритмом для возможной оценки развития у пациента ХТЭЛГ после перенесенной ТЭЛА. В настоящее время данное предположение изучается в международном мультицентровом проспективном исследовании (NCT02555137) [30].
Подводя итог всем вышеописанным методам, используемым в диагностике ХТЭЛГ, следует подчеркнуть, что проведение рутинного скрининга ХТЭЛГ после эпизода ТЭЛА в настоящее время не является целесообразным [3].
Несмотря на то что ХТЭЛГ относится к тяжелым и жизнеугрожающим состояниям, нет четкого ответа на вопрос: «Когда и кого надо обследовать для выявления данного осложнения?». Остаются не до конца изучены вопросы возможности выбора лишь одного метода для подтверждения диагноза ХТЭЛГ и рентабельность предлагаемых новых алгоритмов диагностики. Согласно имеющимся в настоящее время клиническим рекомендациям, настороженность врача-клинициста для скрининга ХТЭЛГ должна быть в отношении пациентов, которые после перенесенного эпизода ТЭЛА и постоянного приема антикоагулянтов в адекватных дозах в течение 3 мес предъявляют жалобы на одышку и снижение толерантности к физической нагрузке [19]. Скрининг пациентов для выявления ХТЭЛГ должен включать ЭхоКГ, ЭКГ, вентиляционно-перфузионную сцинтиграфию, ангиографию легочной артерии, определение лабораторных показателей (в том числе специфических биомаркеров); в дальнейшем необходимо проведение КПОС в специализированном экспертном центре [2, 3].
Совокупность рассмотренных выше методов обследования (начиная от самых простых и доступных, до высокотехнологических, требующих определенного оборудования и специально обученного персонала) позволяет подтвердить диагноз ХТЭЛГ и принять решение о дальнейшей тактике ведения больного.



