ВВЕДЕНИЕ
Венозные тромбоэмболические осложнения (ВТЭО) представляют собой значимую междисциплинарную проблему. При этом до 20% венозных тромбоэмболических событий приходится на канцер-ассоциированные тромбозы [1], которые являются второй по частоте причиной смерти пациентов со злокачественным новообразованием (ЗНО) [2]. Венозная тромбоэмболия в 4–7 раз чаще встречается у пациентов с активным раком по сравнению с общей популяцией [3].
В научной литературе механизм тромбообразования при ЗНО описывается в рамках Вирховской триады: стаз крови, повреждение сосудов и гиперкоагуляция. Стаз крови обусловлен длительной иммобилизацией пациентов, сдавлением опухолью, повреждение сосудов связано с прорастанием опухоли в сосуды, установкой периферических катетеров и прямым повреждающим действием цитостатиков, а гиперкоагуляция становится следствием действия опухоль-активированных прокоагулянтов, развития эндотелиальной дисфункции и повышения адгезии опухолевых клеток, приводящих к активации лейкоцитов и тромбоцитов [4].
Злокачественная опухоль расценивается как независимый фактор высокого риска развития ВТЭО [5], наиболее опасным из которых считается тромбоэмболия легочной артерии (ТЭЛА). В то же время ВТЭО выступают прогностическим фактором, определяющим дальнейшую выживаемость пациентов с ЗНО.
Существуют руководства для клиницистов по ведению пациентов с раковой венозной тромбоэмболией [6]. Однако единого мнения относительно первичной профилактики канцер-ассоциированных тромбозов до сих пор нет.
С целью определения вероятности ВТЭО на современном этапе используются различные методики [7–8], чувствительность и специфичность которых невысоки. Это затрудняет определение времени начала превентивных мероприятий. В связи с этим в рамках данной работы предлагается определить маркеры вероятности ВТЭО у онкологических пациентов.
Цель исследования – изучение факторов высокого риска развития ВТЭО среди пациентов со ЗНО с использованием современных биомаркеров.
Для достижения поставленной цели были сформированы следующие задачи.
1. Оценить влияние клинико-анамнестических и лабораторно-инструментальных показателей на развитие ВТЭО у пациентов со ЗНО и провести оценку «вклада» каждого из основных факторов риска в общую картину ВТЭО у онкологических пациентов.
2. Оценить эффективность биомаркера клеточной адгезии в ранней диагностике ВТЭО.
3. Оптимизировать алгоритм диагностики риска ВТЭО при ЗНО с применением современных биомаркеров.
МАТЕРИАЛ И МЕТОДЫ
Исследовательская работа выполнена на базах БУ «Республиканский кардиологический диспансер» Минздрава Чувашии и АУ «Республиканский клинический онкологический диспансер» Минздрава Чувашии. Для достижения поставленной цели и решения задач было проведено открытое проспективное исследование с включением 211 пациентов со ЗНО.
Критериями включения в исследование были возраст от 18 до 75 лет, наличие верифицированного онкологического диагноза, подписанное информированное согласие.
Критерии невключения: заболевания крови (лейкозы, лимфомы), беременность и лактация, возраст менее 18 лет, декомпенсированная артериальная гипертензия, сахарный диабет 2-го типа, васкулиты, ревматические заболевания и иные заболевания, требующие приема глюкокортикостероидов, иммуносупрессивной терапии, тяжелая коморбидная патология, требующая комплексного медикаментозного лечения, острое тромботическое событие в течение 3 мес ранее (острый инфаркт миокарда, острое нарушение мозгового кровообращения, ТЭЛА, тромбоз глубоких вен, артериальные тромбозы других локализаций), применение антикоагулянтной терапии в течение 3 мес до исследования, прием антиагретантов (кроме ацетилсалициловой кислоты, так как ее получают пациенты с сердечно-сосудистыми заболеваниями и высоким риском осложнений), исходная патология системы гемостаза, диагностированный геморрагический синдром.
У всех участников исследования осуществлялся сбор жалоб, анамнеза жизни и заболевания, проводились обследования, включавшие общеклинические стандартные лабораторные исследования (общие анализы крови и мочи, биохимический анализ крови), электрокардиографию (ЭКГ), эхокардиографию сердца (ЭхоКГ), мультиспиральную компьютерную томографию с ангиографией (МСКТ-АГ), ультразвуковую допплерографию (УЗДГ) вен. В качестве потенциальных лабораторных маркеров венозного тромбообразования дополнительно определялись D-димер и Р-селектин.
Опытную группу (О) исследования составили 122 пациента с ТЭЛА на фоне ЗНО, группу контроля (N) – 89 пациентов с ЗНО без ТЭЛА. Группа контроля была выделена в том числе и для оценки порогового значения Р-селектина как предиктора высокого риска ВТЭО. Дизайн исследования представлен на рисунке 1.
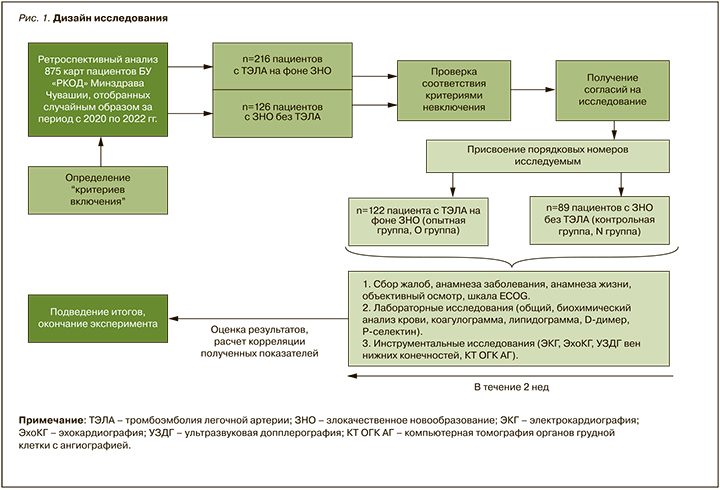
Сравнение групп осуществлялось путем анализа ряда параметров клинического и лабораторно-инструментального характера, которые позволяли провести сравнительный анализ факторов риска ВТЭО.
Для проведения всестороннего статистического анализа полученных результатов была создана электронная база данных с использованием программы Microsoft Excel 2010 (Microsoft, США), статистическая обработка результатов исследования и графический анализ данных выполнялись при помощи сервиса StatTech 2.8.2.
Количественные переменные описывались следующими статистическими методами: числом пациентов, средним арифметическим значением, стандартным отклонением от среднего арифметического значения, медианой, минимальным и максимальным значением. Извлеченные количественные признаки с нормальным распределением представлены в виде формулы M±m, где M – среднее значение признака, m – стандартная ошибка среднего. При выявлении ненормального распределения оценивалась медиана (Me). Качественные переменные описывались абсолютными и относительными частотами (процентами).
Количественные показатели оценивались на предмет соответствия нормальному распределению с применением критерия Колмогорова–Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывались через медиану (Me) и нижний и верхний квартили (Q1–Q3). При нормальном виде распределения данных использовались методы параметрической статистики (критерий Стьюдента). Для сравнения групп при распределениях, отличавшихся от нормального, применялись методы непараметрической статистики (ранговый критерий Манна–Уитни).
Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось посредством критерия хи-квадрат Пирсона (при значениях ожидаемого явления более 10). Частотные характеристики качественных показателей сопоставлялись с помощью точного (двустороннего) критерия Фишера.
Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разрабатывалась с использованием метода линейной регрессии. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
РЕЗУЛЬТАТЫ
Анализ клинической картины исследуемых пациентов проводился путем сравнительной оценки двух групп пациентов – опытной (О – больные с ТЭЛА на фоне подтвержденного онкологического диагноза) и контрольной (N – больные со ЗНО без тромбоза). Подтверждение диагноза ТЭЛА проводилось с помощью МСКТ-АГ.
Средний возраст больных в группах статистически значимо не различался: в основной группе он составил 65,2±11,9 лет, Me 66 (26; 75), в контрольной – 63,1±13,8 лет, Me 64 (23; 75); p=0,59 (критерий Манна–Уитни). Мужчин в исследовании было больше, чем женщин: 128 (60,6%) против 83 (39,4%). Мужчины и женщины статистически не различались по возрасту (p=0,34).
В результате анализа было установлено, что у мужчин ТЭЛА встречалась в 1,41 раза чаще, чем у женщин (отношение шансов (ОШ) 0,709; 95% доверительный интервал (ДИ): 0,370–1,358).
Также было выявлено, что при достижении порогового возраста старше 57 лет вероятность ТЭЛА возрастает (специфичность модели 92,2%). По-видимому, это объясняется общепопуляционной особенностью увеличения риска тромбоэмболических событий с возрастом.
У пациентов с эпизодом тромбоза в анамнезе риск повторного тромбоэмболического события повышался в 4,7 раза (ОШ 0,021; 95% ДИ: 0,003– 0,161), что согласуется с литературными данными.
По результатам сравнительного и корреляционного анализов статистически значимой ассоциации сопутствующей патологии установлено, что вероятность ТЭЛА у пациентов со ЗНО увеличивается 5,7 раз при фибрилляции предсердий и в 4,4 раза при значимой желудочковой экстрасистолии.
Факторы ВТЭО, ассоциированные с онкологическим процессом
Наиболее статистически значимыми локализациями опухолевого процесса, ассоциированными с ВТЭО, являлись колоректальный рак (n=21), рак печени (n=16), поджелудочной железы (n=12), яичников (n=8), желудка (n=8), сочетанные раки (n=11). Различия показателей были статистически значимы (p <0,0001), что согласуется с результатами исследования Chew H.K. et al. [9].
Большое значение в контексте ВТЭО имеют также стадия рака и наличие метастатического процесса. У пациентов с гистологически установленными регионарными и отдаленными метастазами риск ВТЭО оказался в 5 раз выше (p <0,001; используемый метод – Хи-квадрат Пирсона). Это в 2 раза выше, чем в исследовании Blom J.W. et al. [10].
В нашем исследовании были выявлены различия и по размеру опухоли: так, при значении Т >2 (согласно классификации TNM) вероятность ВТЭО увеличивалась (p <0,001; используемый метод – Хи-квадрат Пирсона). Площадь под ROC-кривой составила 0,748±0,049 (95% ДИ: 0,652–0,844).
Вероятность ВТЭО возрастала и при определенных методах терапии, таких как химиотерапевтическое, хирургическое лечение, и еще больше при комбинированном лечении (p <0,001; используемый метод – Хи-квадрат Пирсона).
Статистически значимые различия в плане риска развития ВТЭО были получены при анализе длительности онкологического анамнеза: так, наиболее значимым оказался период до 3 мес от постановки диагноза (p <0,001; используемый метод – Хи-квадрат Пирсона).
Факторы риска ВТЭО, связанные с результатами лабораторных исследований
При оценке результатов лабораторных исследований выявлено значимое снижение уровня гемоглобина в группе ТЭЛА (p <0,001; используемый метод – U-критерий Манна–Уитни). При значении гемоглобина ниже 115 г/л вероятность ВТЭО повышалась (чувствительность и специфичность модели 83,8 и 59,7% соответственно).
В ходе исследования была проведена оценка доступных показателей воспаления. Обнаружено, что при уровне фибриногена выше 2,6 г/л и С-реактивного белка (СРБ) выше 16,9 г/л вероятность ВТЭО пропорционально увеличивалась (p <0,001; используемый метод – Хи-квадрат Пирсона).
Также нами была дополнительно выполнена оценка значимости уровня Р-селектина в ранней диагностике ВТЭО у пациентов со ЗНО. Известно, что селектины – это большая группа гликопротеинов, способствующих взаимодействию лейкоцитов и эндотелиальных клеток. Это временное связывание приводит к дальнейшей активации лейкоцитов и последующей адгезии фибробластов и трансэндотелиальной миграции лейкоцитов [11].
P-селектин, который экспрессируется на поверхности активированных тромбоцитов (α-гранулы) и эндотелиальных клеток (тела Weibel–Palade), быстро мобилизуется в ответ на действие различных воспалительных агентов, таких как тромбин, факторы комплемента, гистамина, свободные радикалы и цитокины, тем самым опосредуя их взаимодействие с лейкоцитами [12]. Высвобождение P-селектина на поверхности клеток обычно исчисляется в минутах, что делает его идеальным кандидатом для опосредования ранних лейкоцитарно-эндотелиальных взаимодействий [13]. В целом активация Р-селектина, рассматриваемая как индикатор активации тромбоцитов, может индуцировать быструю клеточную транслокацию поверхности, приводящую к агрегации тромбоцитов и индукции прокоагулянтного состояния, а затем способствовать образованию микрососудистых тромбов [14].
В результате проведенного нами анализа установлено, что при уровне Р-селектина свыше 375 нг/мл вероятность ВТЭО увеличивалась (чувствительность 95,3%, специфичность 58,9%).
О схожих результатах упоминалось в исследовании Riva N. et al. в 2018 г. [15], где была продемонстрирована высокая чувствительность и специфичность (72,7 и 78,2% соответственно) определения Р-селектина для раннего прогноза ТЭЛА, и в работе Ramacciotti E. et al. в 2011 г. [16], результаты которой доказали высокую специфичность (96%) Р-селектина при тромбозе глубоких вен нижних конечностей.
«Золотым стандартом» исключения венозного тромбоза считается уровень D-димера менее 0,5 мкг/мл, однако «нормальный» уровень D-димера зависит от возраста, беременности и лактации, наличия сопутствующей патологии и других состояний [17]. В нашем исследовании при значении D-димера выше 2,0 мкг/мл вероятность ВТЭО повышалась (чувствительность и специфичность модели 81,4 и 95,9% соответственно).
Также мы сопоставили уровни Р-селектина и D-димера по тромботическим событиям у пациентов с ЗНО. В результате была выявлена значимая корреляционная связь (табл., рис. 2).

ОБСУЖДЕНИЕ
Информативная визуализация ВТЭО (УЗДГ, компьютерная томография) не всегда доступна, поэтому крайне актуальным представляется определение лабораторных биомаркеров вероятности развития ВТЭО. Постановка диагноза методами лабораторной диагностики очень желательна, поэтому исследовательские силы направлены на изучение роли плазменных биомаркеров [18].
Наиболее оптимистичные международные данные имеются по Р-селектину, так как считается, что он играет значительную роль в метастазировании, усиливая адгезию раковых клеток к эндотелию и активированным тромбоцитам в отдаленных органах, сверхэкспрессируется при многих типах рака [19]. Myers D. et al. (2002, 2003) обнаружили достоверно более низкую вероятность тромбообразования у генетически модифицированных животных, у которых отсутствовали P- и E-селектины, по сравнению с контрольными животными дикого типа, и показали, что высокие концентрации циркулирующего Р-селектина вызывают формирование более крупных тромбов [20–21].
В исследовании Bielinski S.J. et al. было отмечено, что многие факторы сердечно-сосудистых заболеваний присутствуют у пациентов в сочетании с высоким уровнем Р-селектина, что увеличивает риск развития ишемической болезни сердца (ИБС) и других заболеваний [22]. Доказана высокая корреляционная связь между уровнем Р-селектина и риском развития инфаркта миокарда [23]. Высокие концентрации P-селектина наблюдались при ИБС, атеросклерозе и остром ишемическом инсульте. Исследователи объяснили эту связь участием Р-селектина в процессах эндотелиальной дисфункции. В российских исследованиях Р-селектин исследовали как предиктор рестеноза у пациентов с ИБС после коронарного стентирования [24], однако отношение Р-селектина к венозным тромбозам упоминается лишь в небольшом количестве работ. Развитие венозного тромбообразования также связывают с факторами неспецифического воспаления и эндотелиальной дисфункции [25].
Исследования, выполненные на пациентах с венозной тромбоэмболией, продемонстрировали увеличение концентрации P-селектина сразу после острого события тромбоза [26] и через несколько месяцев после ВТЭО [27].
Особый интерес представляет изучение роли Р-селектина в патогенезе метастазирования ЗНО. Доказано, что раковые клетки способны усиливать экспрессию Р-селектина на моноцитах, макрофагах, эндотелиальных клетках и тромбоцитах. С другой стороны, раковые клетки сами экспрессируют CD24 на поверхности, которые активно соединяются с рецепторами P-селектина. Соединение Р-селектина и CD24 на раковых клетках помогает их взаимодействию с тромбоцитами и способствует метастатическому распространению опухоли [28].
При сравнении информативности Р-селектина и D-димера в исследовании van Es N. еt al. (117 пациентов с венозным тромбозом в анамнезе на фоне ЗНО) риск ВТЭО оказался в 4 раза выше у больных с повышенным уровнем P-селектина, чем у пациентов с повышенной концентрацией D-димера в сыворотке крови. В связи с этим обнаружение повышенного содержания Р-селектина в плазме крови больных ЗНО может служить как маркером свершившегося рак-ассоциированного тромбоза, так и предиктором его скорого развития или же рецидива венозной тромбоэмболии [29].
Выполненный нами анализ литературы выявил актуальность продолжения исследования роли Р-селектина как раннего лабораторного маркера ВТЭО у пациентов со ЗНО, особенно в амбулаторном этапе. Дальнейшие исследования в этом направлении могут помочь в создании новых рекомендаций по коррекции и оценке эффективности антикоагулянтной терапии у онкологических больных.
ЗАКЛЮЧЕНИЕ
Исходя из результатов нашего исследования, можно выделить значимые клинические и лабораторные критерии высокого риска ВТЭО у пациентов со ЗНО: это возраст старше 57 лет, наличие в анамнезе тромбоэмболических событий, сопутствующие нарушения ритма сердца, локализация онкологического процесса (колоректальный рак, рак поджелудочной железы, сочетанные раки), размер опухолевого процесса, наличие регионарных и отдаленных метастазов, ранний дебют заболевания (первые 3 мес от постановки диагноза ЗНО), уровни фибриногена >2,6 г/л, СРБ >16,9 мг/л, гемоглобина <110 г/л, D-димера >2,0 мкг/мл, Р-селектина >375 нг/мл.
Для оценки индивидуального риска канцер-ассоциированных тромбозов и решения вопроса о целесообразности и длительности антикоагулянтной терапии в перспективе планируется разработка неинвазивной математической модели с учетом значимости прокоагулянтных маркеров.



