ВВЕДЕНИЕ
Внутрибольничная летальность у пациентов с ТЭЛА и артериальной гипотензией или развернутым шоком, выделяемых экспертами Европейского общества кардиологов (ESC) в группу высокого риска, достигает 35–58%, а среди гемодинамически стабильных на момент поступления в стационар пациентов с дисфункцией правого желудочка (ПЖ), относимых к группе промежуточного риска, уровень смертности в течение 30 дней варьирует в пределах от 6 до 15% [1–3]. Одной из ведущих причин смерти у пациентов с ТЭЛА является обструктивный шок (ОШ), который осложняет течение заболевания приблизительно в 8% случаев, и ассоциирован с высоким уровнем летальности, достигающем в первые 7 сут 30–50% [4, 5]. В случае манифестации шока на догоспитальном этапе пациенты имеют крайне неблагоприятный прогноз, главным образом по причине необратимого ишемического поражения жизненно важных органов и развития тяжелой полиорганной недостаточности, приводящей к смерти, даже несмотря на эффективную реперфузионную терапию. Одним из перспективных путей снижения смертности от ТЭЛА представляется предупреждение развития ОШ среди гемодинамически стабильных больных, учитывая то, что данное осложнение часто развивается постепенно и на ранних стадиях является обратимым. В настоящее время для определения тактики ведения пациентов с ТЭЛА широко используется алгоритм, предложенный экспертами ESC (2014), согласно которому нормотензивным пациентам группы повышенного риска краткосрочной смерти, относящихся к III–V классу по шкале PESI (Pulmonary Embolism Severity Index) или имеющих эхокардиографические (ЭХОКГ) признаки дисфункции ПЖ и/или повышенную концентрацию биомаркеров (тропонина и/или мозгового натрийуретического пептида (МНУП) или его прогормона), необходимо проведение непрерывного мониторинга и антикоагулянтной терапии; в то время как наличие признаков развивающегося шока требует проведения экстренной реперфузионной терапии [3]. Данный алгоритм тем не менее не лишен ряда недостатков: он не всегда позволяет четко идентифицировать пациентов «промежуточно высокого риска», поскольку не существует точно определенного прогностически значимого порогового значения биомаркеров, отсутствует унифицированный алгоритм ЭХОКГ оценки дисфункции ПЖ, и, наконец, в некоторых работах применение алгоритма стратификации риска не способствовало снижению летальности от ТЭЛА [6, 7]. Кроме того, действующий алгоритм ориентирован на прогнозирование смертности, в структуру которой, помимо шока, входят фатальный рецидив, тяжелые сопутствующие заболевания, жизнеугрожающие нарушения ритма, перфорация ПЖ и прочие состояния, с различным механизмом развития, плохо поддающиеся алгоритмизированию и лечению. Точное и своевременное выявление пациентов с высоким риском развития именно ОШ является чрезвычайно актуальной задачей, решение которой может позволить снизить смертность у больных ТЭЛА.
Ранее нами была предложена собственная шкала ROCky для прогнозирования неблагоприятного течения ТЭЛА, включающая такие факторы риска, как ЧСC ≥110 уд./мин, АД ≤100 мм рт.ст., положительный тест на сердечный белок, связывающий жирные кислоты (сБСЖК), и наличие сахарного диабета (СД) 2 типа [8]. Эффективность данной шкалы в предсказании развития ОШ остается неизученной.
Цель работы: изучить клинические, анамнестические и лабораторно-инструментальные предикторы развития ОШ у больных ТЭЛА, а также оценить эффективность шкалы ROCky в отношении прогнозирования развития обструктивного шока среди пациентов промежуточного риска.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В исследование был включен 121 пациент с ТЭЛА промежуточного или высокого риска летального исхода, поступивший в ГКБ № 15 им. О.М. Филатова г. Москвы в период 01.09.2013 по 01.06.2016. Диагноз ТЭЛА был подтвержден в 115 случаях данными мультиспиральной компьютерной томографии (МСКТ) с контрастированием легочной артерии (ЛА) или ЭХОКГ в тех случаях, когда проведение МСКТ не представлялось возможным (6 больных). Пациенты были классифицированы как высокого (27 человек, 22,3%) или промежуточного (94 человека, 77,7%) риска летального исхода по наличию инструментальных или лабораторных признаков дисфункции ПЖ и/или соответствовали III–V классу по шкале PESI. В качестве ЭХОКГ критериев дисфункции ПЖ использовалось сочетание увеличения конечно-диастолического размера (КДР) ПЖ более 30 мм и повышения систолического давления в легочной артерии (СДЛА) более 30 мм рт.ст. Критериями невключения в исследование являлись наличие хронической сердечной недостаточности (ХСН), резистентной к терапии, злокачественных новообразований с ожидаемой продолжительностью жизни менее 12 мес, перенесенного в течение последних 30 дней инфаркта миокарда (ИМ), тяжелых нарушений функции печени и почек (клиренс креатинина (КК), рассчитанный по формуле Кокрофта–Голта <15 мл/мин, активность аспартатаминотрансферазы и аланинаминотрансферазы >3 верхних границ норм), фракция выброса левого желудочка (ФВ ЛЖ) <20%. Пациенты были распределены на 2 группы: первую составили 29 больных (24%), у которых к моменту поступления в стационар или в течение 30 последующих дней развился обструктивный шок, во вторую группу вошли 92 больных (76%) без признаков обструктивного шока. Схема распределения пациентов на группы представлена на рис. 1.
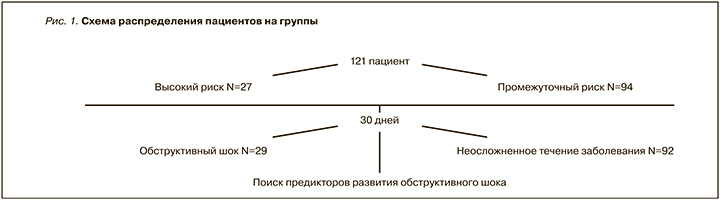
Проспективно в группах были оценены следующие показатели: клинические данные (уровень систолического артериального давления (САД) и частоты сердечных сокращений (ЧСС), анамнестические показатели (наличие факторов риска развития венозной тромбоэмболии (ВТЭ), сопутствующие заболевания, синкопальные состояния), инструментальные параметры: ЭХОКГ признаки дисфункции ПЖ (диаметр правого предсердия (ПП) и конечно-диастолический размер (КДР) ПЖ, соотношение КДР ПЖ и левого желудочка (ЛЖ), уплощение и парадоксальное движение межжелудочковой перегородки (МЖП), систолическое давление в легочной артерии (СДЛА), наличие тромботических масс в правых камерах сердца), а также оценка ФВ ЛЖ; ультразвуковое ангиосканирование (УЗАС) вен нижних конечностей с целью определения наличия тромбоза глубоких вен (ТГВ) и локализации тромбоза в периферической венозной системе; МСКТ ЛА для оценки локализации тромботических масс. Также в качестве исследуемых показателей были оценены уровни креатинина сыворотки крови с расчетом КК по формуле Кокрофта–Голта, гемоглобина, МНУП – его концентрация определялась количественным методом с помощью экспресс-анализатора Triage MeterPro (Biosite, США) с референтными значениями 0–100 пг/мл, сердечного тропонина (сТн) I (определение проводилось количественным иммунологическим методом на анализаторе Immulite 2000 XPi (Siemens Healthcare Diagnostics Inc., США), диагностически значимая концентрация 0,2 нг/мл), сердечного белка, связывающего жирные кислоты (сБСЖК) (с помощью качественного иммунохроматографического теста КардиоБСЖК (НПО БиоТест, Новосибирск, РФ) с диагностически значимым порогом 10 нг/мл).
Ретроспективно в группе гемодинамически стабильных пациентов была оценена прогностическая значимость шкалы ROCky в отношении развития обструктивного шока (позитивный сБСЖК тест – 2 балла, САД ≤100 мм рт.ст. – 2,5 балла, наличие СД 2 типа – 2,5 балла, ЧСС ≥110 уд./мин – 1,5 балла). Пороговое значение шкалы ROCky для определения группы повышенного риска выбрано ≥3,5 балла (в соответствии с указанными ранее оптимальными пороговыми значениями для различных конечных точек).
Длительность наблюдения составляла 30 сут с момента поступления в стационар.
Статистическая обработка проводилась с использованием пакета статистических программ STATISTCA 10.0, Microsoft Excel 10.0. Количественные данные представлены в виде M±σ для признаков с нормальным распределением или Me (Q25–Q75) для признаков с распределением, отличным от нормального. Статистическая значимость различий количественного признака в двух несвязанных совокупностях исследована с помощью непараметрического метода U-критерия Манна–Уитни (для признаков, не отвечающих критериям нормального распределения) и t-критерия по Стьюденту (для нормального распределения). Частотный анализ качественных бинарных признаков проводился с использованием критерия Chi2 по Пирсону, для малочисленных признаков использовался двухсторонний точный критерий Фишера. Наличие ассоциации между признаком и неблагоприятным исходом оценивалось по коэффициенту корреляции r по методу Спирмана. В качестве статистических характеристик предиктора использовались чувствительность (Se), специфичность (Sp), позитивная прогностическая значимость (ППЗ), негативная прогностическая значимость (НПЗ), коэффициент позитивного правдоподобия (КПП), коэффициент негативного правдоподобия (КНП). Критический уровень значимости (р) принят равным 0,05.
Проведение исследования было одобрено этическим комитетом РНИМУ им. Н.И. Пирогова Минздрава России.
 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
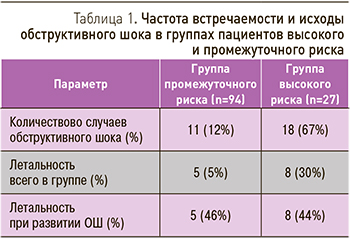
Из 29 пациентов с ОШ в 18 случаях (62%) признаки шока отмечались уже при поступлении в стационар, в 11 случаях (38%) проявления шока развились в более поздние сроки. Уровень летальности не зависел от сроков развития ОШ и составил 44 и 46% соответственно (табл. 1).
ОШ являлся непосредственной причиной летального исхода у 5% пациентов промежуточного риска и у 30% больных высокого риска, оцененного на момент поступления. Для лечения ОШ тромболитическая терапия (ТЛТ) была проведена в 20 случаях (69%), 8 пациентам (27,6%) ТЛТ не проводилось из-за наличия абсолютных противопоказаний, 1 больному (3,4%) ТЛТ не выполнена ввиду стабилизации гемодинамики на фоне антикоагулянтной терапии. Выживаемость среди пациентов с шоком, которым была проведена ТЛТ, составила 70%, тогда как среди пациентов с противопоказаниями к ТЛТ – лишь 22% (p >0,05). Высокая смертность среди пациентов без проведения ТЛТ может быть обусловлена не только собственно течением ТЭЛА, но и наличием тяжелой сопутствующей патологии. Среди умерших в стационаре пациентов с ОШ (13 человек) первостепенность ТЭЛА не вызывала сомнений только 5 случаях (38,5%), у 8 пациентов также имелись другие состояния, значительно отягощавшие прогноз.
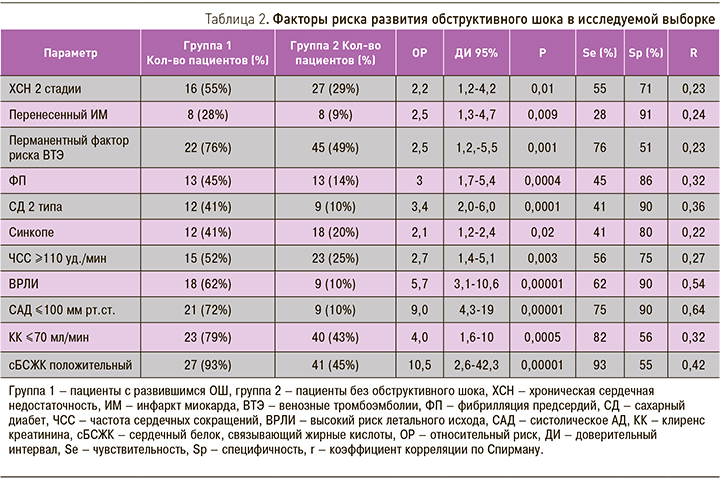
С целью выявления предикторов развития ОШ был проведен сравнительный анализ исследуемых групп по изучаемым клиническо-анамнестическим и лабораторно-инструментальным показателям. Группы достоверно не различались по половому составу (35% мужчин в группе 1 и 36% мужчин в группе 2), возрасту (70,2±16,3 и 63,3±16,1 лет соответственно), индексу массы тела (27,5 (24,5–34) и 31 (23,1–35) кг/м2 соответственно) (p >0,05). Достоверные различия между группами были выявлены по следующим качественным бинарным показателям (табл. 2): наличие ХСН 2 А или Б стадии, перенесенный ранее ИМ, сахарный диабет 2 типа (СД), фибрилляция предсердий (ФП), постоянный фактор риска ВТЭ, синкопальное состояние, высокий риск летального исхода (ВРЛИ) по алгоритму ЕОК (2014) при поступлении, положительный тест на сБСЖК. Также были выявлены достоверные различия по количественным показателям: ЧСС (110 (99–120) и 95 (80–108) уд./мин соответственно; p=0,0002), уровень САД (88 (70–105) мм рт.ст. и 130 (115–140) мм рт.ст. соответственно; p=0,0000001); КК (50 (36–69) и 75 (42–104) мл/мин соответственно; р=0,007). Для количественных переменных (КК, САД, ЧСС) методом сравнения межквартильных размахов в группах определены прогностически значимые пороговые уровни. С неблагоприятным исходом были ассоциированы ЧСC ≥110 уд./мин, САД ≤100 мм рт.ст. и КК ≤70 мл/мин.
С целью проведения ретроспективного анализа эффективности шкалы ROCky в качестве предиктора развития ОШ среди нормотензивных пациентов из исследуемой популяции были исключены пациенты высокого риска (27 человек), таким образом, дальнейший анализ проводился в популяции, куда вошли 11 пациентов с обструктивным шоком и 83 пациента без него, всего 94 пациента (рис. 2).
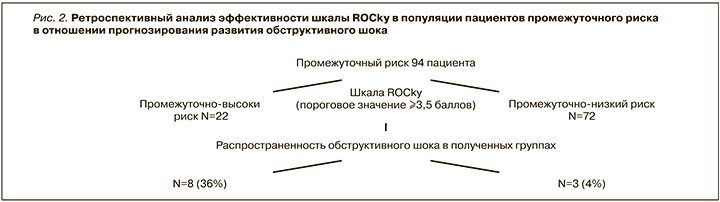
С помощью шкалы ROCky в качестве классифицирующего признака с пороговым значением ≥3,5 балла была проведена ретроспективная стратификация риска среди нормотензивных пациентов в исследуемой популяции. Пациенты были распределены на группы промежуточно высокого (n=22) и промежуточно низкого риска (n=72). Частота развития обструктивного шока в полученной группе промежуточно высокого риска составила 36% (8 случаев), в группе промежуточно низкого риска – 4% (3 пациента), (ОР 9, ДИ 95% 2,5–30; p <0,001). Чувствительность шкалы ROCky составила 73%, специфичность 83%, позитивная предсказательная значимость – 36%, негативная предсказательная значимость – 96%, коэффициент положительного правдоподобия – 4,3, коэффициент отрицательного правдоподобия – 0,3.
ОБСУЖДЕНИЕ
Литературные данные о распространенности и прогнозировании развития ОШ весьма ограничены, поскольку большинство исследований в качестве конечной точки используют показатель летальности. В исследовании Pivetti и соавт. [9] распространенность ОШ среди всех поступивших пациентов с ТЭЛА составила 10%, а уровень летальности при его манифестации – 37,5%, что несколько ниже, чем в нашем исследовании (24 и 45% соответственно). Это может объясняться особенностями популяции (пациенты низкого риска с ожидаемым благоприятным течением заболевания не включались в наше исследование). Уровень смертность среди пациентов с ОШ, которым не проводилась ТЛТ в исследовании Pivetti, соответствует результатам, полученным в настоящей работе (81,8 и 78% соответственно), а выживаемость при проведенной ТЛТ теми же авторами сообщается значительно выше (100 против 30% соответственно), что также может быть связано с тем, что в настоящее исследование включались потенциально более тяжелые пациенты.
Способы прогнозирования развития обструктивного шока в отдельности от других осложнений ТЭЛА изучены недостаточно. ОШ упоминается в составе комбинированной конечной точки всего в нескольких прогностических шкалах [10–13]. Шкала ROCky, так же как и вышеперечисленные модели, была создана для прогнозирования комбинированной конечной точки, и исследование ее прогностической значимости среди пациентов промежуточного риска в отношении развития ОШ проводилось ретроспективно, что является ограничением данной работы и требует подтверждения в проспективных исследованиях. Однако факторы риска развития ОШ, полученные в ходе статистического анализа, в целом соответствуют факторам риска комбинированной конечной точки, хотя и имеют различную степень предикторной значимости для разных исходов, что может быть использовано для корректировки прогностического алгоритма. Исключение составил показатель тропонина I, уровень которого достоверно не различался в группах сравнения в настоящем исследовании.
ЗАКЛЮЧЕНИЕ
Предикторами развития обструктивного шока у пациентов с ТЭЛА являются наличие хронической сердечной недостаточности, фибрилляции предсердий, сахарного диабета 2 типа, постоянного фактора риска ВТЭ, синкопальных состояний, положительный тест на сБСЖК, ЧСС ≥110 уд./мин, САД ≤100 мм рт.ст., клиренс креатинина ≤70 мл/мин. Указанные маркеры могут быть использованы как в монофакторных, так и в мультифакторных моделях для дальнейшего проспективного изучения. Прогностическая шкала ROCky в ретроспективном исследовании в популяции промежуточного риска продемонстрировала высокую эффективность в отношении прогнозирования развития обструктивного шока, что позволяет рекомендовать ее к дальнейшему изучению в проспективных исследованиях.



