Бронхиальная астма (БА) – типичное мультифакторное заболевание, которое развивается при сложном взаимодействии множества генов, факторов внешней среды и ген-средовых взаимодействий [1, 2, 3]. В основе оптимального лечения БА лежит концепция, объединяющая генетическую предрасположенность с механизмом заболевания и терапевтическим эффектом, поэтому особый интерес представляет молекулярно-генетическое исследование фенотипов астмы [4]. В последние годы увеличивается число публикаций, посвященных полиморфизму генов рецепторов врожденного иммунитета (TLR), реализующих свое действие на начальных этапах взаимодействия с антигеном и определяющих интенсивность иммунного ответа на микробные и немикробные аллергены [5, 6, 7].
Установлено, что TLR участвуют в распознавании аллергенов в дыхательных путях, регулируют активность и поляризацию адаптивного Th1, Th2, Th17 иммунного ответа, играя важную роль в развитии БА [6]. Ключевое значение среди полиморфизмов, влияющих на функции TLR, имеют однонуклеотидные единичные замены (SNP) в генах, ответственных за внутренний и внешний домены рецепторов TLR. Изменение их структуры и функции формирует дефекты проведения сигнала внутрь клетки, что сопровождается нарушением экспрессии цитокинов и других эффекторных молекул клетками иммунной системы и эпителием дыхательных путей и способствует развитию гиперреактивности и ремоделированию дыхательных путей [1, 5, 8, 9].
Цель исследования – определить полиморфные маркеры генов рецепторов врожденного иммунитета при аллергическом и неаллергическом фенотипах БА.
МАТЕРИАЛ И МЕТОДЫ
Клинические и иммуногенетические исследования выполнены у 100 больных русской национальности Ставропольского края с БА, находившихся на амбулаторном лечении в ГБУЗ СК «Городская поликлиника № 1» г. Ставрополя. Аллергическая астма (АБА) была диагностирована у 65 пациентов, неаллергическая (НБА) – у 35. Возраст больных находился в диапазоне 20–70 лет; медиана этого показателя в группе АБА составила 34 [23,5; 45] года, в группе НБА – 61 [47; 66] год (p <0,001).
В контрольную группу вошли 50 практически здоровых людей в возрасте от 18 до 60 лет.
Клинико-инструментальные и лабораторные методы исследования включали сбор аллерго-анамнеза, клинический осмотр пациентов, оценку тяжести течения БА, исследование функции внешнего дыхания с применением компьютерной спирографии, пикфлоуметрии, Rh-графию легких и придаточных пазух носа, определение антител – IgM, IgG к Chl. pneumoniae и Mycoplasma pneumoniae – методом иммуноферментного анализа (ИФА), цитологическое исследование индуцированной мокроты.
Содержание общего и специфических IgE в сыворотке крови определяли методом твердофазного хемилюминесцентного анализа с помощью наборов реагентов Total IgE (Siemens, США) и панелей аллергенов: пыльцевых, бытовых, эпителиальных и плесневых аллергенов (Siemens Healthcare Diagnostics Inc, США).
Для оценки клеточного состава индуцированной мокроты 50 мкл биоматериала наносили на предметное стекло, высушивали в течение 10 мин в термостате при температуре 37 0С, фиксировали в парах 40% формалина и окрашивали по Романовскому–Гимзе. С помощью световой микроскопии подсчитывали не менее 400 клеток в 50–100 полях зрения.
Для выявления полиморфных маркеров генов TLR2 G2258A (Arg753Gln), TLR6 C745T (Ser249Pro), CD14 C(-159)T методом полимеразной цепной реакции в работе использовали диагностические тест-системы «SNP-экспресс» (ООО НПФ «Литех», г. Москва). Разделение продуктов амплификации проводили методом горизонтального электрофореза в 3% агарозном геле, приготовленном на ТЕА-буфере с использованием электрофоретической детекции результатов ПЦР (BioRad Laboratories, США). Для идентификации результатов электрофореза применяли 1% раствор бромистого этидия, фрагменты ДНК визуализировались в виде светящихся оранжево-красных полос (УФ-излучение длиной волны 310 нм).
Для статистического анализа данных использовали пакет программ Attestat 10.5.1, Primer of Biostat 4,0.
Количественные значения представляли в виде медианы и интерквантильного (25 и 75 процентили) размаха (Me (Q1-Q)). Для оценки межгрупповых различий количественных признаков применяли однофакторный дисперсионный анализ, критерии Крускала–Уоллиса, Ньюмена–Кейлса, Данна. Статистически значимыми считали различия при p <0,05. Достоверность различий в частотах аллельных вариантов и генотипов оценивали с помощью критерия χ2 Пирсона. Для расчета соответствия распределения генотипов в популяционной выборке закону Харди–Вайнберга применялось программное обеспечение Hardy–Weinberg equilibrium calculator. Степень риска развития событий оценивали по величине отношения шансов (OR) с расчетом доверительного интервала CI.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При анализе распределения аллелей и генотипов TLR2 в зависимости от клинического фенотипа БА было выявлено уменьшение частоты распространенного аллеля 2258G как у пациентов с аллергической (85,4%, p <0,05), так и неаллергической БА (82,9%, p <0,05) (табл. 1).

Установлено уменьшение риска развития АБА (OR=0,24; CI: 0,08–0,74) и НБА (OR=0,20; CI: 0,06–0,65) у носителей доминантного аллеля 2258G.
Распространенность редкого аллеля 2258А, напротив, увеличивалась и составила в группе пациентов с АБА 14,6% (p <0,05), в группе с НБА – 17,1% (p <0,05). Выявлено повышение относительного риска развития АБА (OR=4,10; 95% CI: 1,35–12,5) и НБА (OR=4,97; 95% CI: 1,53–16,2) у резидентов минорного аллеля 2258А.
Не установлено статистически значимых межгрупповых различий по частоте встречаемости генотипов GA, AA в зависимости от фенотипа БА и по сравнению со здоровыми людьми. Отмечено уменьшение частоты встречаемости гомозиготного генотипа G2258G у пациентов с АБА (80,0 и 94%; p <0,05) и НБА (77,1 и 94%; p <0,05) со снижением риска развития заболевания.
Таким образом, можно предполагать, что носительство редкого аллеля 2258A повышает риск развития заболевания и обладает предиктивными свойствами в отношении развития БА, в то время как наличие мажорного аллеля 2258G и гомозиготного генотипа G2258G уменьшает вероятность развития болезни. Полученные закономерности не зависят от клинического фенотипа БА и подтверждаются для пациентов как с АБА, так и НБА. Вероятно, носительство редкого аллеля TLR2 2258A можно рассматривать как фактор, предрасполагающий к развитию БА в популяции Ставропольского края.
Ранее было показано, что иммунный ответ, индуцированный при взаимодействии с TLR2, играет важную роль в развитии Th2-ассоциированых заболеваний [6, 10] и может участвовать в развитии экспериментальной БА. Установлено, что активация TLR2 его синтетическими лигандами APC Pam3Cys способствует увеличению синтеза Th2-ассоциированных молекул интерлейкина-13 (IL-13) и IL-1β, гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) и уменьшению продукции цитокинов, опосредованных Th1 (IL-12, фактор некроза опухоли альфа, IL-18, IL-27). Другой из синтетических лигандов TLR2 – PGN – способствовал активации базофилов и увеличению секреции IL-4 и IL-13 как в присутствии, так и в отсутствии IgE [11]. Было показано, что TLR2, присутствующий на поверхности альвеолярных макрофагов, участвует в распознавании аллергенов клещей домашней пыли [6] с формированием Th2-ответа и развитием аллергического воспаления.
При анализе клинических фенотипов БА ассоциация полиморфных маркеров гена TLR6 установлена лишь для пациентов с АБА (табл. 2).
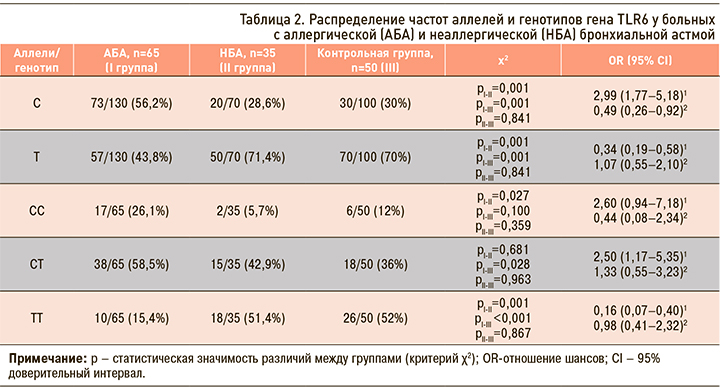
У больных АБА чаще, чем у пациентов с НБА (56,2 и 28,6%; p <0,001) и у здоровых резидентов (56,2 и 30%; p <0,001), определялось носительство мажорного аллеля 745С (Ser/249), реже – минорного аллеля 745T (Pro/249). Вероятность развития АБА у обладателей мажорного аллеля возрастала практически в 3 раза, относительный риск развития заболевания составил 2,99 (95% CI: 1,77–5,18). Следует отметить, что у пациентов с АБА достоверно чаще, чем у пациентов с НБА (26,1 и 5,7%; p <0,05), определялся гомозиготный генотип по распространенному в популяции аллелю С745С. При НБА, напротив, преобладающим был гомозиготный вариант по редкому аллелю вариант T745T (51,4 и 15,4%; p <0,001). У обладателей гетерозиготного генотипа С745T отмечено увеличение риска развития АБА (OR=2,50; 95% CI: 1,17–5,35), у носителей гомозиготного генотипа T745T – уменьшение вероятности верификации АБА (OR=0,16; 95% CI: 0,07–0,40).
Таким образом, увеличение вероятности развития АБА ассоциировалось с гетерозиготным генотипом С745T, уменьшение – с гомозиготным по редкому аллелю генотипом Т745T. Не выявлено ассоциации полиморфных маркеров гена TLR6 для НБА.
Существуют данные о том, что лимфоидные клетки у носителей защитного варианта TLR6 демонстрируют повышенную экспрессию цитокинов Th1 и снижение Th2-ассоциированной продукции IL-4 после специфической стимуляции [12]. Нами было установлено, что генотип TLR6 С745С обладает предиктивными свойствами и способствует развитию АБА: это может быть связано с низкой продукцией интерферона гамма (IFγ) и высокой продукцией IL-10 респондентами С745С. Клеточный механизм, объясняющий ассоциацию полиморфизма TLR6 с уменьшенной продукцией IFγ Тh1, неизвестен. Есть предположение, что доминирующий вариант аллеля 745С TLR6 обусловливает снижение числа функциональных карманов в LRR-участке рецептора и нарушает его взаимодействие с лигандами, а также активацию фактора транскрипции NF-kB. При этом редкий аллель 745Т TLR6 увеличивает их число и ассоциируется с повышенной продукцией провоспалительных цитокинов [13]. Высокий уровень IL-12 поддерживает поляризацию Th1, что определяет недостаточную функцию Th2.
При определении полиморфных маркеров CD14 С(-159)Т rs2569190 у пациентов с различными клиническими фенотипами БА установлено увеличение распространенного аллеля -159С (70,0 и 55,0%; p <0,05) и уменьшение редкого аллеля -159Т (30,0 и 45,0%; p <0,05) у пациентов с НБА по сравнению со здоровыми людьми (табл. 3).
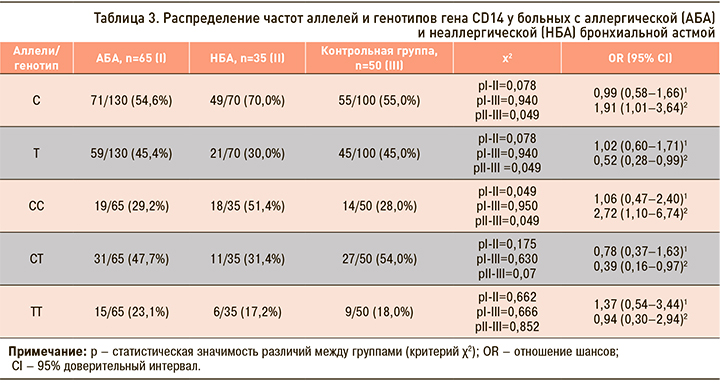
Риск развития НБА у обладателей аллеля -159С увеличивался (OR=1,91; CI: 1,01–3,64), а у резидентов аллеля -159T – уменьшался (OR=0,52; CI: 0,28–0,99). Распространенность гетерозиготного и гомозиготных по мажорному и минорному аллелям генотипов у пациентов с АБА оказалась сопоставимой с показателями в контрольной группе. У пациентов с НБА более распространенным был гомозиготный по распространенному аллелю генотип С(-159)С; статистически значимые различия выявлялись по сравнению с АБА (70,0 и 29,2%; p <0,05) и здоровыми людьми (51,4 и 28,0%; p <0,05).
Риск развития АБА не увеличивался в зависимости от генотипа. Вероятность развития НБА достоверно возрастала у гомозигот по распространенному аллелю – С(-159)С (OR=2,72; 95% CI: 1,10–6,74).
Таким образом, в нашей работе установлено увеличение риска развития НБА у резидентов распространенного аллеля -159С и гомозиготного генотипа С(-159)С, уменьшение – у респондентов минорного аллеля -159Т.
Ген молекулы CD14 локализован на длинном плече 5 хромосомы в близости к локусу 5q31-q33, ответственному за течение аллергических заболеваний, включая БА [14]. Взаимодействие липополисахаридов с мембранной молекулой CD14 катализирует их связывание с рецептором TLR4 и передачу сигнала через TIR-домен адаптерным белкам MyD88, MyВ88, TRIF, что вызывает активацию транскрипционного фактора NF-κB с последующей экспрессией генов IL, NO-синтетазы и генов других молекул, ассоциированных с воспалением [15]. В дальнейшем каскаде активации отмечается усиление продукции провоспалительных цитокинов и медиаторов воспаления. Кроме того, увеличивается экспрессия генов цитокинов, обусловливающих дифференцировку Тh1-лимфоцитов – IL-12, IL-23, IL-27 [14, 15].
В соответствии с задачами исследования нами было проведено сопоставление клинических и лабораторных показателей у больных БА в зависимости от генотипов TLR2 G2258A, (rs5743708); TLR6 C745Т (rs5743810) и CD14 C(-159)T (rs2569190).
При распределении пациентов с различной степенью тяжести БА не выявлено ассоциации с генотипами TLR2 G2258A и TLR6 C745Т. При этом получено увеличение числа больных с легким течением БА среди пациентов с генотипом CD14 T(-159)T и увеличение количества пациентов с тяжелым и среднетяжелым течением заболевания у пациентов с генотипами C(-159)С и C(-159)T (рис.).
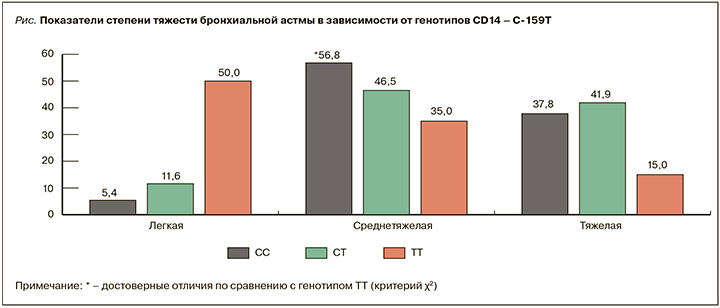
Следует отметить, что с генотипами C(-159)С и C(-159)T были ассоциированы и низкие показатели функции внешнего дыхания (табл. 4).
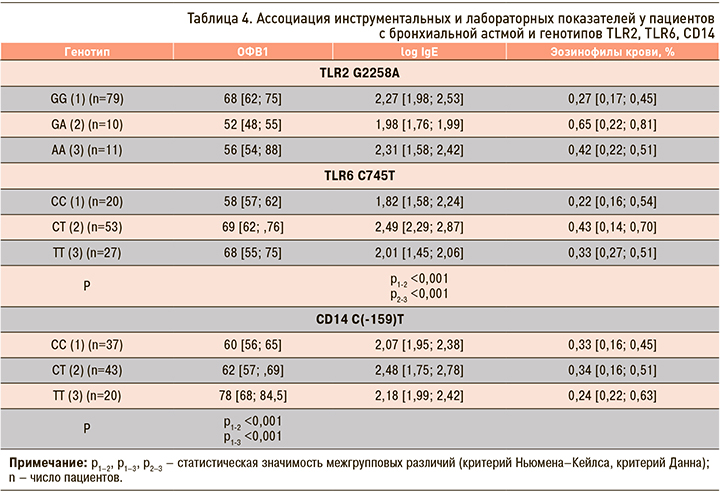
У гомозигот по доминантному аллелю (С-159С) уровень ОФВ1 составил 60 [56; 65], у гетерозигот (С-159T) – 62 [57; 69] (p <0,001), у гомозигот по рециссивному аллелю (T-159T) –78 [68; 84,5] (p <0,001).
Не было установлено взаимосвязи уровней эозинофилов периферической крови и изучаемых генотипов TLR2 G2258A, TLR6 C745Т, CD14 C(-159)T. Выявлена ассоциация показателей общего IgE с генотипом TLR6 C745Т. Наиболее высокие уровни logIgE определялись у гетерозигот C745Т – 2,49 [2,29; 2,87] (p <0,001). Взаимосвязи с другими полиморфными маркерами не установлено.
Не отмечено корреляции эозинофилов индуцированной мокроты и генотипов TLR6 C745Т (rs5743810) и CD14 C(-159)T (rs2569190).
Показано статистически значимое увеличение эозинофилов у гомозигот по рециссивному аллелю TLR2 А2258A – 17,1 [12,8; 27,8] (p <0,05) (табл. 5).
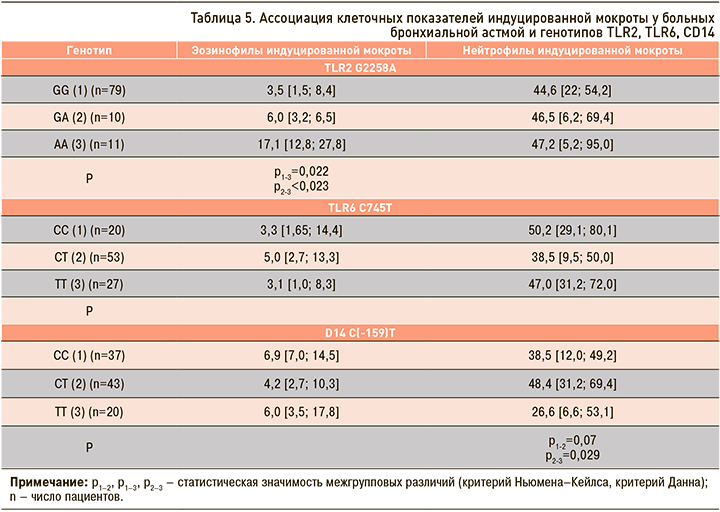
Число нейтрофильных гранулоцитов в мокроте при БА не зависело от полиморфных маркеров TLR2 А2258A и TLR6 C745Т. При этом их количество увеличивалось у резидентов гетерозиготного генотипа CD14 C(-159)T – 48,4 [31,2; 69,4] (p <0,05), что может быть связано с распространенностью тяжелого течения БА у этой категории больных (см. табл. 5).
Таким образом, формирование БА тяжелого и среднетяжелого течения, а также низкие показатели функции внешнего дыхания (ОФВ1) чаще ассоциированы с генотипами CD14 C(-159)С и CD14 C(-159)T, высокие показатели сывороточного IgE – с генотипом TLR6 С745Т. Увеличение эозинофилов в индуцированной мокроте выявлялось преимущественно у респондентов генотипа TLR2 А2258A, нейтрофильных гранулоцитов – у обладателей генотипа CD14 C(-159)T.
Результаты полученных исследований согласуются с экспериментальными данными о том, что полиморфизмы TLR служат важными факторами при развитии БА и подтверждают необходимость дальнейших исследований механизмов, лежащих в основе различных клинико-патогенетических вариантов БА.
ЗАКЛЮЧЕНИЕ
- Молекулярно-генетическими маркерами повышенного риска АБА являются аллели TLR2 2258A, TLR6 745С и генотип TLR6 С745Т, НБА – аллели TLR2 2258A и CD14(-159)C и генотип CD14С(-159)C.
- Тяжелое и среднетяжелое течение БА, а также низкие показатели функции внешнего дыхания (ОФВ1) ассоциированы с генотипами CD14 C(-159)С и CD14 C(-159)T, высокие показатели сывороточного IgE – с генотипом TLR6 С745Т.
- Преобладание эозинофилов в индуцированной мокроте больных БА связано с носительством генотипа TLR2 А2258A нейтрофильных гранулоцитов – генотипа CD14 C(-159)T.


