ВВЕДЕНИЕ
Хроническая сердечная недостаточность (ХСН) является заболеванием с высокой медико-социальной значимостью, обусловленной высокой распространенностью и неблагоприятным прогнозом. Согласно данным Атласа Ассоциации сердечной недостаточности Европейского общества кардиологов (ESC), встречаемость этой патологии составляет 3,20 (2,66– 4,17) случая на 1000 человеко-лет [1]. По данным российских эпидемиологических исследований, распространенность ХСН в общей популяции превышает 7%, медиана времени дожития среди пациентов с ХСН I–II функционального класса (ФК) равна 8,4 года, ХСН III–IV ФК – 3,8 года. Смертность от всех причин среди пациентов с ХСН I–II ФК достигает 4,8% в год, с ХСН III–IV ФК – 10,2%, что подтверждает неблагоприятный прогноз больных ХСН любого ФК [2, 3]. Это заболевание является ведущей причиной госпитализаций пациентов, особенно среди лиц старшего возраста: среднее число госпитализаций в данной возрастной группе составляет 2671 (1,771–4,317) на 1 млн человек в год [1].
Хроническая болезнь почек (ХБП) – наднозологическое понятие, объединяющее заболевания почек продолжительностью более 3 мес, проявляющиеся альбуминурией/протеинурией либо рядом других клинических проявлений и/или снижением скорости клубочковой фильтрации (СКФ) [4]. ХБП характеризуется бессимптомным течением, усложняющим ее своевременное распознавание, широкой распространенностью и выступает фактором риска, увеличивающим риск сердечно-сосудистой и общей смертности. ХБП обладает схожими патогенетическими механизмами развития с ХСН и занимает лидирующее место в структуре сопутствующей патологии у пациентов с сердечной недостаточностью [5, 6].
Вероятность обнаружения ХСН у пациентов с ХБП выше, чем у пациентов без ХБП, и составляет 42,9 и 18,5% соответственно; это определяет высокий интерес к течению ХБП у первой категории больных [7].
В настоящее время в мире насчитывается около 850 млн пациентов с ХБП [8]. По данным метаанализа, проведенного Hill N. et al., средняя встречаемость ХБП составила 13,4% (11,7–15,1%), а ХБП С3–5 стадии – 10,6% (9,2–12,2%) [5, 9]. В общей популяции распространенность ХБП C1–5 стадии в России достигает 4%, из которых на долю пациентов с ХБП С4–5 приходится 4,8% [10]. Среди 14 579 больных сердечной недостаточностью с сохраненной фракцией выброса левого желудочка (СНсФВ ЛЖ) в исследовании I-PRESERVE распространенность ХБП С3а стадии равнялась 32,2%, С3б – 23,2%, С4 – 12,6% [11].
Наличие признаков ХБП у пациентов с ХСН – фактор неблагоприятного прогноза, который характеризуется дополнительной активацией ренин-ангиотензин-альдостероновой системы (РААС) и гипергидратацией, обусловленной гипернатриемией и низкой чувствительностью почек к воздействию натрийуретических гормонов. В свою очередь, развитие ХСН у пациентов с ХБП сопровождается гуморальными (гиперактивация симпатической нервной системы, активация РААС, оксидативный стресс, дисфункция эндотелия) и гемодинамическими расстройствами (снижение сердечного выброса, гипоперфузия почек), приводящими к повышению степени тяжести заболевания почек и ухудшению прогноза [5, 12, 13]. Исследование I-PRESERVE продемонстрировало взаимосвязь нарастания тяжести ХБП у пациентов с СНсФВ ЛЖ с увеличением вероятности общей смертности и госпитализации по поводу ХСН. Возрастание этой вероятности было максимальным у лиц с ХБП С4 стадии: отношение рисков с поправкой на другие факторы составило 1,57 (р <0,001) для летальности и 1,91 (р <0,001) для госпитализации по поводу декомпенсации ХСН. В связи с этим ХБП считается одним из основных факторов риска, усугубляющих течение СНсФВ ЛЖ и ухудшающих прогноз жизни [11].
С целью своевременной диагностики декомпенсации основной и сопутствующей патологии у пациентов с ХСН и ХБП, наблюдающихся в амбулаторных условиях, необходимы высокочувствительные и легко воспроизводимые маркеры декомпенсации клинического состояния, одним из которых служит индекс глобальной функции левого желудочка (ИГФ ЛЖ).
ИГФ ЛЖ – маркер, учитывающий как функциональные параметры, так и структурные характеристики ЛЖ. Впервые описанный в 2013 г. [14] и оцениваемый с помощью магнитно-резонансной томографии (МРТ), ИГФ ЛЖ рассматривается как независимый предиктор возникновения сердечной недостаточности, неблагоприятных сердечно-сосудистых событий и летального исхода. В последние годы появились работы, демонстрирующие не только возможность расчета и дальнейшего использования ИГФ ЛЖ с помощью эхокардиографического (ЭхоКГ) исследования, но и новые перспективы применения данного маркера, в частности, для дифференцирования амилоидоза сердца от гипертрофической кардиомиопатии [15–17].
Взаимное влияние на развитие и прогрессирование ХСН и ХБП, высокая встречаемость ХБП как сопутствующей патологии при ХСН, отсутствие работ, посвященных исследованию ИГФ ЛЖ у пациентов старшего возраста с ХСН и ХБП, послужили основанием для проведения предлагаемого исследования.
Цель исследования – оценить прогностическую значимость ИГФ ЛЖ у пациентов пожилого возраста с ХСН и ХБП, наблюдающихся в амбулаторных условиях.
МАТЕРИАЛ И МЕТОДЫ
Проведено открытое наблюдательное исследование.
Критерии включения:
- пациенты с ХСН II–IV ФК в соответствии с классификацией Нью-Йоркской ассоциации сердца (NYHA), наблюдающиеся в амбулаторных условиях;
- возраст 60 лет и старше;
- наличие ХБП согласно критериям KDIGO (2012) [18];
- отсутствие госпитализаций по поводу декомпенсации ХСН и стабильное медикаментозное лечение ХСН в течение 1 мес до включения в исследование;
- оптимальная визуализация сердца при ЭхоКГ исследовании.
Критерии исключения: терминальная стадия ХБП (С5), цирроз печени, паренхиматозные заболевания почек, гемодинамически значимые поражения клапанов сердца, гипертрофическая кардиомиопатия, инфаркт миокарда, инсульт в течение 3 мес до включения в исследование, онкогематологические заболевания, солидные опухоли с метастазированием, психиатрические заболевания, отказ от подписания согласия на проведение исследования.
Сплошное включение пациентов в исследование проводилось с сентября 2014 г. по декабрь 2017 г. в ГБУЗ «Диагностический клинический центр № 1» Департамента здравоохранения г. Москвы. В представленный ниже фрагмент исследования вошли 85 пациентов, разделенные на две группы в зависимости от наличия или отсутствия ХБП:
- основная группа – 59 пациентов с ХБП и ХСН: 27 (46%) мужчин и 32 (54%) женщины в возрасте от 70 до 88 лет (медиана 76 (75–80) лет);
- группа сравнения – 26 пациентов с ХСН и без ХБП: 10 (38%) мужчин и 16 (62%) женщин в возрасте от 70 до 85 лет (медиана 76 (72–79) лет).
На момент включения все пациенты подписали информированное согласие на добровольное участие в исследовании. Проведение исследования было принято к сведению Этическим комитетом ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.
У всех пациентов проводился сбор жалоб и анамнеза, общепринятый физикальный осмотр, оценивались клинико-демографические показатели и медикаментозное лечение. Диагноз ХСН подтверждался на основании наличия симптомов и/или клинических признаков (в покое или при физической нагрузке), объективными признаками дисфункции сердца (в покое) на основании проведенного ЭхоКГ-исследования [2]. Госпитализация по причине декомпенсации сердечно-сосудистого заболевания (ССЗ) и летальный исход рассматривались в качестве конечных точек. Период наблюдения составил 36 (20–40) мес.
ЭхоКГ выполнялось в двухмерном (В-режиме) и допплеровских режимах (импульсно-волновом и постоянно-волновом) на аппарате GE Vivid-3. При ЭхоКГ-исследовании придерживались рекомендаций, предложенных Американской ассоциацией эхокардиографии (ASE) и Европейского общества сердечно-сосудистой визуализации (EACI) [6, 7].
ИГФ ЛЖ (в процентах) рассчитывался по формуле: (УО ЛЖ/ГО ЛЖ) × 100, где УО ЛЖ – ударный объем ЛЖ; ГО ЛЖ – глобальный объем ЛЖ. В свою очередь, ГО ЛЖ вычислялся как сумма среднего объема полости ЛЖ и объема миокарда по формуле: (КДО ЛЖ + КСО ЛЖ)/2 + ММЛЖ/ПЛЖ, где КДО ЛЖ – конечный диастолический объем ЛЖ; КСО ЛЖ – конечный систолический объем ЛЖ; ММЛЖ – масса миокарда ЛЖ; ПЛЖ – плотность ЛЖ. ПЛЖ была принята равной 1,05 г/мл.
КДО и КСО ЛЖ рассчитывали в двухмерном режиме методом дисков (модифицированное уравнение Симпсона). ММЛЖ (г) определяли по формуле: 0,8 × (1,04 × (МЖП + ЗСЛЖ + КДР)3 – КДР3) + 0,6, где МЖП – толщина межжелудочковой перегородки в диастолу (см); ЗСЛЖ – толщина задней стенки ЛЖ в диастолу (см); КДР – конечно-диастолический размер ЛЖ (см) [19].
Статистическая обработка данных проводилась с использованием пакета программ IBM SPSS Statistics 23.0.0.0. Для качественных признаков были рассчитаны абсолютная частота проявления признака и частота проявления признака в процентах (%). Для количественных признаков при нормальном распределении определялось среднеквадратичное отклонение среднего (M±SD), при ненормальном распределении – медиана (Me), 25-й и 75-й перцентили. Анализ вида распределения осуществлен с использованием критерия Шапиро–Уилка. При сравнении показателей двух групп при ненормальном распределении применялись непараметрические критерии: для количественных – ранговый U-критерий Манна–Уитни, для качественных – критерий χ2 Пирсона с поправкой Йетса и точным критерием Фишера.
Прогностическая значимость ИГФ ЛЖ оценивалась с помощью ROC-анализа. Для бинарных исходов вычислялись отношения шансов (ОШ) с 95% доверительными интервалами (ДИ). Различия считали статистически значимыми при значениях двустороннего p <0,05.
РЕЗУЛЬТАТЫ
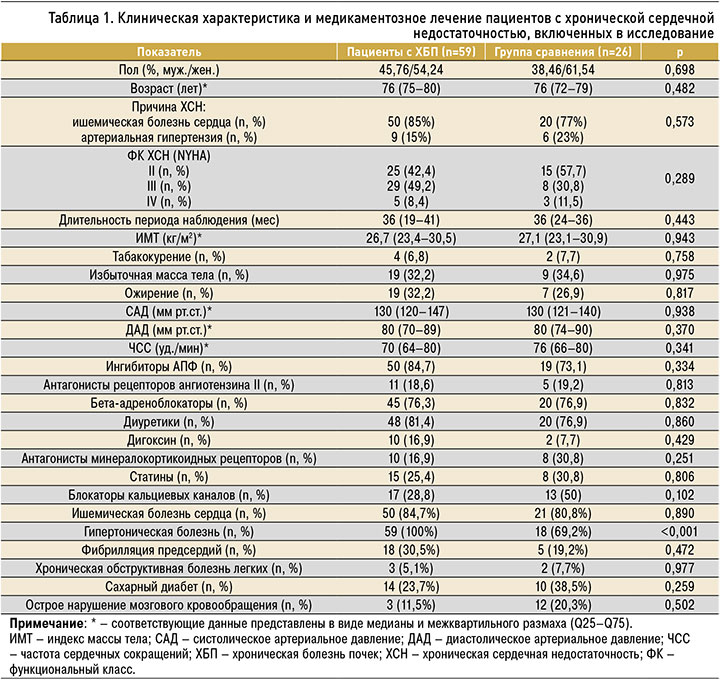
Клиническая характеристика и медикаментозное лечение пациентов, включенных в исследование, представлены в таблице 1, ЭхоКГ-показатели – в таблице 2.
В группе пациентов с ХСН и ХБП величина ИГФ ЛЖ (табл. 3) составила 19,3 (16,6–21,5)%, в группе сравнения – 20,1 (16,7–23,0)%.

По мере увеличения стадии ХБП регистрировалась тенденция к снижению величины ИГФ ЛЖ: при стадии С3а (n=36) этот показатель был равен 20,1 (16,5–21,6)%, при стадии C3b (n=22) – 18,6 (16,6–21,3)%. Стадия C4 имелась лишь у одного пациента, у которого ИГФЛЖ составил 18,4%.
Из-за декомпенсации ССЗ за период наблюдения были госпитализированы 44 (74,6%) пациента основной группы (n=59; 74,6%), среди них 11 (25%) человек имели II ФК ХСН по NYHA, 28 (64%) – III ФК, 5 (11%) – IV ФК (р <0,001).
Значение ИГФ ЛЖ у пациентов основной группы с госпитализациями (n=44) составило 18,6 (16,0–21,3)%, без госпитализаций (n=15) – 21,4 (19,2–21,8)% (p=0,034).
Значение ИГФ ЛЖ у лиц из группы сравнения с госпитализациями (n=16) равнялось 17,6 (15,7–21,0)%, без госпитализаций (n=10) – 22,9 (20,5–23,7)% (p=0,068).
На основании анализа ROC-кривой (рис. 1) оптимальное значение ИГФ ЛЖ для предсказания декомпенсации ССЗ с последующей госпитализацией у пациентов основной группы с чувствительностью 63,6% и специфичностью 66,7% составило 20,3% и ниже (площадь под кривой 0,685±0,071; 95% ДИ: 0,55–0,82; р=0,034).

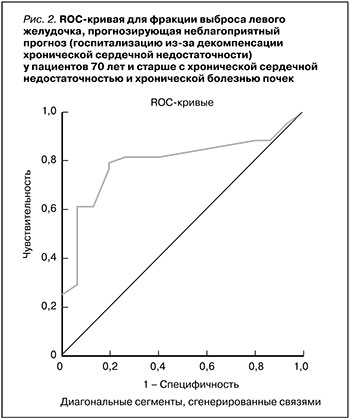
Оптимальное значение ФВ ЛЖ для предсказания декомпенсации ССЗ с последующей госпитализацией у пациентов основной группы (рис. 2) с чувствительностью 79,5% и специфичностью 80,0% составило 57,5% и менее (площадь под кривой 0,795±0,062; 95% ДИ: 0,67–0,92; р=0,001).
Летальность в группе пациентов с ХБП была выше по сравнению с группой сравнения: в первом случае умерло 18 из 59 (30,5%), во втором – 2 (7,7%) из 26 человек (ОШ 5,27; 95% ДИ: 1,12–24,71; р <0,05). Из 18 скончавшихся пациентов основной группы 15 (83,3%) имели III ФК ХСН по NYHA, 3 (16,7%) – IV ФК (р <0,001).
ИГФ ЛЖ продемонстрировал достаточный уровень информативности по результатам анализа ROC-кривой (рис. 3) для прогнозирования летального исхода (площадь под кривой 0,678±0,082; 95% ДИ: 0,52–0,84; р=0,035). Оптимальное значение ИГФ ЛЖ для предсказания летального исхода у пациентов с ХСН и ХБП с чувствительностью 66,7% и специфичностью 65,7% составило 19,2% и менее.

Оптимальное значение ФВ ЛЖ для предсказания летального исхода у пациентов основной группы (рис. 4) с чувствительностью 72,2% и специфичностью 65,9% составило 51% и менее (площадь под кривой 0,744±0,067; 95% ДИ: 0,61–0,88; р=0,003).
ОБСУЖДЕНИЕ
Исследование было посвящено оценке прогностической значимости ИГФ ЛЖ у амбулаторных пациентов старшего возраста с ХСН и ХБП. Средний возраст пациентов в основной группе и группе сравнения составил 76 лет, в обеих группах преобладали женщины, этиология ХСН в большинстве случаев была ишемической, при этом преобладали больные с СНсФВ ЛЖ: в основной группе их было 36 (61,0%, n=59), в группе сравнения – 16 (61,5%, n=26).
В основной группе превалировали пациенты с III ФК по NYHA, в группе сравнения – со II ФК по NYHA. Среди сопутствующей патологии у пациентов обеих групп наиболее часто встречались артериальная гипертензия, фибрилляция предсердий, сахарный диабет.
Величина ИГФ ЛЖ в основной группе составила 19,3 (16,6–21,5)%, и этот показатель оказался близким к полученным нами ранее данным у амбулаторных пациентов с ХСН – 21,7 (19,3–22,9)% [20].
Значение ИГФ ЛЖ для предсказания неблагоприятного прогноза у пациентов 60 лет и старше с СНcФВ ЛЖ составляет 21,1% и ниже [20]. В данном исследовании приняли участие 78 пациентов с СНсФВ ЛЖ в возрасте 74 (67–77) лет, при этом показатели ИГФ ЛЖ, определявшиеся с помощью ЭхоКГ, оказались существенно меньше при сравнении с результатами, которые были получены другими исследователями у лиц без ССЗ, а также у пациентов, перенесших острый инфаркт миокарда с последующей реваскуляризацией [14–16, 21, 22]. Низкие значения ИГФ ЛЖ в нашем исследовании вполне закономерны, так как ремоделирование ЛЖ у пациентов с ХСН выражено в наибольшей степени. По нашим данным, по мере увеличения ФК ХСН и стадии ХБП наблюдалась тенденция к снижению ИГФ ЛЖ. В доступной нам научной отечественной и зарубежной литературе мы не обнаружили работ, анализировавших прогностическую ценность ИГФ ЛЖ у пациентов с ХСН и ХБП, что требует дальнейшего изучения роли этого параметра у данной категории пациентов.
В нашей работе ИГФ ЛЖ рассчитывался при использовании двухмерного режима ЭхоКГ с расчетом объемов ЛЖ методом дисков (модифицированное уравнение Симпсона). Это принципиально важно в случае с больными ХСН, поскольку у значительной их части имеются нарушения локальной сократимости ЛЖ, которые не могут быть учтены при расчете объемов в М-режиме ЭхоКГ.
Согласно полученным нами результатам, у пациентов c ХСН и ХБП ИГФ ЛЖ показал прогностическую значимость в отношении летального исхода: отрезное значение ИГФ ЛЖ у пациентов с ХСН и ХБП составило 19,2% и ниже (р=0,035). При этой величине чувствительность ИГФ ЛЖ для предсказания неблагоприятного прогноза равнялась 66,7%, а специфичность – 65,7%. Мы наблюдали худшую выживаемость у пациентов с ХБП в сравнении с пациентами без этого заболевания (ОШ 5,27; р <0,05).
Отрезное значение ИГФ ЛЖ для предсказания декомпенсации ССЗ у пациентов с ХСН и ХБП составило 20,3% и ниже (площадь под кривой 0,685±0,071; 95% ДИ: 0,55–0,82; р=0,034). При этой величине чувствительность ИГФ ЛЖ для предсказания госпитализаций была 63,6%, а специфичность – 66,7%.
Чувствительность и специфичность ФВ ЛЖ для прогнозирования последующих неблагоприятных сердечно-сосудистых событий на субклинических стадиях заболевания недостаточны, поскольку этот параметр не чувствителен к изменениям массы ЛЖ. А вот ИГФ ЛЖ учитывает данный параметр, что делает его предпочтительнее, чем ФВ ЛЖ, поскольку значительным изменениям последнего предшествуют выраженные компенсаторные изменения массы и объема ЛЖ.
ЭхоКГ в условиях амбулаторного звена широко используется в клинической практике. ИГФ ЛЖ легко определяется с помощью общепринятого ЭхоКГ-исследования и объединяет информацию о глобальных систолических характеристиках ЛЖ с его анатомическими параметрами, имеет широкий ранг значений, коррелирующий с уровнем структурного ремоделирования ЛЖ [20].
СНсФВ ЛЖ характеризуется диастолической дисфункцией ЛЖ, основным компонентом формирования которой выступает фиброз миокарда. В основе фиброза лежат синтез коллагена (или снижение деградации коллагена), воспаление и окислительный стресс. Отложение коллагена, снижение растяжимости титина и эластичности кардиомиоцитов приводят к повышению диастолической жесткости ЛЖ [23].
В настоящее время появляются данные о новых фенотипах СНсФВ ЛЖ. Это, в частности, ассоциированный с ожирением [24] и воспалительно-метаболический фенотипы [25]. Основную роль в их патогенезе играют системные воспалительные, метаболические и гормональные нарушения, оказывающие негативное влияние не только на функционирование сердечно-сосудистой системы и течение ХСН, но и функцию почек. Наиболее частые причины воспалительно-метаболической СНсФВ ЛЖ – сахарный диабет и ожирение – являются важными причинами хронического заболевания почек. Кроме того, другие заболевания, связанные с СНсФВ (например, ревматоидный артрит, псориаз и неалкогольный стеатогепатит), увеличивают риск развития ХБП пропорционально тяжести воспалительного заболевания. На сегодняшний день СНсФВ ЛЖ рассматривается как мультиморбидная патология, к числу компонентов которой относится и ХБП. ХБП способствует развитию основных факторов, участвующих в повреждении и нарушении функции ЛЖ сердца при СНсФВ ЛЖ: воспаления и эндотелиальной дисфункции микрососудистого русла миокарда, нарушению нейрогормонального статуса (дополнительная активация РААС) и объемной (гемодинамической) перегрузке сердца. Кроме этого, дисфункция почек способствует задержке жидкости в организме, обусловленной гипернатриемией, изменению кислотно-щелочного равновесия и электролитного баланса [5, 12, 13, 26]. Показано, что провоспалительные медиаторы, ассоциированные с СНсФВ ЛЖ, связаны с прогрессирующим снижением функции клубочков. Почечная реакция на рост жировой ткани и воспаление могут запускать изменения в тубулогломерулярной обратной связи, что стимулирует гиперфильтрацию клубочков и ее неблагоприятное влияние на функцию почек [25].
В целом наличие воспалительно-метаболического фенотипа СНсФВ ЛЖ дает основания воспринимать его как комплексную проблему, объединяющую многие заболевания с характерной клинической картиной и неблагоприятным прогнозом [27]. Высокая распространенность ХБП в качестве сопутствующей патологии у пациентов с ХСН, а также общность механизмов развития и прогрессирования ХСН и ХБП обусловливают большое количество исследований, посвященных их взаимосвязи [6].
Во многих исследованиях показано наличие связи между клиническими проявлениями ХБП (СКФ <60 мл/мин/1,73 м2, альбуминурия А2) и некоторыми ЭхоКГ-параметрами нарушения структуры, диастолической и систолической функции ЛЖ у пациентов с СНсФВ ЛЖ [28, 29].
В исследовании Unger E.D. et al. участвовали 299 пациентов с СНсФВ I–III ФК NYHA, которые были разделены на группы с сохраненной функцией почек (СКФ 83,5 мл/мин/1,73 м2) и С3–С4 стадиями ХБП (СКФ 37,2 мл/мин/1,73 м2). К концу периода наблюдения, в среднем составившего 14 (5–24) мес, было установлено, что снижение СКФ связано с ухудшением некоторых параметров систолической динамики миокарда, оцениваемой с помощью спекл-трекинг ЭхоКГ: деформация левого предсердия в фазу резервуара, продольная деформация ЛЖ, свободное напряжение стенки правого желудочка. Снижение СКФ также было связано с худшими исходами (скорректированное отношение рисков на одно стандартное отклонение расчетной СКФ 1,28; 95% ДИ: 1,01–1,61; p=0,039). У пациентов с СНсФВ ЛЖ наличие ХБП ассоциировалось с ремоделированием сердца, значительно худшей сердечной механикой и худшими исходами [28, 30].
Структура и функции сердца начинают изменяться еще в дебюте ХБП независимо от других факторов риска, что сопровождается развитием или прогрессированием гипертрофии левого желудочка (ГЛЖ), способной приводить к СНсФВ ЛЖ, аритмиям и ишемии миокарда. ХСН у пациентов с ИБС на фоне ХБП представлена выраженными нарушениями диастолической функции при сохраненной ФВ ЛЖ в сравнении с пациентами без ренальной дисфункции. Поражение органов-мишеней при ХСН ишемической этиологии на фоне ХБП представлено более выраженной ГЛЖ и требует своевременной диагностики для предупреждения прогрессирования патологического процесса [31].
ИГФ ЛЖ служит высокочувствительным и легко воспроизводимым маркером декомпенсации клинического состояния, учитывает изменения структурных характеристик ЛЖ, обусловленные влиянием ХБП на развитие и прогрессирование СНсФВ ЛЖ, обладает дополнительной прогностической ценностью в сравнении с ФВ ЛЖ при использовании стандартных ЭхоКГ показателей. Все это позволяет считать его предпочтительным маркером для предсказания неблагоприятного прогноза и декомпенсации ССЗ у пациентов с ХСН и ХБП в условиях амбулаторного звена.
ЗАКЛЮЧЕНИЕ
Полученные нами результаты свидетельствуют, что по мере увеличения как ФК ХСН, так и стадии ХБП наблюдалась тенденция к снижению ИГФ ЛЖ.
Отрезное значение этого параметра для предсказания декомпенсации ССЗ с последующей госпитализацией у пациентов 70 лет и старше с ХСН и ХБП составило ≤20,3%, для предсказания летального исхода – ≤19,2%.
Полученные нами результаты имеют большое значение для раннего выявления пациентов с ХСН и ХБП в возрасте 70 лет и старше, имеющих повышенный риск развития осложнений и наблюдающихся в амбулаторно-поликлинических условиях.



