ВВЕДЕНИЕ
Остеоартрит (ОА) остается наиболее распространенным заболеванием суставов, особенно среди пожилых людей. Он характеризуется прогрессирующим поражением всех тканей сустава и, конечно, болью, выступающей основным клиническим признаком этой патологии. Несмотря на то что обычно ОА прогрессирует медленно, в конечном итоге он в 10% случаев приводит к инвалидности. ОА представляет серьезную проблему для систем здравоохранения XXI в. [1]. Так, в отчете «Глобальное бремя болезней – 2020» сообщается об увеличении распространенности и заболеваемости ОА в США с 1990 по 2017 г. на 9,3 и 8,2% соответственно [2]. При этом распространенность заболевания увеличивается с возрастом: в тех же США в 2005 г. ОА был обнаружен у 13,9% взрослых в возрасте >25 лет и у 33,6% – в возрасте >65 лет. Прогнозируется, что к 2040 г. страдать ОА будет 25,9% всего взрослого населения Америки [3–5].
Хотя к настоящему времени установлены многочисленные факторы риска развития ОА, включая генетическую предрасположенность, старение, ожирение, механическую перегрузку и травматическое повреждение суставов, точная этиология ОА остается в значительной степени не раскрытой. Во всем мире 80% пациентов с ОА страдают от ограничений в движениях, а 25% испытывают трудности при выполнении основных повседневных активностей, что свидетельствует о значительном влиянии болезни на функциональные нарушения и инвалидность [6]. По данным метаанализа Leyland K.M. et al. (2021), было выявлено повышение риска преждевременной смертности на 23% (95% доверительный интервал (ДИ): 1,07–1,42) при ОА коленного сустава и на 20% (95% ДИ: 1,04– 1,37) в случае ОА тазобедренного сустава [7].
Ранее ОА рассматривался как дегенеративное заболевание, возникающее вследствие повреждения хряща, однако совершенствование современных методов визуализации позволило установить, что оно развивается в результате поражения всех структур сустава и, наряду с повреждением хряща, включает ремоделирование субхондральной кости, синовиальное воспаление и образование остеофитов. Следовательно, ОА можно рассматривать как сложный гетерогенный синдром с множественным поражением суставных тканей различной степени тяжести. Отчасти из-за этого очень сложно разработать единую «универсальную» терапию, которая могла бы быть эффективной для всех пациентов с ОА [8].
В настоящее время все фармакологические методы терапии ОА в целом направлены на модификацию симптомов болезни: с этой целью используются нестероидные противовоспалительные препараты (НПВП), анальгетики, внутрисуставные средства, такие как стероиды и гиалуроновая кислота [9]. Хирургическое лечение обычно показано только для пациентов с терминальной стадией ОА. Однако болевой синдром при этом заболевании зачастую не купируется; примерно от 30 до 40% больных не удовлетворены лечением [10, 11], что подчеркивает важность поиска новых эффективных методов терапии.
Основным патологическим процессом при ОА является прогрессирование заболевания, иными словами, ухудшение биологических, структурно-механических свойств и функции суставных тканей. Эффективное медикаментозное лечение должно обладать способностью замедлять эти процессы или даже полностью их останавливать. Фармакологические агенты, которые изменяют естественное прогрессирование заболевания, останавливая структурные изменения суставов и облегчая симптомы, либо уменьшая боль, либо же улучшая физическую функцию, называются «болезнь-модифицирующими препаратами для остеоартрита» (DMOAD). Эффективный DMOAD, как описано в опубликованном в 2018 г. проекте отраслевого руководства FDA по структурным конечным точкам для ОА, должен демонстрировать замедление потери ширины суставной щели коленного или тазобедренного сустава (ССЩ) на рентгенограмме с соответствующим клинически значимым симптоматическим улучшением [12].
Лечение этого сложного по механизму и течению заболевания требует проведения комплексной и практически постоянной терапии, воздействующей на основные звенья патогенеза и замедляющей прогрессию заболевания. Помимо этого, комплексная терапия, включающая нефармакологические и фармакологические методы, должна быть ориентирована на пациента с учетом его индивидуальных особенностей и течения ОА, что позволяет добиться высокой эффективности и безопасности лечения. В настоящее время приоритетными медикаментозными средствами считаются медленно действующие симптоматические препараты (SYSADOA), включенные в 2019 г. в рекомендации Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO) по лечению ОА коленных суставов в качестве препаратов первой линии; их следует назначать после установления диагноза ОА.
В 2021 г. на основании большого сетевого метаанализа Yang W. et al. эти препараты были впервые названы DMOAD (Disease-Modifying Osteoarthritis Drug; рис. 1). В приведенных исследованиях влияние препаратов на прогрессию ОА оценивалось по динамике сужения суставной щели (рентгенография) или объема суставного хряща (магнитно-резонансная томография) [13].
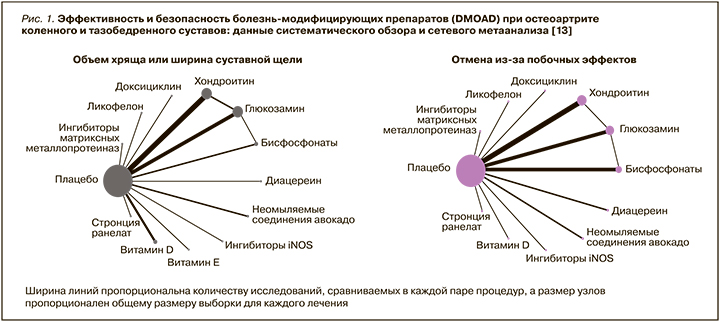
Группа SYSADOA включает пероральные, парентеральные и внутрисуставные лекарственные средства. Название этой группы, а именно «медленно действующие», отражает скорость развития их эффекта, который проявляется через 8–12 нед от начала лечения. Врач должен хорошо знать эту особенность данных препаратов и, главное, уметь объяснить больному, что необходимо «дождаться» эффекта при их применении. При этом, в отличие от быстро действующих препаратов, подобных НПВП, SYSADOA обладают выраженным последействием: иными словами, их действие продолжается еще в течение 2–3 мес после отмены, а это позволяет назначать их интермиттирующим курсом, что повышает комплаентность лечения и имеет некоторую экономическую выгоду.
Пероральные SYSADOA имеют низкую биодоступность, тогда как парентеральные формы, вводимые внутримышечно, не только увеличивают ее, но и позволяют достичь более быстрого эффекта. Один из таких препаратов – гликозаминогликан-пептидный комплекс (Румалон®), представляющий собой экстракт хряща и костного мозга телят. В состав препарата входят хондроитин-4-сульфат (64,5%), хондроитин-6-сульфат (16,5%), хондроитин (9,5%), дерматансульфат (3,4%), гиалуроновая кислота (2,1%) и кератансульфат (4,0%). Механизм действия гликозаминогликан-пептидного комплекса (ГПК) направлен на подавление воспаления и реализуется через ингибирование различных эффектов интерлейкина 1 (основного провоспалительного цитокина), активности протеолитических ферментов, подавление апоптоза хондроцитов. Кроме того, он обладает и анаболическим действием, увеличивая образование сульфатированных мукополисахаридов [14–18].
ГПК давно хорошо известен практикующим врачам, его эффективность подтверждена многими клиническими исследованиями. Наш опыт его применения тоже свидетельствует о наличии у препарата анальгетического и противовоспалительного действия, проявляющегося в уменьшении боли и улучшении функциональных способностей суставов; более того, после длительного применения ГПК в течение 3 лет были получены данные о его способности замедлять прогрессирование ОА [19].
В 2004 г. Altman R.D. также отметил доказанную эффективность ГПК при ОА [20]. Симптоматический эффект ГПК был выявлен в исследовании Adler Е. et al.: через 12 мес доля «ответчиков» (лиц с положительным ответом) на терапию ГПК составила 64,0%, тогда как на применение плацебо – 29,0% (p <0,05). В двух других длительных (2–3 года) плацебо-контролируемых исследованиях продемонстрировано достоверное снижение боли у больных, получавших ГПК, по сравнению с плацебо [21, 22]. Rejholec V. et al. доказали влияние ГПК на замедление прогрессии ОА, основываясь на результатах 16-летнего проспективного наблюдения за группой больных, получавших это лекарственное средство по 2 курса в год: в основной группе инвалидность получили только 11% больных, в то время как в контрольной – 71,0%, оперативное вмешательство по замене тазобедренного сустава было проведено 5 и 14 больным соответственно [23].
Относительно недавно А.Е. Каратеев с соавт. изучили эффективность ГПК у 115 больных ОА с болью в суставах ≥40 мм по визуальной аналоговой шкале (ВАШ) и с недостаточно эффективной предшествующей 6-месячной терапией пероральными SYSADOA и НПВП. Через 8 и 12 нед от начала лечения было выявлено позитивное влияние ГПК на все составляющие функционального индекса WOMAC. Около 80% больных оценили эффект лечения как «хороший» и «отличный». В конце исследования, через 12 нед, анальгетическое и противовоспалительное действие ГПК было подтверждено отменой и снижением дозы НПВП (31,7 и 32,4% соответственно) [24].
В патогенезе ОА большое значение принадлежит ожирению и связанным с ним различным метаболическим нарушениям. В условиях мультиморбидности, влекущей за собой полипрагмазию, особое внимание привлекают внимание препараты с плейотропным действием, в частности диацереин и его активный метаболит реин. Сигнальный путь NF-κB (ядерный фактор транскрипции κB) играет ключевую роль в процессе воспаления, поскольку его активация способствует высвобождению провоспалительных медиаторов, таких как индуцируемая синтаза оксида азота (iNOS) и фактор некроза опухоли альфа (ФНО-α). Gао Y. et al. обнаружили, что реин способен ингибировать активацию NF-κB и нижестоящего сигнала iNOS [25]. Кроме того, действие реина заключается в ингибировании активации интерлейкина-1 (ИЛ-1) и снижении числа рецепторов к ИЛ-1 на поверхности хондроцитов и синовиоцитов [26].
Существуют данные о положительном влиянии диацереина и его метаболита реина на некоторые метаболические заболевания, такие как ожирение, диабет, гиперлипидемия и неалкогольная жировая болезнь печени [27, 28]. Реин регулирует метаболизм глюкозы и липидов, подавляя всасывание холестерина, снижая синтез липопротеидов и уровень глюкозы [29].
Клиническая эффективность диацереина, по сравнению с плацебо и НПВП, подтверждена многими клиническими исследованиями и метаанализами. Обладая примерно равной эффективностью с НПВП, но отличным от них механизмом действия, этот препарат может быть альтернативой нестероидной противовоспалительной терапии при лечении ОА, особенно у больных, имеющих противопоказания к последней, так как не вызывает нежелательных явлений, присущих НПВП.
Недавнее международное многоцентровое двойное слепое сравнительное исследование целекоксиба и диацереина окончательно подтвердило его анальгетическую и противовоспалительную эффективность [30]. В 6-месячное исследование было включено 380 больных с ОА коленных суставов, половина из которых получала по 100 мг диацереина, остальные – 200 мг целекоксиба. К концу исследования показатели эффективности, а именно боль по WOMAC и число ответчиков по критериям OMERACT-OARSI, статистически не различались. Авторы заключили, что при умеренном и тяжелом ОА коленных суставов диацереин обладает равной эффективностью с целекоксибом по влиянию на боль, скованность и функцию суставов, а также хорошим профилем безопасности. Частота нежелательных явлений, связанных с приемом препаратов, была одинаково низкой, за исключением легкой или умеренной диареи (диацереин – 4,8%, целекоксиб – 1,6%), не потребовавшей отмены препарата.
В отдельных исследованиях представлены инструментальные данные по влиянию диацереина на синовит [31].
Структурно-модифицирующий эффект препарата при его хорошей переносимости был подтвержден в длительном трехгодичном исследовании [32]. Эксперты ESCEO в 2016 г. включили диацереин в группу базисных препаратов для лечения ОА, проанализировав накопившиеся данные о его эффективности.
Учитывая плейотропный механизм действия диацереина, мы изучили его эффективность при ОА коленных суставов в сочетании с метаболическим синдромом (МС) в условиях многоцентрового открытого исследования длительностью 9 мес. Наши результаты показали довольно быстрое, уже через 1 мес от начала лечения, развитие анальгетического действия диацереина: значимое снижение боли, скованности, улучшение функции суставов и качества жизни. При этом улучшение фиксировалось до конца лечения: доля «ответчиков» по критерию OMERACT-OARSI равнялась 92,5%, а полностью отказались от НПВП 64,2% пациентов. Эффективность препарата наблюдалась еще в течение 3 мес после его отмены. На фоне терапии мы отметили также достоверное снижение индекса массы тела (ИМТ), уровней липопротеидов низкой плотности, триглицеридов, глюкозы и мочевой кислоты, т.е. влияние препарата на некоторые компоненты МС [33].
Переносимость диацереина, как правило, хорошая. Единственное, относительно частое нежелательное явление на фоне его приема – либо размягчение стула, либо диарея: относительный риск ее развития составляет 3,51 (95% ДИ: 2,55–4,83) по сравнению с плацебо [34], а около 39% больных по сравнению с 12% на плацебо имеют один эпизод диареи или жидкого стула. Чаще всего диарея протекает легко, развивается в начале лечения и не требует отмены диацереина.
Наше исследование по изучению безопасности приема в течение 30 дней препарата Диафлекс (диацереин) в условиях реальной клинической практики, включившее 3479 пациентов с ОА и неспецифической болью в спине, показало, что умеренная диарея развилась только у 0,86% больных. В целом переносимость препарата была хорошей, а результат лечения как «хороший» или «отличный» оценили 76% пациентов [35].
Несмотря на позитивные результаты применения SYSADOA, часть больных остается не до конца удовлетворенной лечением своего заболевания. Отметим также, что остаточная боль фиксируется даже после радикальных хирургических вмешательств, в связи с чем постоянно ведется поиск новых подходов к лечению ОА: разрабатываются новые молекулы, новые пути доставки препаратов непосредственно к очагу поражения в суставе, применяются комбинированные методы лечения и т.д. Все препараты SYSADOA обладают симптом- и структурно-модифицирующими свойствами, однако механизмы действия этих препаратов могут отличаться друг от друга. С учетом этого совместное их использование может иметь некоторое преимущество перед монотерапией за счет аддитивного действия различных средств, как это наблюдается, например, при применении комбинации хондроитина и глюкозамина. Диацереин по механизму действия отличается от других препаратов этой группы, воздействуя на другие важные звенья патогенеза (рис. 2). Хорошо известно, что противовоспалительное действие хондроитина сульфата (основное действующее вещество препарата Румалон) связано с прямой ингибицией сигнального пути NF-κB, активация которого при любой локализации ОА приводит к избыточной продукции провоспалительных цитокинов, оксида азота, металлопротеиназ, расщепляющих основные молекулы матрикса суставного хряща. Диацереин тоже оказывает влияние на торможение активности сигнального пути NF-κB, но уже через связанные с ним сигнальные пути – киназы (МАРК/ERK), приводя к уменьшению продукции каспазы 1, которая, в свою очередь, влияет на превращение предшественника ИЛ-1β в его активную форму. На премембранном уровне диацереин уменьшает количество рецепторов к ИЛ-1 на поверхности клеток. Хондроитина сульфат и диацереин препятствуют развитию неоангиогенеза, который отчасти происходит под влиянием центрального цитокина при ОА – ИЛ-1β. Оба препарата обладают анаболическими свойствами, увеличивая экспрессию трансформирующего фактора роста фибробластов (TGF-b1), который способствует синтезу гиалуроновой кислоты и коллагена II.
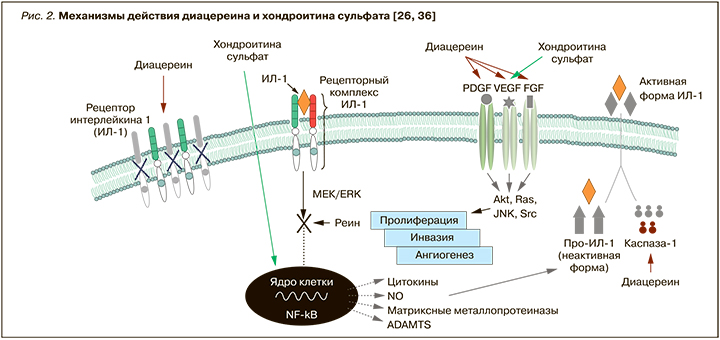
Именно поэтому мы предположили, что одновременное назначение препаратов Румалон и Диафлекс может быть перспективным с учетом возможного их аддитивного действия. Это и послужило основанием для проведения предлагаемого клинического исследования.
Цель исследования – оценить эффективность, переносимость и безопасность комплексной терапии препаратами Румалон и Диафлекс у пациентов с ОА коленных суставов по сравнению с монотерапией Румалоном.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 78 больных (71 женщина и 7 мужчин), из 6 субъектов России (Москва – 30 больных, Новосибирск – 10, Хабаровск – 10, Казань – 10, Ульяновск – 6, Санкт-Петербург – 12). Средний возраст пациентов составил 59,7±7,3 лет (от 45 до 74), средний ИМТ – 33±5,49 кг/м2, средняя продолжительность болезни – 8 лет (от 1 года до 30).
Критерии включения
1. Мужчины и женщины в возрасте 40–75 лет.
2. Установленный в соответствии с критериями Американского колледжа ревматологов (ACR) диагноз первичного тибиофеморального ОА, II или III рентгенологическая стадия по Kellgren–Lawrence.
3. Боль при ходьбе ≥40 мм по ВАШ.
4. Потребность в приеме НПВП (прием в течение 30 дней за последние 3 мес).
5. Подписанное информированное согласие.
Критерии невключения
1. Вторичный ОА коленных суставов: инфекционный артрит, системные воспалительные заболевания суставов, подагра, псевдоподагра, болезнь Педжета, внутрисуставные переломы, охроноз, акромегалия, гемохроматоз, болезнь Вильсона, первичный хондроматоз.
2. Внутрисуставное введение любых препаратов в течение 6 нед до начала исследования.
3. Асептический некроз мыщелков бедренной и большеберцовой костей.
4. Оперативные вмешательства на коленном суставе.
5. Известная повышенная чувствительность к компонентам препаратов.
6. Сопутствующие тяжелые заболевания (неконтролируемая артериальная гипертензия, нестабильная стенокардия, сердечно-сосудистая недостаточность, сахарный диабет (СД) 1-го типа, тяжелые заболевания печени и почек).
7. Язва желудка или двенадцатиперстной кишки в течение последнего месяца.
8. Беременность, период лактации.
9. В исследование не допускались пациенты, принимавшие препараты группы SYSADOA и прекратившие их прием менее чем за 3 мес до включения в программу.
Длительность исследования составила 10 мес: 8 мес – лечение и 2 мес – наблюдение, оценка эффекта последействия терапии.
Таким образом, в исследование вошли 78 больных с достоверным диагнозом ОА коленных суставов II–III стадий по Kellgren–Lawrence и болью в суставе >40 мм по ВАШ, которые были рандомизированно распределены в две группы:
- первая группа – 45 человек, одновременно получавших препараты Румалон и Диафлекс (комбинированная терапия, далее – КоТ) по стандартной схеме: Румалон – внутримышечно в дозе 0,3, 0,5 мл (первые две инъекции) и далее – 1 мл через день (на курс – 25 инъекций, повторный курс – через 6 мес); Диафлекс – 50 мг/сут в течение первого месяца, затем (в последующие 7 мес) по 50 мг 2 раза/сут;
- вторая группа – 33 человека, получавших только Румалон (монотерапия, далее – МоТ) по вышеуказанной схеме.
Исследование включало 6 визитов: V0 – визит скрининга; V1 – рандомизация; V2 – через 1 мес после начала терапии; V3 – через 2 мес от начала терапии (завершение первого курса терапии Румалоном при продолжающемся приеме Диафлекса в группе комбинированной терапии); V4 – через 6 мес (начало второго курса терапии препарата Румалон при продолжающемся приеме Диафлекса в группе комбинированной терапии); V5 – через 8 мес (окончание лечения и оценка эффективности проводимой терапии); V6 – через 10 мес (оценка последействия терапии).
Лабораторные исследования включали оценку аланинаминотрансферазы (АЛТ), аспарагинаминотрансферазы (АСТ), глюкозы, гликированного гемоглобина (НbА1c), холестерина, мочевой кислоты. На визитах V1, V3 и V5 определялся уровень С-реактивного белка (СРБ).
В рамках инструментального исследования на визитах V1 и V5 пациентам выполнялось ультразвуковое исследование (УЗИ) целевого коленного сустава.
Безопасность терапии оценивалась по частоте возникновения и виду неблагоприятных реакций (НР), а также по клинически значимым отклонениям лабораторных параметров.
Сопутствующая терапия во время исследования включала прием пациентами НПВП.
В течение исследования не допускалось:
- применение внутрисуставных инъекций глюкокортикоидов, препаратов гиалуроновой кислоты и любых других препаратов для внутрисуставного введения;
- применение препаратов, обладающих «хондропротективными» свойствами;
- физиолечение.
Показатели эффективности проводимого лечения
1. Боль по ВАШ.
2. Динамика индекса WOMAC (боль, скованность и функциональная недостаточность), изменение индекса в процентах относительно начального визита и относительно предыдущего визита.
3. Опросник качества жизни EQ-5D.
4. Общее состояние здоровья.
5. Ответ на терапию по критерию OMERACT-OARSI.
6. Оценка эффективности терапии врачом и пациентом.
7. Динамика суточной потребности в НПВП.
Статистическая обработка данных осуществлялась с применением программы STATISTICA 10 (StatSoft, США). Проводились анализ на нормальность распределения переменных с помощью теста Колмогорова–Смирнова, Шапиро–Уилка, частотный анализ. Использовались методы описательной статистики с вычислением минимальных, максимальных и средних значений переменных, стандартных отклонений, медианы, интерквартильного размаха [25-й, 75-й перцентили], параметрические (t-теста Стьюдента) и непараметрические (тест Вилкоксона, χ2) критерии. Для выявления взаимной зависимости между переменными выполнялся корреляционный анализ по Спирмену. Для анализа отношений вероятности в группах рассчитывался относительный риск (ОР) и его доверительные интервалы (ДИ). Для сравнения показателя в динамике использовался дисперсионный анализ (One Way ANOVA), метод множественных сравнений Шеффе или тест Краскела–Уоллеса. Различия считались достоверными при р <0,05.
РЕЗУЛЬТАТЫ
Пациенты в обеих группах исследования не имели значимых различий по возрасту (комбинированная терапия (КоТ) – 59,8±3,2 лет, монотерапия (МоТ) – 60,1±4,7 лет), ИМТ (31,5±6,3 и 30,1±5,2 кг/м² соответственно) и длительности ОА (8,2±5,5 и 9,3 ±5,8 лет соответственно). У подавляющего числа больных в обеих группах определялась II стадия ОА коленных суставов по Kellgren–Lawrence (КоТ – 87,3%, МоТ – 86,4%), у остальных– III стадия (КоТ – 12,7%, МоТ – 13,6%). Практически у всех пациентов с ОА были зафиксированы разные сопутствующие заболевания. Среди них наиболее часто встречались гипертоническая болезнь (60,0%), заболевания желудочно-кишечного тракта (19,2%), СД 2-го типа (11,6%), дислипидемии (6,4%), бронхиальная астма (3,9%), заболевания щитовидной железы (3,9%). Все больные до включения в исследование получали различные НПВП, чаще всего это были препараты мелоксикама (78,2%) и нимесулида (36,8%).
Пациенты, вошедшие в группу комбинированного лечения, в начале исследования имели более выраженный болевой синдром по ВАШ (60,0±14,3) по сравнению с группой монотерапии (52,0±10,00; p <0,03)
Результаты исследования продемонстрировали выраженное влияние КоТ и МоТ на уменьшение боли в коленных суставах по ВАШ уже через месяц с момента начала терапии (V2). Снижение боли наблюдалось на каждом визите, на протяжении всей 6-месячной терапии в обеих группах. При этом межгрупповых различий выявлено не было. В то же время динамика боли по WOMAC показала, что при использовании комбинации Румалона и Диафлекса достоверное уменьшение боли по сравнению с первоначальной выявлялось уже на 3-м визите, тогда как в группе, получавшей только Румалон, различия выявлялись только к 5-му визиту.
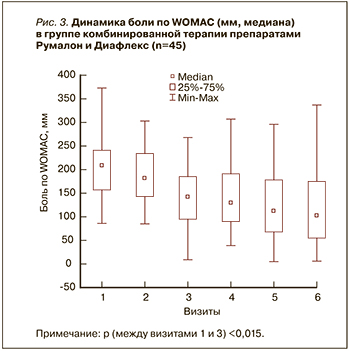
Так, в начале комбинированной терапии боль в суставах по WOMAC составляла 198 (160–280) мм, через 1 мес – 169 (127–247) мм, через 3 мес – 127 (79–221) мм, в конце терапии – 110 (34–204) мм. После отмены препаратов Румалон и Диафлекс еще в течение 2 мес (период наблюдения) болевой синдром не нарастал (84 (33–187) мм), что свидетельствует о выраженном последействии применявшейся комбинации (рис. 3).
В начале монотерапии препаратом Румалон боль в суставах по WOMAC составила 209 (157–241) мм, через 1 мес – 182 (143–234) мм, через 3 мес – 142 (92–185) мм, в конце терапии – 112 (68–178) мм. После отмены препарата через 2 мес наблюдения боль не нарастала (103 (55–175) мм), что тоже свидетельствует о наличии у Румалона эффекта последействия (рис. 4).
При анализе скованности и функциональной недостаточности по WOMAC межгрупповых различий не наблюдалось. Достоверное снижение суммарного индекса WOMAC было отмечено на 3-м визите в обеих группах (p <0,01 и p <0,02 соответственно). Эти данные указывают на хороший симптоматический эффект как комбинированной терапии, так и монотерапии Румалоном.
Статистически значимое улучшение качества жизни по EQ-5D (рис. 5) было выявлено только в группе КоТ на 5-м визите по сравнению с данными первого визита: V1 – 0,52 (0,52–0,59), V2 – 0,59 (0,52–0,59), V3 – 0,59 (0,52–0,59), V4 – 0,59 (0,52–0,69), V5 – 0,59 (0,52–0,73).
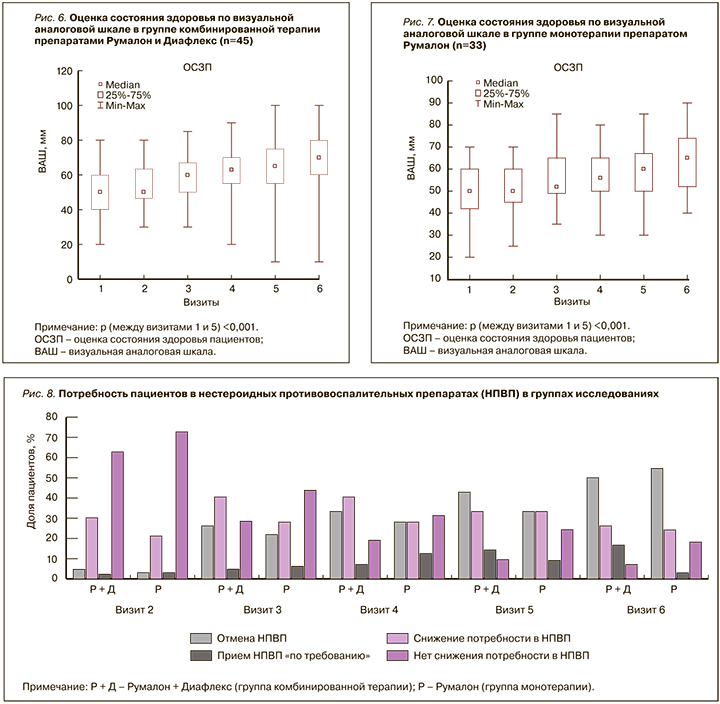
Оценка общего состояния здоровья (по ВАШ) показала статистически значимое улучшение состояния пациентов в группе комбинированного лечения: в начале исследования этот показатель составил 50 (40–60) мм, на 5-м визите (V5) – 65 (55–75) мм (рис. 6). В группе монотерапии в начале лечения общее состояния здоровья (по ВАШ) оценивалось в 50 (42– 60) мм, а на 6-м визите – 65 (52–74) мм (рис. 7).
Наличие анальгетического и противовоспалительного действия у комбинированной и монотерапии подтверждалось снижением суточной потребности в НПВП. Если в начале терапии почти все пациенты принимали НПВП постоянно, то к концу лечения 42,9% больных в группе КоТ смогли полностью отказаться от их приема и только 9,5% продолжили их принимать. В группе МоТ аналогичные показатели составили 33,3 и 24,3% соответственно (рис. 8). Таким образом, эти результаты говорят о большем анальгетическом и противовоспалительном эффекте комбинированного применения Румалона и Диафлекса.
Результаты оценки эффективности лечения, по мнению пациентов и врачей, в группах исследования были похожими. К концу лечения «значительное улучшение» и «улучшение» отметили 95,3% больных на комбинированной терапии и 90,8% больных на Румалоне, тогда как через 2 мес наблюдения – 90,6 и 81,7% соответственно. Это тоже подтверждает наличие эффекта последействия исследуемых препаратов. Отсутствие эффекта или ухудшение было зафиксировано лишь в единичных случаях.
Хороший ответ на лечение по критерию OMERACT-OARSI отмечался в обеих группах, однако число «ответчиков» в конце было значимо больше в группе комбинированного лечения (ОР=1,76; 95% ДИ: 0,98–3,16; р=0,04).
Очень интересные данные были получены по динамике синовитов, определяемых с помощью УЗИ. На первом визите межгрупповых отличий не было, но на последнем наблюдалось значимое (почти в 2 раза) снижение риска выявления пациентов с синовитом в группе комбинированного лечения (ОР=0,51; 95%ДИ: 0,28–0,92; р=0,04). Это говорит о более выраженном влиянии комбинированной терапии на синовит, что очень важно в реальной клинической практике.
Во время лечения ни у одного пациента не отмечалось клинически значимых отклонений изучаемых биохимических параметров, что свидетельствует о безопасности комбинированной терапии и монотерапии в нашем исследовании. При этом межгрупповых различий по лабораторным данным мы не получили, что, по-видимому, объясняется малочисленностью выборок (возможно, нужны большие группы больных).
Переносимость терапии в целом была хорошая. НР были выявлены у 4 больных на комбинированном лечении. У одной пациентки имела место диарея 5–6 раз в день, через 7 дней стул восстановился, и больная продолжила участие в исследовании. Другая пациентка выбыла из исследования из-за развития отечности суставов рук, прошедшей на 12-е сутки; по мнению врача, связь этого НР с препаратами возможная, хотя больная принимала и НПВП. У третьей пациентки развился тромбофлебит, разрешившийся через 2 нед, после чего лечение было продолжено. Наконец, еще у одной больной наблюдалось повышение артериального давления. Отметим, что 2 последних НР были не связаны с исследуемыми препаратами.
В группе, получавшей Румалон, было зафиксировано только 1 нежелательное явление, не связанное с приемом препарата: небольшая тошнота, которая самостоятельно прошла в течение 2 дней.
ОБСУЖДЕНИЕ
В настоящее время признана большая роль SYSADOA в терапии ОА: получены доказательства не только симптоматической эффективности этих препаратов, но и накоплен значительный опыт их применения в качестве структурно-модифицирующих средств. В последние годы с созданием клинических рекомендаций по лечению ОА определена тактика назначения SYSADOA. Они отнесены к препаратам первой линии, т.е. при установлении диагноза ОА должны назначаться практически любому больному с этим заболеванием.
Вместе с тем исследования по удовлетворенности больных ОА лечением дают неутешительные результаты: около 30% пациентов полностью не удовлетворены существующими схемами терапии. Одной из причин такого положения является несоблюдение врачами в реальной клинической практике рекомендаций по лечению ОА. Профессор Conagham G. провел исследование в Европе для выяснения, что предпочитают назначать врачи больным с ОА [37]. Оказалось, что на первом месте, как и много лет назад, стоят анальгетики, НПВП, опиоиды, в то время как SYSADOA назначаются менее 10% больных. Возможно, это обусловлено противоположными взглядами в различных рекомендациях, особенно европейских и американских, на эффективность этих препаратов. Тем не менее существует и постоянно пополняется доказательная база для этих препаратов, причем не только по их симптоматическим, но и структурно-модифицирующим свойствам; соответствующие данные получены с помощью и рентгенографических исследований, и других высокочувствительных инструментальных методов (магнитно-резонансная терапия, компьютерная томография и др.). При этом, справедливости ради, следует отметить, что SYSADOA, конечно, не обладают 100%-ной эффективностью, как, впрочем, и многие другие лекарства. Углубление наших знаний о патогенезе ОА привело к созданию многих новых молекул для лечения этого заболевания, но даже высокотехнологичные препараты пока не продемонстрировали успехов в лечении этого заболевания. Безусловно, существует множество причин такого положения дел. Это высокая гетерогенность не только самого заболевания, но и болевого синдрома (главного клинического признака ОА), отсутствие достижимых оцениваемых конечных точек заболевания, неточно определенные критерии оценки эффективности лекарственных препаратов и др.
Сегодня мы живем в условиях мультиморбидности, когда нам приходиться учитывать не только особенности самой болезни, но и индивидуальные характеристики больного, факторы внешней среды, в которой он живет, его предпочтения и возможности, особенно в экономическом плане. В связи с этим мы все время возвращаемся к уже знакомым нам препаратам, изучение которых открывает новые механизмы их действия, направленные не только на ОА, но и сопутствующую ему патологию, а также к средствам с самой высокой безопасностью среди всех лекарств для лечения ОА. Становится хорошо известным плейотропный механизм действия SYSADOA, и это касается абсолютно любого препарата из этой группы: высокая кардиобезопасность, влияние на атерогенез, различные метаболические нарушения и даже на микробиоту, поэтому мы все время возвращаемся к этим препаратам, стараясь придумать новые методы их использования.
В данной работе мы проверяли гипотетическую возможность аддитивного действия двух хорошо известных и отлично себя зарекомендовавших препаратов – Румалона и Диафлекса. Они обладают симптоматической эффективностью и способны при длительном приеме замедлять прогрессию ОА. Изучение этих препаратов у коморбидных больных выявило их влияние не только на ОА, но и сопутствующие заболевания. Это их качество чрезвычайно важно, особенно в условиях полипрагмазии, сопровождающей мультиморбидность. В проведенной работе удалось еще раз подтвердить влияние Румалона и Диафлекса на боль, которое является примерно равным для этих препаратов, когда боль оценивается при движении. В то же время на фоне комбинированного лечения наблюдалось несколько более быстрое, по сравнению с монотерапией, действие при оценке динамики боли по индексу WOMAC, который оценивает боль по 5 параметрам, включая некоторые функции организма. А вот влияние исследуемых препаратов на скованность, функцию суставов оказалось одинаковым, что еще раз указывает на их эффективность при ОА.
Оценка влияния комбинированной терапии по сравнению с монотерапией на качество жизни (как по опроснику EQ-5D, так и в соответствии с оценкой состояния здоровья по ВАШ) тоже выявило небольшое преимущество комбинированного применения Диафлекса с Румалоном. Показательны и высокие результаты оценки эффекта лечения по OMERACT-OARSI и по мнению врача и больного; это подтверждают данные об отмене НПВП на фоне обеих схем назначения препаратов. Но, пожалуй, самое интересное заключается в выраженной способности комбинации Диафлекс + Румалон влиять на синовит в коленном суставе: риск его выявления при таком лечении снизился в 2 раза по сравнению с монотерапией, что чрезвычайно важно, поскольку синовит ассоциируется с интенсивностью боли и более быстрой прогрессией заболевания.
Наряду с прочим мы опять подтвердили высокую безопасность Диафлекса, Румалона и их комбинации. Отсутствие динамики лабораторных показателей, отражающих метаболические нарушения в организме, которые мы выявляли в более ранних наших работах, вероятно, связано с небольшими выборками больных. Для уточнения этого аспекта требуются более обширные и длительные исследования.
ЗАКЛЮЧЕНИЕ
В многоцентровом российском рандомизированном исследовании еще раз подтверждено позитивное влияние комбинированного применения препаратов Диафлекс и Румалон и монотерапии Румалоном на симптомы ОА (уменьшение болевого синдрома, улучшение качества жизни больных с ОА коленных суставов) при их высокой безопасности, а также наличие у этих препаратов эффекта последействия. Выявлено преимущество комбинированной терапии в скорости наступления анальгетического эффекта, влиянии на синовит коленного сустава и большем снижении суточной потребности в НПВП.



