ВВЕДЕНИЕ
Поразившая весь мир в конце 2019 г. и продолжающая до сих пор новая коронавирусная инфекция COVID-19, приведшая к колоссальным жертвам и, по-видимому, все еще далекая от завершения, первоначально характеризовалась развитием тяжелой пневмонии у 10–15% пациентов (преимущественно старшей возрастной группы) с высокой температурой тела, сильным сухим кашлем, одышкой и затрудненным дыханием [1–3]. Все это приводило к острому респираторному дистресс-синдрому (ОРДС) и часто заканчивалось летальным исходом [2–4]. К осени 2021 г. в мире от этой инфекции умерли почти 5 млн человек.
То, что первым и наиболее выраженным проявлением болезни выступает пневмония, вполне естественно, поскольку вызывающий заболевание РНК-вирус SARS-CoV-2 так же, как и его предшественник – вирус SARS-CoV-1, вызвавший в 2002–2003 гг. эпидемию атипичной пневмонии, попадая в нижние отделы легких, связывается с рецептором ангиотензинпревращающего фермента 2 типа (АПФ2) [1, 5]. Этот рецептор обильно экспрессирован на мембранах альвеоцитов, и взаимодействие с ним вируса вызывает повреждение терминальных бронхиол и альвеол, которые заполняются жидкостью с формированием в них гиалиновых мембран. В результате нарушается механизм газообмена в легких, что в ряде случаев ведет к смерти от гипоксии.
С течением времени и по мере увеличения числа заболевших стало понятно, что вирус SARS-CoV-2 поражает не только легкие, но и другие органы [6]. Так, значительно страдает сердечно-сосудистая система, дисфункция которой проявляется в виде острых инфарктов миокарда, инсультов, миокардитов, перикардитов и жизнеугрожающих нарушений сердечного ритма [7–10]. Кроме этого, при COVID-19 повреждаются органы желудочно-кишечного тракта [11–13], включая печень [14], система выделения [15 17], наблюдаются выраженные поражения нервной системы [18–21]. В целом можно говорить, что вирус повреждает практически все органы.
Механизм, трансформирующий легочную инфекцию в полиорганную недостаточность, состоит в следующем: SARS-CoV-2, пройдя через альвеолярно-капиллярную мембрану, попадает в легочное сосудистое русло и распространяется током крови по организму, вовлекая в воспалительный процесс практически все органы и ткани, поскольку рецепторы к АПФ2 представлены на многих клетках, в том числе на эндотелиоцитах всех сосудов. Разрушая сосудистый эндотелий, вирус провоцирует воспаление, стимулирует развитие «цитокинового шторма», также повреждающего эндотелий сосудов и усиливающего дальнейшее развитие воспалительной реакции. Поражение эндотелия приводит к нарушениям в системе гемостаза, коагулопатии, развитию системного васкулита или, более конкретно, эндотелиита. В результате происходит образование тромбов, нарушающих нормальное кровоснабжение органов, что в конечном итоге провоцирует развитие полиорганной недостаточности [22–24]. Некоторые исследователи полагают, что для тяжелых случаев COVID-19 характерна клиническая картина диссеминированного внутрисосудистого свертывания крови [25].
Очень большое значение имеет и то обстоятельство, что даже у пациентов, перенесших COVID- 19 в легкой форме, часто имеют место длительно сохраняющиеся серьезные последствия заболевания, которые проявляются поражением различных систем организма (постковидный синдром, или лонг-ковид). Это дает основание предполагать, что острый COVID-19 вполне может трансформироваться в хроническое поражение различных органов.
С сожалением приходится констатировать, что, несмотря на активные форсированные исследования, до сегодняшнего дня не создано патогенетических препаратов для лечения этой инфекции, и единственным средством борьбы с ней остается своевременная вакцинация.
Из сказанного выше ясно, что именно повреждение эндотелия – основной фактор, дающий вирусу возможность повреждать органы и нарушать систему гемостаза [22–24]. Соответственно искать патогенетическую терапию следует не только среди препаратов, способных непосредственно уничтожать вирус или подавлять его репликацию, но и среди средств, защищающих сосудистый эндотелий. Из эндотелиопротекторов наиболее перспективным нам представляется препарат сулодексид (производитель – «АльфаСигма», торговое название – Вессел Дуэ Ф).
Сулодексид – препарат, получаемый из слизистой оболочки тонкого кишечника свиней, который представляет собой естественную смесь быстродвижущейся гепариноподобной фракции (80%) и дерматан сульфата (20%). Сулодексид способен защищать гликокаликс (слой протеогликанов, покрывающих обращенную в просвет сосуда поверхность эндотелия), благодаря чему предохраняет эндотелий от повреждающих воздействий и восстанавливает его целостность [26–27]. Помимо этого, он обладает антикоагулянтным, антиагрегантным, антитромботическим и ангиопротекторным действием [28]. Препарат подавляет активность фактора Х свертывания, усиливает синтез и секрецию простациклина (простагландина PgI2), уменьшает концентрацию фибриногена в плазме. Также сулодексид повышает концентрацию активатора тканевого фактора и снижает концентрацию в крови его ингибитора.
Обладая такими свойствами, сулодексид должен препятствовать развитию повреждения эндотелия при COVID-19 и, как следствие, тормозить развитие воспаления и коагулопатии. С целью убедиться в этом мы осуществили электронно-микроскопическое исследование образцов крови больных COVID-19, в схему лечения которых добавляли сулодексид.
МАТЕРИАЛ И МЕТОДЫ
В одноцентровое проспективное наблюдательное исследование вошли 28 пациентов с подтвержденным методом полимеразной цепной реакции (ПЦР) диагнозом COVID-19, проходивших лечение с 25.05.2020 по 22.07.2020 в Центральной клинической больнице с поликлиникой Управления делами Президента РФ (Москва). В исследование включали только тех больных, тяжесть состояния которых при поступлении оценивалась (по данным компьютерной томографии легких и оксиметрии) как средняя. Интервал от момента появления первых симптомов заболевания до госпитализации больных составлял от 1 до 11 дней (5,9±0,8 дней), среднее время пребывания в больнице равнялось 11,6±0,4 дням. Характеристика пациентов, включенных в исследование, отражена в таблице 1.
У всех пациентов при поступлении определяли основные антропометрические параметры, температуру тела, состояние гемодинамики (частоту сердечных сокращений, артериальное давление), дыхательную функцию (частоту дыхательных движений, SpO2) и регистрировали электрокардиограмму (ЭКГ). Клинические лабораторные анализы включали основные биохимические показатели (ферменты печени, креатинин, рН, лактат), факторы воспаления (С-реактивный белок, скорость оседания эритроцитов, фибриноген, интерлейкин 6, ферритин, прокальцитонин), коагулологические параметры (Д-димер, активированное частичное тромбопластиновое время, протромбиновое время, анти Ха).
Лечение больных осуществляли, используя противовирусные препараты (фавипиравир, гидроксихлорахин), ингибиторы активности провоспалительных цитокинов (тоцилизумаб, левилимаб, олокизумаб), кислород. Всем пациентам для предотвращения тромбообразования вводили подкожно низкомолекулярный гепарин (эноксапарин): 2 больным (с низкой массой тела) – в профилактической дозе (0,4 мл), 26 – в промежуточной (0,6 мл) или в лечебной (0,8 мл) дозе.
В экспериментальной группе 14 пациентам дополнительно к рекомендованной терапии в течение 10 дней внутривенно вводили сулодексид – 2 мл (600 Ед) в сутки. Остальные 14 пациентов получали аналогичное лечение, но без сулодексида; они сформировали контрольную группу.
При поступлении у всех больных из кубитальной вены забирали кровь для клинических анализов и отдельно – 0,5 мл крови в пробирки с 3,2% цитратом натрия для последующей электронной микроскопии. Далее, в ходе лечения, у пациентов ежедневно регистрировали параметры, характеризующие функцию сердечно-сосудистой и дыхательной систем, и не реже одного раза в три дня повторяли забор крови для проведения клинических анализов.
Спустя 10 дней активного лечения у всех больных вновь брали 0,5 мл крови для электронной микроскопии. Результаты анализов больных, получавших сулодексид, сравнивали с данными, полученными у контрольной группы, которая получала такое же базовое лечение, но без сулодексида.
Все пациенты дали письменное информированное согласие на участие в исследовании в соответствии с этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации. Протокол исследования был одобрен локальным этическим комитетом Центральной клинической больницы с поликлиникой Управления делами Президента РФ.
Кровь для электронно-микроскопического исследования брали в пробирки VACUETTE (Greiner Bio-One, Австрия), содержащие 3,2% раствор цитрата натрия (соотношение объема крови к антикоагулянту 9:1) и готовили препарат для сканирующей электронной микроскопии. Подробно приготовление препарата описано в работах Бурячковской Л.И. с соавт. (2021) [29] и Melkumyants A. et al. (2022) [30]. Если говорить вкратце, то 20 мкл верхнего слоя крови после отстоя в течение 20 мин при комнатной температуре фиксировали в 2,5% глутаровом альдегиде, наносили на поликарбонатный фильтр с порами диаметром 0,4 мкм и проводили стандартную промывку и обезвоживание образцов. Использованный нами подход позволял максимально сохранить все клетки, содержащиеся в крови, и совершить подсчет их количества в заданном объеме. Для просмотра вырезали сегмент 1/4 фильтра, на котором осаждались клетки из объема 5 мкл крови. В каждом образце подсчитывали клетки крови и циркулирующие эндотелиальные клетки (ЦЭК). Исследование выполняли на сканирующем электронном микроскопе Inspect F50 FEI с ЭДС-анализатором Oxford X-Max 80. Количество клеток крови подсчитывали на 100 расположенных на фильтре квадратах размерами 10×10 мкм.
Статистическая обработка результатов
Все количественные данные представлены в виде среднее + средняя ошибка среднего (s+m). Качественные данные представлены в процентах, достоверность их различия определялась с помощью теста хи-квадрат. Поскольку особый интерес для нас представляли различия в значениях параметров у пациентов, получавших сулодексид, и больных контрольной группы, значения, регистрируемые перед первым днем терапии и после 10-го дня, сравнивали с использованием двустороннего непараметрического теста Манна–Уитни. Достоверным считали различие при p <0,05. Статистические данные представлены в виде сравнения величин, регистрировавшихся при поступлении больных в клинику и после 10-дневной терапии с применением сулодексида или без него.
РЕЗУЛЬТАТЫ
За время госпитализации ни один больной не был переведен в реанимацию, и никому не потребовалась респираторная поддержка. Ни у одного пациента, получавшего в дополнение к антикоагулянту сулодексид, не наблюдалось никаких признаков какого-либо (даже несущественного) кровотечения.
Основные данные измерений и лабораторных анализов крови, регистрировавшиеся при поступлении больных в клинику и перед их выпиской после окончания терапии, представлены в таблице 2.
Как видно из приведенных в таблице 2 данных, сулодексид оказывал эффект только в отношении уровня С-реактивного белка (СРБ), который уменьшался достоверно быстрее у получавших этот препарат больных, нежели у участников из контрольной группы. Также обращает на себя внимание влияние сулодексида на уровень Д-димера. Хотя нами и не было получено достоверного различия по этому показателю между больными двух групп, однако тенденция более значимого уменьшения уровня Д-димера на фоне добавления сулодексида очевидна. Изменение всех остальных биохимических параметров в обеих группах были практически одинаковы (сравнение изменений всех параметров, кроме СРБ и Д-димера дает величину р не меньше 0,3).
Совершенно иначе выглядит сравнение результатов, полученных при анализе клеток крови с помощью электронной микроскопии.
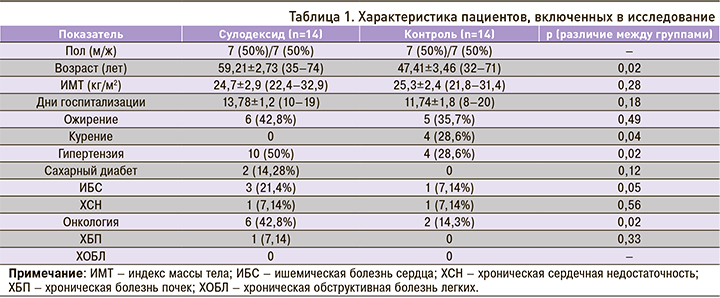
1. ЦЭК. У здоровых лиц концентрация ЦЭК обычно не превосходит 3 клеток в 1 мл крови [31]. В нашем исследовании до начала лечения в группе сулодексида ЦЭК в среднем составляли 2,21±0,29 клеток на 1/4 фильтра (от 1 до 7 клеток), а в контрольной группе – 2,02±0,31 (от 1 до 6 клеток). Если учесть, что одна четверть фильтра содержит 5 мкл крови, то при поступлении в больницу концентрация ЦЭК в крови пациентов из группы сулодексида в среднем равнялось 442±58 клеток/ мл. После 10 дней терапии, включавшей сулодексид, количество ЦЭК на 1/4 фильтра достоверно (р=0,006) уменьшилось до 1,34±0,28 клеток (от 0 до 3), т.е. в среднем до 268±56 клеток/мл. В контрольной группе количество ЦЭК на фильтре, напротив, увеличилось (хотя и недостоверно, р=0,28) до 2,36±0,34 (от 1 до 6 клеток), т.е. среднее значение этого показателя выросло с 404±62 до 472±68 клеток/ мл. Эффект сулодексида на содержание ЦЭК в единице объема крови и морфологию клеток, выявленный методом электронной микроскопии, отражен на рисунке 1 (А, Б).
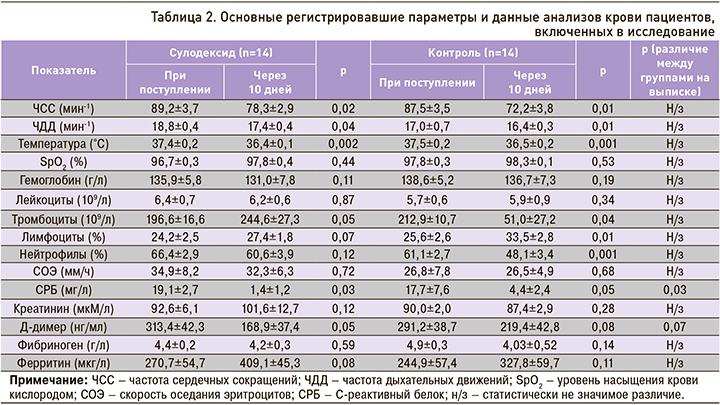
2. Эритроцитарные агрегаты (сладжи). В крови больных обеих групп как при поступлении, так и спустя 10 дней отчетливо проявлялись длинные эритроцитарные монетные столбики (сладжи), состоящие из агрегировавших (склеившихся) эритроцитов (рис. 2, Б). Число агрегировавших эритроцитов, образующих сладж, у пациентов при поступлении в клинику находилось в диапазоне от 3 до 12 клеток, а через 10 дней терапии не превосходило 5 клеток. Число сладжей в группе сулодексида до начала лечения составляло 5,75±1,69 в образце просмотра, в контрольной группе – 4,82±1,14. Спустя 10 дней число сладжей в группе сулодексида достоверно (р=0,03) и значительно уменьшилось до 2,42±0,98, тогда как в контрольной группе оно снизилось незначительно и недостоверно (р=0,67) – до 3,98±0,91 (рис. 2, А).
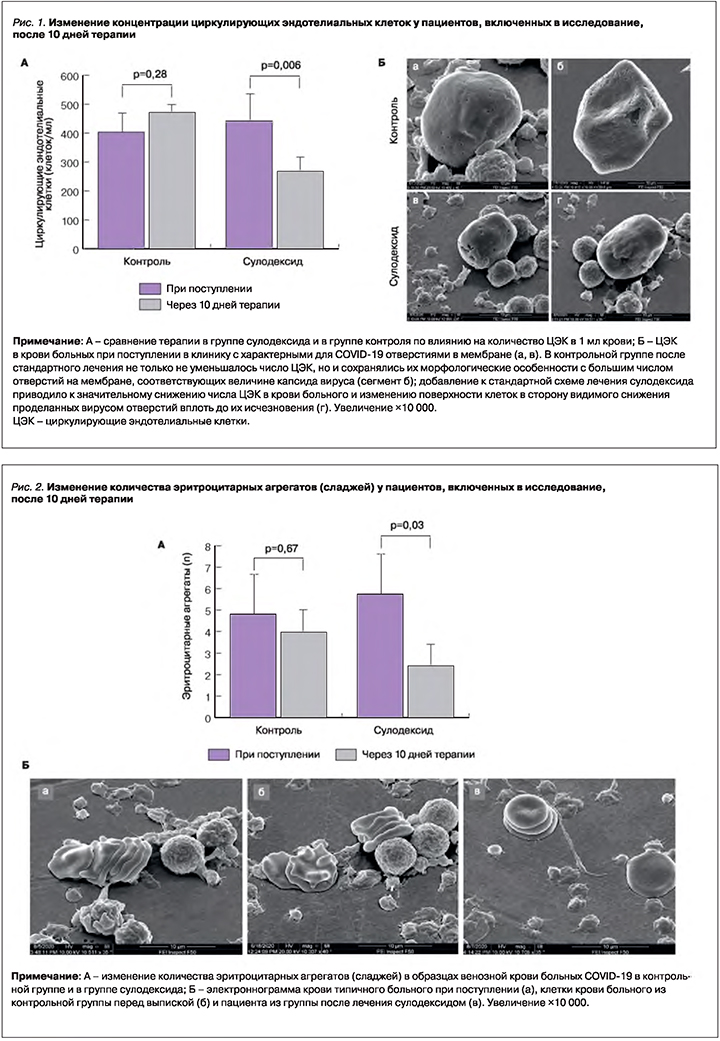
3. Активированные тромбоциты. Кровяные пластинки – тромбоциты – при активации приобретают сферическую форму и способны образовывать микроагрегаты, что позволяет при микроскопии различать активированные и неактивированные покоящиеся дисковидные клетки. В группе пациентов, получавших сулодексид, процент активированных тромбоцитов в течение 10 дней практически не изменился: 42,69±5,96% при поступлении и 38,16±3,79% после окончания терапии (р=0,22). В то же время в контрольной группе в течение 10-дневной терапии (без сулодексида) этот показатель достоверно увеличился с 36,65±4,59 до 45,38±5,65% (р=0,04). Результаты изменения концентрации активированных тромбоцитов представлены на рисунке 3 А, Б.
4. Гетероклеточные агрегаты. Увеличение количества активированных тромбоцитов в крови больных из контрольной группы не могло не привести к повышению числа эритроцитарно-тромбоцитарных агрегатов (ЭТА). Если среди пациентов, получавших сулодексид, этот параметр за 10 сут практически не изменился (28,83±4,32 против 23,25±3,54; р=0,36), то в контролеконцентрация ЭТА достоверно увеличилась (с 23,23±4,39 до 38,45±3,6; р=0,04).
Содержание в крови лейкоцитарно-тромбоцитарных агрегатов и эхиноцитов в контрольной группе и среди пациентов, получавших сулодексид, изменялось в течение 10-дневной терапии недостоверно (р >0,3).
ОБСУЖДЕНИЕ
Как мы отмечали во введении, первоначально все внимание, связанное с новой коронавирусной инфекцией, было сосредоточено на состоянии легочной системы, поскольку тяжелая пневмония была абсолютно доминирующим симптомом этого заболевания. Однако после того, как выяснилось, что при COVID-19 поражаться могут практически все системы организма, стало понятно, что вирус SARS-CoV-2 проникает в организм по сосудистой сети, и при этом важнейшую роль в процессе повреждения органов играет сосудистый эндотелий.
Если до 1980 г. монослой клеток эндотелия, покрывающий все контактирующие с кровью поверхности сосудов, рассматривали исключительно как структуру, обеспечивающую гемостаз, то, начиная с классической работы Furchgott R.F. et Zawadszki J.V. (1980) [32], продемонстрировавших эндотелий-зависимую регуляцию тонуса сосудистых гладких мышц, представление о роли эндотелия в функционировании сосудистой системы значительно расширилось. Было установлено, что, помимо гемостатической функции, эндотелий играет важнейшую роль в регуляции гидравлического сопротивления сосудов и в осуществлении иммунных реакций [33]. Последнее связано с тем, что эндотелиоциты как первый барьер на пути большинства вирусов [34] обеспечивают активную иммунную защиту, часто сопровождающуюся «цитокиновым штормом» [35]. К таким состояниям относится и COVID-19.
Поскольку рецептор АПФ2, с которым связывается вирус SARS-CoV-2, экспрессируется на эндотелиоцитах практически всех сосудов, легко понять, как попавший в кровоток вирус инфицирует органы, прикрепляясь к эндотелиальным клеткам и проникая в них. После того как SARS-CoV-2 реплицируется в эндотелиальных клетках, погибшие эндотелиоциты отделяются от стенки сосуда, оголяя тромбогенную и провоспалительную субэндотелиальную поверхность, что, в свою очередь, приводит к развитию коагулопатии, периваскулярному воспалению, отеку тканей и прокоагулянтному состоянию.
Между тем, хотя утверждение о том, что именно монослой эндотелиоцитов служит «границей» между кровью и сосудистой стенкой, является общепринятым, оно не верно. Дело в том, что у эндотелия есть свой защитный слой: это производимый самим эндотелием внеклеточный матрикс – гликокаликс (ГК). Он представляет собой слой макромолекул, состоящий из протеогликанов, гликозаминогликанов, гликопротеинов и гликолипидов. Гликокаликс покрывает люминальную (обращенную в просвет сосуда) поверхность эндотелиальных клеток [36, 37], обеспечивая в комбинации с эндотелием гомеостаз сосудистой сети: они регулируют проницаемость и тонус сосудов, предотвращают возникновение микрососудистого тромбоза и подавляют адгезию лейкоцитов и тромбоцитов. Разрушение гликокаликса вызывает дисфункцию эндотелия [38, 39], развитие отека вследствие нарушения проницаемости капилляров, воспаление сосудистой стенки и, наконец, гиперкоагуляцию и парез регуляции сосудистого тонуса.
Известно, что эндотелиальный гликокаликс разрушается при многих патологических состояниях; в частности, его повреждение вызывают вирусы [34, 40]. Особенно выражено повреждение гликокаликса при сепсисе [41]. Также обнаружено, что повреждение эндотелиального гликокаликса является обязательным фактором при COVID-19 [42]. С учетом этих данных вполне естественной попыткой противодействовать разрушительному действию вируса SARS-CoV-2 видится поиск способа предохранить гликокаликс от разрушения, что, в свою очередь, предупредит повреждение эндотелиальных клеток и следующее за этим нарушение гемостаза.
Наиболее перспективным способом борьбы с повреждением эндотелия служит использование сулодексида, обладающего способностью защищать гликокаликс, а следовательно, и эндотелий [43–46]. Исследования, проведенные как на культуре клеток, так и на животных и людях, показали, что сулодексид, подавляя высвобождение провоспалительных цитокинов и химокинов, значительно противодействует воспалительному процессу [44]. Кроме того, установлено, что сулодексид, ослабляя оксидативный стресс посредством уменьшения продукции активных форм кислорода и увеличения образования супероксид дисмутазы, противодействует повреждению гликокаликса. Наряду с этим сулодексид в силу своего состава является мощным антитромботическим фактором. По сравнению с эноксапарином он оказывал более выраженный антикоагулянтный эффект в отношении протромбинового и тромбинового времени, активированного частичного тромбопластинового времени. Кроме того, сулодексид оказывал более сильное ингибирующее действие на образование микрочастиц, экспрессию P-селектина и образование агрегатов тромбоцитов [47–48].
Наконец, очень важным обстоятельством является безопасность использования такого антитромботического средства, как сулодексид [49]. Так, в нашем исследовании, хотя сулодексид вводили внутривенно и при этом никак не корректировали дозу низкомолекулярного гепарина, применяемого подкожно, не наблюдалось ни одного даже незначительного (десневого, носового) кровотечения.
Все сформулированные выше положения нашли полное подтверждение и в приводимом в этой статье исследовании. Во-первых, как следует из рисунка 1, концентрация циркулирующих эндотелиоцитов в группе больных, леченных в течение 10 дней с применением сулодексида, оказалась почти на 40% меньше, чем в контрольной группе; это свидетельствует о том, что сулодексид смог защитить от поражения большую часть эндотелиоцитов. Подобный эффект должен был привести к уменьшению нарушения в составе и структуре крови, что подтверждает рисунок 2: концентрация эритроцитарных сладжей в группе сулодексида в течение 10 дней терапии уменьшилась почти втрое, тогда как в контрольной группе она осталась практически неизменной. Если учесть, что эритроцитарные агрегаты препятствуют нормальному кровоснабжению, то можно заключить, что сулодексид позволяет нормализовать (или по крайней мере значительно улучшить) кровоснабжение органов, уменьшая степень выраженности гипоксии тканей.
Далее, как видно из рисунка 3, сулодексид подавляет активацию тромбоцитов, снижая степень и выраженность гиперкоагуляции, в то время как в контрольной группе, несмотря на непрерывно идущий процесс лечения, количество активированных тромбоцитов возрастало.
Наконец, нужно заметить, что мы начали лечение больных COVID-19 с применением сулодексида достаточно поздно: от появления первых симптомов заболевания до госпитализации больных проходило в среднем почти шесть дней. Этого времени вирусу могло быть вполне достаточно для того, чтобы вызвать значительное воспаление сосудистой стенки и коагулопатию. Весьма вероятно, что начни мы применение сулодексида раньше, его эффект был бы более выраженным.
В пользу этого предположения свидетельствуют результаты работы мексиканских исследователей, которые начали лечение больных COVID-19 на амбулаторном этапе, в течение не более трех дней после появления симптомов болезни. Из 243 невакцинированных пациентов, включенных в исследование, 124 человека получали перорально сулодексид в дозе 1000 ед/сут в течение 21 дня, 119 – плацебо. За все время терапии в группе сулодексида было госпитализировано достоверно меньше пациентов, чем в группе плацебо: 17,7 против 29,4% (р=0,03). В респираторной поддержке в группе сулодексида нуждались 29,8% больных, а в группе плацебо – 42% (р=0,05). И хотя в обеих группах некоторых больных приходилось вентилировать принудительно (искусственная вентиляция легких), а некоторые умерли, количество пациентов в этих конечных точках в группе сулодексида было вдвое меньше, чем в группе плацебо [50]. Эти данные свидетельствуют о эффективности сулодексида в лечении COVID-19 на амбулаторном этапе.
ЗАКЛЮЧЕНИЕ
Подводя итог, можно утверждать, что обладающий множеством достоинств (безопасность, возможность перорального приема) препарат сулодексид эффективно снижает сосудистое воспаление и значительно уменьшает нарушения состава и функции крови у больных COVID-19. Наши данные указывают на то, что сулодексид может служить эффективным лечебным средством для больных, пораженных вирусом SARS-CoV-2. Конечно, для того чтобы сделать окончательный вывод о пользе применения сулодексида при COVID-19, необходимо серьезное рандомизированное клиническое исследование на большом количестве больных. Однако полученные нами результаты, равно как и данные, опубликованные в работе мексиканских исследователей [50], дают основания надеяться, что в будущем также удастся доказать эффективность приема сулодексида в лечении больных с новой коронавирусной инфекцией.
Благодарности: авторы признательны компании «Нанопромимпорт» (Научный парк ФГБОУ ВО «МГУ им. М.В. Ломоносова»), лично его главе Вячеславу Голкову и инженеру Игорю Богданову за высокопрофессиональную техническую поддержку.



