ВВЕДЕНИЕ: ВОЗРАСТНЫЕ КРИТЕРИИ ПОЗДНЕГО ГИПОГОНАДИЗМА
Гипогонадизм – распространенное эндокринное расстройство, характеризующееся как клиническими признаками дефицита тестостерона, так и снижением его уровня в сыворотке крови [8]. Это состояние можно классифицировать по двум критериями: «по уровню поражения» выделяют первичный (при патологии яичек) и вторичный (поражение на уровне гипофиз/гипоталамус) гипогонадизм, «по механизму поражения» – органический и функциональный. Функциональный гипогонадизм обратим после лечения основных его причин.
Если по этим определениям мировым медицинским сообществом в целом был достигнут консенсус, то возраст, после которого дефицит тестостерона может быть классифицирован как «поздний», все еще обсуждается. Согласно позиции Британского общества сексуальной медицины (British Society for Sexual Medicine, BSSM), термин «поздний гипогонадизм» следует использовать для описания функционального расстройства, проявляющегося клиническими признаками андрогенного дефицита и лабораторно подтвержденным низким уровнем тестостерона сыворотки крови у мужчин старше 50 лет [6]. Аналогичным образом, Канадская медицинская ассоциация (Canadian Medical Association, САМ) в своих руководящих принципах ссылается на тот же возрастной порог из-за высокой распространенности дефицита тестостерона у мужчин старше 50 лет [7].
Однако является ли возрастная граница для позднего гипогонадизма клинически значимой? Если рассматривать старение мужской репродуктивной системы, то постепенное ухудшение качества сперматозоидов и снижение фертильности, возможно, начинается уже в 30–35 лет [1]. С возрастом растет распространенность коморбидных метаболических заболеваний (висцерального ожирения, сахарного диабета 2-го типа), которые во многом обусловливают дефицит тестостерона у мужчин, как это, к примеру, наблюдалось у мужчин среднего и пожилого возраста в европейском исследовании старения мужчин European Male Aging Study (2012) [2].
Добавим, что до 2000-х гг. для описания рассматриваемой проблемы применялись термины «андропауза», «мужской климактерический период», «снижение андрогенов у стареющих мужчин» (Androgen Decline In The Ageing Male, ADAM) и «частичное снижение андрогенов у стареющих мужчин» (Partial Androgen Decline In The Ageing Male, PADAM). С 2010-х гг. двумя наиболее часто используемыми терминами стали «дефицит тестостерона» и «возрастной гипогонадизм» [6–9, 13, 14]. В результате некоторыми медицинскими обществами в эти определения были включены как функциональные, так и хронические органические формы гипогонадизма независимо от факторов их возникновения [8, 9, 12, 14]. Напротив, другие профессиональные ассоциации рассматривали поздний гипогонадизм как синоним функционального гипогонадизма [6, 11].
ПРИЗНАКИ ДЕФИЦИТА ТЕСТОСТЕРОНА ПРИ ФУНКЦИОНАЛЬНОМ ГИПОГОНАДИЗМЕ
Не вызывает сомнений связь между уровнем тестостерона и сексуальной функцией у мужчин среднего и пожилого возраста. В европейском исследовании мужского старения уменьшение частоты утренней эрекции, снижение либидо и эректильная дисфункция были последовательно ассоциированы с низким уровнем тестостерона в сыворотке крови, с пороговыми значениями общего тестостерона в диапазоне 8–11 нмоль/л (230–320 нг/дл) [17].
В то же время общеизвестно, что у пациентов с поздним гипогонадизмом наблюдаются и менее специфические симптомы, включая усталость, раздражительность, подавленное настроение, плохую концентрацию внимания, ухудшение памяти, снижение переносимости физических нагрузок и работоспособности, легкую анемию и нарушение сна [5–14]. Возникает закономерный вопрос: должна ли клиническая диагностика гипогонадизма основываться исключительно на типичных его симптомах или же нескольких неспецифических признаков может быть достаточно для проведения дополнительного обследования? Если в первом случае вероятность лабораторно подтвердить дефицит тестостерона намного выше, то второй подход открывает возможности для ранней и своевременной диагностики гипогонадизма. Так, в последних рекомендациях Российской ассоциации эндокринологов (РАЭ) говорится о необходимости ежегодного скрининга на андрогенный дефицит у всех пациентов с сахарным диабетом 2-го типа и ожирением [18].
Отметим, что документы целого ряда крупных медицинских обществ и ассоциаций содержат указания на более специфические признаки дефицита тестостерона, тогда как в публикациях других сообществ представлен лишь общий перечень соответствующих симптомов (табл. 1) [5–16].



Zitzmann M. et al., включив в наблюдение 434 мужчин в возрасте 50–86 лет, не выявили четкого порогового уровня сывороточного тестостерона крови для начала проявлений симптомов позднего гипогонадизма. Между тем при снижении уровня андрогенов росла распространенность психосоматических симптомов и метаболических факторов риска. Например, частота потери либидо стремительно увеличивалась при снижении концентрации тестостерона ниже 15 нмоль/л (p <0,001), в то время как депрессия и сахарный диабет 2-го типа (в том числе в отсутствие ожирения) значительно чаще встречались у мужчин с концентрацией тестостерона ниже 10 нмоль/л (p <0,001). Эректильная дисфункция развивалась из-за целого комплекса факторов – метаболических нарушений, курения, депрессии. При этом частота ее встречаемости значительно возрастала при уровне тестостерона ниже 8 нмоль/л (p=0,003) [19]. Обнаруженная в этом исследовании тесная связь между количеством метаболических нарушений и уровнем циркулирующего тестостерона продемонстрировала роль этого гормона как самостоятельного фактора риска развития коморбидной патологии.
Для повышения эффективности раннего выявления функционального гипогонадизма и его дифференциальной диагностики с другими патологическими состояниями разработаны различные анкеты и опросники. Среди них наиболее часто используются Шкала симптомов старения мужчин (AMS), тест на дефицит андрогенов у стареющих мужчин (ADAM), опросник Массачусетского исследования старения мужчин, или опросник Смита (MMAS) и Андротест [20–23]. Несмотря на общую адекватную чувствительность (>80%), сообщалось об ограниченной специфичности указанных анкет и опросников (<50%) [24].
Различные медицинские сообщества дают разные рекомендации насчет применения этих опросников в клинической практике. Так, BSSM и Международное общество по изучению старения мужчин (ISSAM) поддерживают применение этих методов для получения базовой количественной оценки выраженности симптомов гипогонадизма и оценки клинического ответа на лечение, а вот Европейская ассоциация урологов (EAU) их использование не рекомендует [6, 12, 14].
ЛАБОРАТОРНЫЕ МЕТОДЫ ДЛЯ ОЦЕНКИ УРОВНЯ ТЕСТОСТЕРОНА
Как указывалось ранее, диагноз позднего гипогонадизма опирается как на клинические, так и биохимические данные. Лабораторные исследования включают определение общего тестостерона (Т), глобулина, связывающего половые гормоны (ГСПГ), фолликулостимулирующего (ФСГ) и лютеинизирующего гормона (ЛГ). Оценка содержания свободного Т может быть показана только тем пациентам, у которых есть состояния, влияющие на уровень ГСПГ, либо в случае, когда общий Т находится на нижней границе референсного диапазона или близко к ней [8].
Согласно рекомендациям BSSM, EAU, Европейской академии андрологии (EAA) и Эндокринного общества Австралии (ESA), общий Т должен быть проанализирован с использованием проверенных методов прямого иммуноанализа, если методы «золотого стандарта» (газовая или жидкостная хроматография, органическая экстракция с последующей масс-спектрометрией) недоступны [6, 9, 11, 12, 25, 26].
Для оценки содержания свободного Т общепризнан расчетный метод, учитывающий уровни общего Т, ГСПГ и альбумина [6, 7, 11–14, 27].
ПОРОГОВЫЙ УРОВЕНЬ ТЕСТОСТЕРОНА ДЛЯ БИОХИМИЧЕСКОЙ ДИАГНОСТИКИ ПОЗДНЕГО ГИПОГОНАДИЗМА
Колебания уровня тестостерона зависят от суточных и сезонных ритмов, а также имеют индивидуальные вариации, обусловленные возрастом, генетическими особенностями, этнической принадлежностью, факторами образа жизни и сопутствующими заболеваниями [28].
Широко принятым большинством профессиональных сообществ является диагностический подход, основанный на двукратном определении уровня тестостерона натощак в интервалах между 07:00 или 08:00 утра и 10:00 или 11:00 утра с интервалом в 4 нед, исключая периоды острого заболевания [1, 6, 8–12].
Известно, что около 40% тестостерона связано с ГСПГ, на уровень которого влияет целый ряд факторов. Таким образом, при снижении (например, на фоне ожирения, сахарного диабета, применения глюкокортикоидов, нефротического синдрома, гипотиреоза или акромегалии) или повышении концентрации (например, на фоне старения, ВИЧ- инфекции, цирроза печени, гепатита или тиреотоксикоза) сывороточного ГСПГ, а также у пациентов с пограничными уровнями общего тестостерона (6,9–13,9 нмоль/л, или 200–400 нг/ дл согласно критериям Эндокринного общества и 8–12 нмоль/л, или 231–346 нг/дл согласно критериям BSSМ и EAA) уровень общего тестостерона может неадекватно отражать андрогенный статус, в связи с чем возникает необходимость в оценке показателя свободного тестостерона [6, 8, 11, 13, 29].
В соответствии с вышеупомянутыми условиями показания к определению свободного тестостерона есть у значительной доли пациентов с поздним гипогонадизмом. К сожалению, данные проспективных и рандомизированных контролируемых исследований, посвященных связи между уровнями общего и свободного тестостерона и клиническими показателями андрогенного дефицита (включая мышечную силу, минеральную плотность костной ткани, индекс массы тела и жировую массу), ограниченны. Однако лабораторное подтверждение гипогонадизма на основании одномоментной оценки как общего, так и свободного тестостерона ассоциировано с повышенным индексом массы тела и сексуальными нарушениями, включая эректильную дисфункцию, снижение либидо и снижение утренней эрекции [4, 17]. В таблице 2 приведены данные о пороговых диагностических значениях общего и свободного тестостерона.
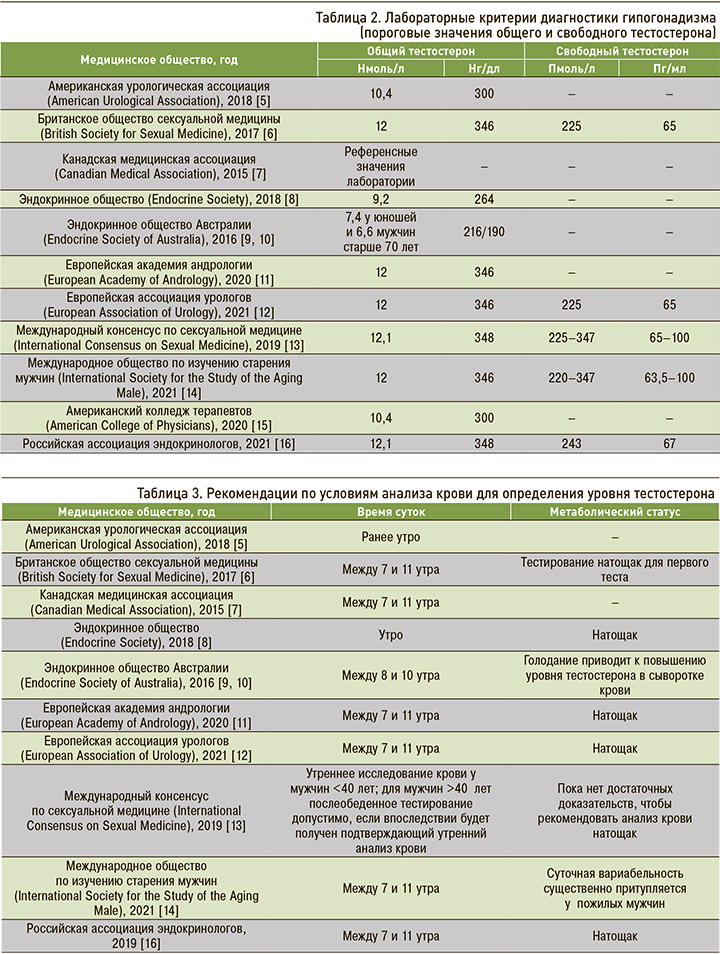
Международным обществом сексуальной медицины (International Society for Sexual Medicine) в 2019 г. был поставлен вопрос о необходимости обязательного взятия крови для определения уровня тестостерона только утром натощак [13]. Вместе с тем ранее сообщалось, что даже у пожилых мужчин были зарегистрированы суточные колебания уровня тестостерона (с повышением в утренние часы) при использовании методик «золотого стандарта», в частности масс-спектрометрии [30]. Таким образом, подавляющее большинство действующих руководящих принципов, за исключением ISSAM и Международного консенсуса по сексуальной медицине (ICSM), диктуют необходимость анализа крови на тестостерон утром натощак (табл. 3).
Нужно отметить, что на сегодняшний день сохраняются неоднозначные взгляды на лабораторные диагностические критерии гипогонадизма. В некоторых крупных исследованиях, например в группе плацебо-контролируемых наблюдений The Testosterone Trials Национальной академии наук США, в качестве критерия включения был выбран уровень общего тестостерона 9,5 нмоль/л (275 нг/ мл) [31].
Кроме того, существуют свои особенности в подходах к дальнейшему обследованию пациента в зависимости от степени снижения уровня тестостерона крови. Так, при уровне общего тестостерона <5,2 нмоль/л (<150 нг/дл) в соответствии с рекомендациями Американской урологической ассоциации (AUA), BSSM, Эндокринного общества и при его уровне <6 нмоль/л (175 нг/дл) в соответствии с гайдлайнами EAA и EAU рекомендуется исключить вторичный гипогонадизм с помощью магнитно-резонансной томографии гипофиза и проведения оценки уровня гипофизарных гормонов [5, 6, 8, 11, 12, 14].
По сути до сих пор в мире нет единой точки зрения насчет лабораторных критериев диагностики позднего андрогенного дефицита. Кроме того, еще предстоит выяснить, должны ли использоваться одни и те же критерии диагностики независимо от возраста и/или наличия сопутствующих заболеваний.
ОЖИДАЕМЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ ПРЕПАРАТАМИ ТЕСТОСТЕРОНА
К настоящему времени собраны внушительные данные об эффективности и безопасности тестостерон-заместительной терапии (ТЗТ). В частности, ESA подчеркивает, что особенности клинических эффектов ТЗТ сильно варьируются у различных мужчин, а эксперты ISSAM отмечают, что эффекты TЗТ зависят от продолжительности терапии [9, 14]. Например, улучшение либидо, эректильной функции, общего самочувствия и настроения наблюдается уже в первые месяцы лечения, в то время как для достижения терапевтического эффекта ТЗТ в отношении минеральной плотности костной ткани требуется до 2–3 лет [14].
AUA впервые рекомендует рассматривать андрогенный дефицит как независимый фактор риска развития сердечно-сосудистых заболеваний и их осложнений, что делает вопрос назначения ТЗТ при позднем гипогонадизме более чем актуальным [5]. Согласно большинству руководящих документов, ТЗТ должна применяться только при подтверждении гипогонадизма в соответствии с определенными диагностическими критериями. Препараты тестостерона не должны назначаться для снижения веса и/или улучшения гликометаболического контроля у мужчин с сахарным диабетом 2-го типа и/или метаболическим синдромом [8, 11]. При этом в ICSM отмечается, что ТЗТ все же может играть роль в управлении метаболическими состояниями, включая ожирение [13]. Таким образом, показания к назначению тестостерона мужчинам с различными сопутствующими заболеваниями и андрогенным дефицитом вызывают множество споров и вопросов. Исходя из актуальных рекомендаций РАЭ, ТЗТ может быть назначена всем мужчинам с сахарным диабетом 2-го типа и гипогонадизмом вне зависимости от возраста и показателей углеводного обмена [18].
Современные данные свидетельствуют о неоспоримой пользе ТЗТ для улучшения либидо и эректильной функции, но что касается его влияния на метаболические и сердечно-сосудистые параметры, то актуальные сведения на этот счет неоднозначны и требуют долгосрочных крупномасштабных исследований.
ВЕДЕНИЕ ПАЦИЕНТОВ НА ТЕСТОСТЕРОН-ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ
Как уже было сказано ранее, ТЗТ следует применять только у пациентов с подтвержденным андрогенным дефицитом. Противопоказания к препаратам тестостерона включают:
- рак грудной железы;
- метастатический рак предстательной железы;
- впервые выявленное узловое образование или уплотнение предстательной железы;
- уровень простатического специфического антигена (ПСА) >4 нг/мл (или >3 нг/мл у лиц с высоким риском развития рака предстательной железы);
- тяжелую обструкцию нижних мочевых путей, связанную с доброкачественной гипертрофией предстательной железы;
- недавний инфаркт миокарда или инсульт;
- неконтролируемую или плохо контролируемую застойную сердечная недостаточность;
- тяжелое обструктивное апноэ во сне;
- уровень гематокрита выше верхней границы нормы или более 54% в период ТЗТ;
- тромбофилию;
- заинтересованность в репродуктивной реабилитации [5–14].
В мире доступны различные формы препаратов тестостерона, в том числе пероральные, инъекционные, буккальные формы, назальный гель, трансдермальные пластыри и гели [32]. Инъекционные препараты длительного действия (например, тестостерон ундеканоат) и трансдермальные составы являются наиболее часто применяемыми, удобными и экономически эффективными методами лечения в соответствии с рекомендациями ESA, EAA и РАЭ [10, 11, 16].
К преимуществам инъекционных препаратов тестостерона длительного действия относятся нечастая кратность введения (1 раз в 2–6 нед) и длительное поддержание уровня общего тестостерона крови в референсном диапазоне [32]. В свою очередь, основной недостаток таких препаратов – длительный период полувыведения, не позволяющий одномоментно отменить терапию в случае возникновения неблагоприятных побочных эффектов [6]. В связи с этим, согласно рекомендациям EAA, EAU и РАЭ, трансдермальный тестостерон следует рассматривать как предпочтительный препарат при инициации ТЗТ у пациентов с поздним андрогенным дефицитом. Если клиническая ситуация демонстрирует значительные преимущества инъекционных форм, то может быть рассмотрен переход на препараты тестостерона более длительного действия [11, 12, 16].
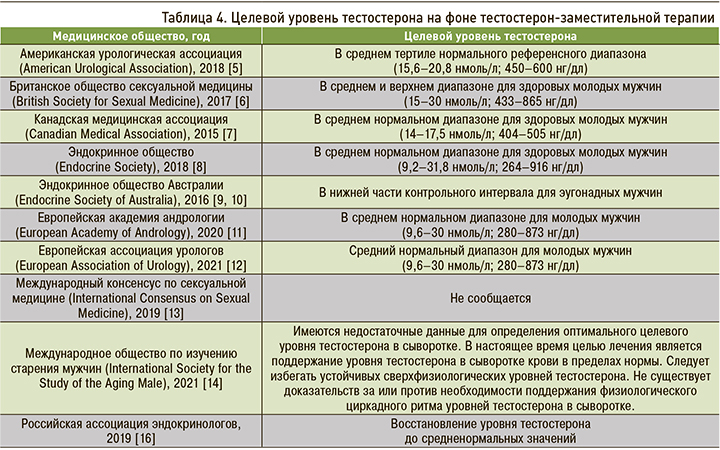
Если на вышерассмотренные аспекты терапии взгляд экспертов един, то в отношении целевого уровня общего тестостерона, который должен быть достигнут на ТЗТ, мнения расходятся (табл. 4). Большинство профессиональных обществ рекомендует достижение среднего нормального диапазона общего тестостерона [5, 7, 8, 11–13, 16], ESA – нижней части референсного интервала, а BSSM – среднего и верхнего диапазона для здоровых молодых мужчин [6, 10]. ISSAM же, в свою очередь, обращает внимание на отсутствие достаточных данных для определения оптимальных сывороточных уровней общего тестостерона на фоне ТЗТ [14].
Клиническое и лабораторное наблюдение должно проводиться через 3, 6 и 12 мес, а затем ежегодно у любого пациента на ТЗТ, включая пациентов с поздним гипогонадизмом [6, 8, 12–14]. При этом следует оценивать как эффективность, так и безопасность ТЗТ. CMA, Эндокринное общество, EAA, EAU, ISSAM и РАЭ предлагают выполнять пальцевое ректальное исследование при каждом обследовании [7, 8, 11, 14, 16]. Что же касается лабораторной оценки, то здесь показано определение общего тестостерона, ПСА общего и гематокрита. В случаях повышения уровня ПСА >1,4 нг/мл в течение 1 года с момента начала ТЗТ или если его уровень составляет >4 нг/мл при любом последующем наблюдении, Эндокринное общество, EAA и РАЭ рекомендуют проведение урологического осмотра [8, 11, 16]. В то же время ЕSА рекомендовало отказаться от рутинного мониторинга ПСА в период ТЗТ, поскольку это может привести к чрезмерной диагностике и вреду от вмешательств по поводу клинически незначимого местного рака предстательной железы [10]. Согласно гайдлайнам EAU, у пациентов с андрогенным дефицитом также должна быть произведена оценка липидного и углеводного обмена [12].
Наконец, у пациентов с пограничными уровнями общего тестостерона некоторые авторы предлагают провести пробное лечение тестостероном продолжительностью от 3 мес (CMA) до 6 мес (BSSM) [6, 7]. Следует отметить, что пробное лечение на полгода рекомендует и ICSM – для мужчин с клиническими признаками андрогенного дефицита, но нормальным уровнем тестостерона сыворотки.
ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ ТЕСТОСТЕРОНОМ – ЕДИНСТВЕННЫЙ ВАРИАНТ ДЛЯ ПАЦИЕНТОВ С ПОЗДНИМ ГИПОГОНАДИЗМОМ?
Как известно, на уровень тестостерона могут влиять различные физиологические, фармакологические и патологические факторы. С одной стороны, из этого следует, что всегда следует добиваться устранения модифицируемых факторов риска, с другой стороны, возможно, стоит предварительно оценить «удельный вес» этих факторов в развитии андрогенного дефицита перед решением вопроса о необходимости назначения ТЗТ.
Среди функциональных причин гипогонадизма выделяют [8]:
- ожирение;
- гипотиреоз и гиперпролактинемию;
- некоторые нарушения сна;
- сопутствующие заболевания, связанные со старением;
- применение наркотиков (например, опиоидов), анаболических стероидов и глюкокортикоидов;
- злоупотребление алкоголем и марихуаной;
- системные заболевания;
- дефицит питательных веществ/чрезмерные физические нагрузки;
- органную недостаточность (печень, сердце и легкие).
Понятие функционального гипогонадизма подразумевает восстановление нормальной выработки тестостерона при условии лечения основного заболевания (фактора). На сегодняшний день данные по этому вопросу противоречивы. В частности, опубликовано множество доказательств нормализации уровня тестостерона после лечения ожирения с помощью мер по изменению образа жизни, фармакологической терапии или бариатрической хирургии [33–36]. В то же время необходимо отметить, что, несмотря на положительные результаты, сообщалось о высоком проценте неудач при использовании мер по лечению ожирения, особенно когда терапия прекращалась: у части пациентов ожирение и андрогенный дефицит снова прогрессировали [37, 38]. Большинство профессиональных сообществ рекомендует первостепенно воздействовать на параметры образа жизни (например, питание и физическую активность у мужчин с ожирением) и лечить сопутствующие заболевания, лежащие в основе андрогенного дефицита. Именно такой подход признан AUA, BSSM, Эндокринным обществом, EAA, EAU и ESA [5, 6, 8, 10–12]. Но если BSSM одобрил изменения образа жизни только в сочетании с ТЗТ, то EAA и ESA рекомендуют сначала лечить сопутствующие заболевания и начинать TЗT только у пациентов со стойким низким уровнем тестостерона [6, 10, 11]. Специалисты EAU рассматривают нормализацию массы тела как первостепенное направление терапии у всех мужчин с ожирением и гипогонадизмом; вместе с тем они подчеркивают, что по влиянию на уровень общего тестостерона и клинические признаки андрогенного дефицита эта мера имеет значительно более скромный эффект по сравнению с ТЗТ [12].
Согласно РАЭ, для назначения ТЗТ необходимым и достаточным является наличие лабораторно подтвержденного гипогонадизма [16]. Исключение могут составлять случаи обратимого гипогонадизма, например, при достижении целевого гликемического контроля у пациентов с впервые выявленным сахарным диабетом. В таком случае сначала рекомендуется компенсировать углеводный обмен, а уже потом провести повторную диагностику гипогонадизма для оценки сохранности собственной выработки тестостерона [18].
Наконец, среди стратегий лечения гипогонадизма следует упомянуть применение селективных модуляторов рецепторов эстрогена (кломифенцитрата и др.) и ингибиторов ароматазы (анастрозола и др.). Было показано, что они восстанавливают уровень тестостерона, сохраняя сперматогенез у мужчин. Кроме того, эти средства хорошо переносятся [39–41]. Возможность использования некоторых селективных модуляторов рецепторов эстрогена и/или ингибиторов ароматазы оговаривается AUA, BSSM и Эндокринным обществом [5, 6, 8]. При этом, согласно EAA, указанные препараты не должны применяться при гипогонадизме в связи со скудной доказательной базой (ограниченное количество рандомизированных контролируемых исследований, неадекватные данные об исходах, короткая продолжительность испытаний, а также недостаточное количество включенных пациентов) [11].
ЗАКЛЮЧЕНИЕ
Несмотря на общие принципы диагностики и последующего наблюдения пациентов с поздним гипогонадизмом, между специалистами существуют некоторые различия во взглядах на эту проблему. Самое большое отличие заключается в том, что особое внимание позднему андрогенному дефициту уделяет только Европейская академия андрологии (EAA). Нет на сегодняшний день единой точки зрения на возрастной порог для диагностики возрастного андрогенного дефицита, а также единогласия в вопросе, какие симптомы следует рассматривать как специфические для гипогонадизма.
Что касается биохимических критериев, то здесь предложены различные пороговые значения для уровней общего тестостерона, которые будут использоваться как для диагностики, так и во время последующего наблюдения пациентов с гипогонадизмом. Кроме того, пороговый уровень свободного тестостерона для диагностики указан только в некоторых документах. Наконец, нами обнаружены расхождения относительно вклада ТЗТ и нефармакологической терапии в лечение гипогонадизма [42].
Среди всех форм гипогонадизма поздний андрогенный дефицит имеет свои особенности. Он имеет высокую распространенность среди населения в целом по сравнению с другими формами первичного и вторичного гипогонадизма. В будущем в связи с тенденцией к росту ожидаемой продолжительности жизни, наряду с увеличением распространенности различных расстройств, способствующих развитию гипогонадизма (например, ожирения и сахарного диабета 2-го типа), ожидается значительное увеличение численности мужчин с поздним андрогенным дефицитом. Безусловно, подход к лечению мужчины с поздним гипогонадизмом должен быть комплексным с учетом всех сопутствующих патологий, играющих роль в развитии андрогенного дефицита. В свете значительного повышения интереса к этой теме и появления все большего числа публикаций в скором времени должен быть сформирован единый подход к диагностике и лечению столь значимой и многофакторной проблемы.



