ВВЕДЕНИЕ
Проблема цереброваскулярных заболеваний (ЦВЗ) продолжает оставаться одной из наиболее актуальных и социально значимых в современной медицине. Это определяется широкой распространенностью сосудистых заболеваний головного мозга, их неуклонным ростом, в том числе среди лиц молодого трудоспособного возраста, высоким процентом инвалидизации и смертности. Различают острые (инсульты, транзиторная ишемическая атака) и хронические расстройства мозгового кровообращения (хроническая ишемия головного мозга, в отечественной литературе традиционно обозначаемая как «дисциркуляторная энцефалопатия», а также хроническая недостаточность мозгового кровообращения, цереброваскулярная недостаточность, сосудистая энцефалопатия и др.) [1].
Хроническая ишемия головного мозга (ХИГМ) – медленно прогрессирующая дисфункция головного мозга, возникшая вследствие диффузного и/ или мелкоочагового повреждения мозговой ткани в условиях длительно существующей недостаточности церебрального кровоснабжения и проявляющаяся нарастающими разнообразными дефектами его функционирования в виде комплекса неврологических и нейропсихологических расстройств [2–4].
К основным этиологическим факторам развития ХИГМ относят атеросклероз и артериальную гипертензию, к дополнительным – другие заболевания сердечно-сосудистой системы, которые сопровождаются признаками хронической сердечной недостаточности, нарушениями сердечного ритма, нередко приводящие к падению системной гемодинамики. Неблагоприятно на мозговой кровоток также влияют ортостатическая артериальная гипотензия следствие вегетососудистой дизрегуляции, аномалии брахиоцефальных артерий, интра- или экстракраниальная венозная патология, компрессии сосудов вертебробазилярной системы (спондилогенные, мышечно-фасциальные или другого происхождения). Часто цереброваскулярную недостаточность выявляют у больных сахарным диабетом. Кроме того, церебральная гипоперфузия может развиваться или усугубляться вследствие тяжелой гипоксемии, снижения кислородно-транспортной функции крови, например в случае выраженной анемии или вследствие повышенной вязкости крови при тяжелой полицитемии, особенно в сочетании со стенозом церебральных артерий [5].
В условиях ХИГМ механизмы компенсации истощаются, энергетическое обеспечение мозга становится недостаточным, и в результате сначала развиваются функциональные изменения, а затем и необратимое морфологическое повреждение. Патофизиологические процессы проявляются нарушением целостности гематоэнцефалического барьера, микроциркуляторными расстройствами, изменением иммунореактивности и активацией микроглии, начинающей синтезировать нейротоксины, истощением системы антиоксидантной защиты с поражением свободными радикалами клеточных мембран и митохондрий, прогрессированием эндотелиальной дисфункции, уменьшением антикоагулянтных резервов сосудистой стенки, вторичными метаболическими расстройствами [4–8].
Ранние стадии ХИГМ протекают с минимальными нарушениями когнитивных функций, трудно идентифицируемыми клинически, в виде снижения памяти, замедления темпа и переключаемости умственной деятельности, затруднения процессов обобщения понятий. Нередко эти нарушения сопровождаются головной болью и нарушением сна. Эмоциональные изменения заключаются в развитии апатии, депрессии, немотивированной тревожности, повышенной раздражительности, сужения круга интересов [9–11]. При этом очаговой неврологической симптоматики, как правило, нет.
Сочетание эмоциональных и когнитивных нарушений становится причиной социальной дезадаптации больных с начальными проявлениями ХИГМ. Между тем именно пациенты с субклиническими формами ЦВЗ нуждаются в своевременном клиническом обследовании, поскольку на начальных стадиях сосудистые когнитивные расстройства рассматриваются как потенциально обратимые, а следовательно, ранние диагностика и начало лечебно-профилактических мероприятий позволяют существенно повлиять на качество жизни и прогноз у этой категории больных [12].
Постановка диагноза ХИГМ, особенно на ранних этапах, часто затруднена, так как описанная клиническая картина неспецифична и может приводить к гипердиагностике сосудистого генеза этих проявлений. С учетом этого важно установить связь между клиническими проявлениями и патологией церебральных сосудов.
Для объективизации диагноза используют соответствующие диагностические шкалы и опросники, помогающие определить степень выраженности когнитивных и эмоциональных нарушений, а также инструментальные методы – спондилографию шейного отдела позвоночника при подозрении на патологию в вертебробазилярной системе, ультразвуковые исследования экстра- и интракраниальных сосудов, офтальмоскопию и др. Оценку состояния вещества мозга и ликворных путей выполняют с помощью визуализирующих методов исследования (компьютерная или магнитно-резонансная томография), однако выявить структурные изменения на ранних стадиях бывает весьма сложно, поскольку они развиваются в течение длительного времени, а обнаруженные признаки сосудистого поражения не всегда соотносятся с выраженностью и особенностями клинической картины.
В последние годы особое внимание уделяется поиску новых биохимических маркеров, которые позволили бы подтверждать наличие эпизодов церебральной ишемии, контролировать проводимую терапию, а также определять группы риска развития ишемических катастроф. Одним из таких биомаркеров стали антитела к NR-2 пептиду (NR2- At). Они могут сохраняться в кровотоке до 3–6 мес после одного или нескольких ишемических эпизодов, и их повышенный титр прямо коррелирует с риском возникновения (низкий, средний или высокий) повторных транзиторных ишемических атак или ишемического инсульта [8, 13–15].
Множество вышеуказанных причин развития ХИГМ могут быть изолированными или сочетанными, но часто встречаются в различной комбинации с разной степенью выраженности у людей, в том числе молодого возраста, имеющих системную соединительнотканную неполноценность – так называемую недифференцированную дисплазию соединительной ткани (НДСТ). Например, диспластическое поражение сердечно-сосудистой системы может проявляться синдром артериальной гипо- или гипертензии, аритмическим и сосудистым синдромами, поражение системы гемостаза – анемическим и тромбогеморрагическим синдромами. Поражение соединительнотканных структур головного мозга, обеспечивающих его трофику, опору и защиту, вызывает развитие разнообразных неврологических и/или психических нарушений (до 90% пациентов с НДСТ) [16], таких как синдром расстройства вегетативной нервной системы, синдром психических расстройств и расстройства поведения, в том числе тревожный и депрессивный синдромы, астенический синдром.
Поскольку НДСТ приобрела большую распространенность в современной популяции (по данным разных авторов, она достигает 80% среди детей и лиц молодого возраста) и часто затрагивает сердечно-сосудистую и нервную системы, можно предполагать наличие ХИГМ у этой категории пациентов.
Цель исследования – изучить взаимосвязь НДСТ с развитием церебральной ишемии у лиц молодого возраста.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 80 человек в возрасте от 18 до 22 лет, в том числе 23 (29%) мужчины и 57 (71%) женщин, обучающихся в Алтайском государственном медицинском университете.
Критериями включения были возраст 18–22 года, информированное согласие на участие в исследовании.
Критерии невключения: органические заболевания головного мозга, сахарный диабет, соматические заболевания в стадии декомпенсации, психотические психические расстройства, прием антидепрессантов.
Наличие НДСТ устанавливалось на основании критериев, предложенных Т.И. Кадуриной, с использованием бальной шкалы Байесовского классификатора. Для верификации и количественной оценки проявлений психовегетативного синдрома использовались общепризнанные методики: опросник А.М. Вейна – для выявления признаков вегетативных нарушений; тест Спилберга–Ханина – для определения ситуативной и личностной тревожности; шкала депрессии Бека – для оценки наличия и уровня депрессии; индекс HIT-6 – для определения влияния головной боли на повседневную активность; тест Крепелина – для оценки умственной работоспособности.
Всем обследуемым проводилось общеклиническое исследование крови. Уровень NR2-At измерялся с применением набора фирмы DRD «NR2-AT-ИФА» (г. Улан-Удэ), ферритина, интерлейкина 1 (ИЛ-1), ИЛ-6, фактора некроза опухоли альфа (ФНО-α), фактор роста эндотелия сосудов (VEGF) – с помощью реактивов компании «Вектор» (г. Новосибирск), нейротрофического фактора мозга – реактива компании BCM Diagnostics (США). Все реактивы использовались в соответствии с протоколами производителей.
Дуплексное сканирование брахиоцефальных сосудов осуществлялось на ультразвуковом аппарате GE Healthcare Medical Systems Vivid 3 с применением линейного (5–10 МГц) и секторального (1,5–4,2 МГц) датчиков, запись электроэнцефалограммы производилась на электроэнцефалографе «Нейрон-Спектр 4/ВПМ» фирмы «Нейрософт» (Россия).
Концентрация NR2-At в крови у здоровых взрослых в норме составляет <2,0 нг/мл. Из 80 обследованных студентов у 57 (71%) уровень этого биомаркера оказался выше порогового значения, что свидетельствует о наличии перенесенных в течение последних 3–6 мес однократного или повторных эпизодов церебральной ишемии. Поскольку у студентов, включенных в исследование, не было клинических проявлений острой ишемии головного мозга (острых нарушений мозгового кровообращения, транзиторной ишемической атаки), можно говорить о лабораторно подтвержденных случаях бессимптомной субклинической церебральной ишемии или дебюте ХИГМ. По содержанию NR2- At в сыворотке крови было выделено 2 группы исследования: с нормальным (группа контроля, n=23) и повышенным уровнем (группа сравнения, n=57) этого биомаркера.
Статистический анализ данных проводился с помощью программы RStudio (версия 2022.02.0 Build 443 – ©2009-2022 RStudio, Inc., USA, URL https://www.rstudio.com/) на языке R (версии 4.1.3 (2022-03-10), URL: https://www.R-project.org/). Эмпирические распределения данных испытывались на согласие с законом нормального распределения по критериям Шапиро–Уилка. Ввиду ненормального распределения данных для сравнения непрерывных показателей между группами использовался непараметрический ранговый U-критерий Манна–Уитни. Дескриптивные характеристики представлены в виде медианы [первый квартиль; третий квартиль] (МЕД [Q1; Q3]) для числовых данных, количество (процент) – для категориальных данных. Для сравнения категориальных и бинарных показателей применялся точный двусторонний критерий Фишера. Выявление попарных связей между показателями осуществлялось путем расчета коэффициента корреляции Спирмена. Исследование связей рассматриваемых показателей с повышенным уровнем NR2-At (≥2нг/мл) проводилось путем построения одно- и многофакторных моделей линейной регрессии. Различие считалось статистически значимым при p <0,05.
РЕЗУЛЬТАТЫ
Сравнительная характеристика показателей НДСТ, психовегетативного статуса и головной боли у пациентов с различным уровнем NR2-At приведена в таблице 1.
Уровень NR2-At в группе сравнения был более чем в 2,5 раза выше, чем в контроле (4,11 и 1,45 нг/ мл соответственно, р <0,001), при этом его повышенные показатели значительно чаще встречались у женщин (r=0,33, р=0,004). Значения артериального давления (АД) и индекса массы тела (ИМТ) оказались сопоставимыми в группах исследования, однако при проведении корреляционного анализа была обнаружена слабая отрицательная связь изучаемого маркера ишемии головного мозга с уровнем систолического АД (достоверность, приближающаяся к статистически значимой: r=-0,21, р=0,066) и с ИМТ (статистически значимая связь: r=-0,27, р=0,033). В нашем исследовании обнаруженная тенденция была ассоциирована не с повышением АД, поскольку студентов с артериальной гипертензией выявлено не было, а с его снижением, зарегистрированным у 8% обследованных.
Показатели вегетативной дисфункции, астении, тревожности, депрессии и индекса влияния головной боли на повседневную жизнь оказались выше в группе обследованных, перенесших церебральную ишемию. Тест Крепелина позволил выявить значимое снижение переключаемости внимания в группе сравнения: при выраженной НДСТ связь оказалась отрицательной сильной (r=-0,89, р <0,05).
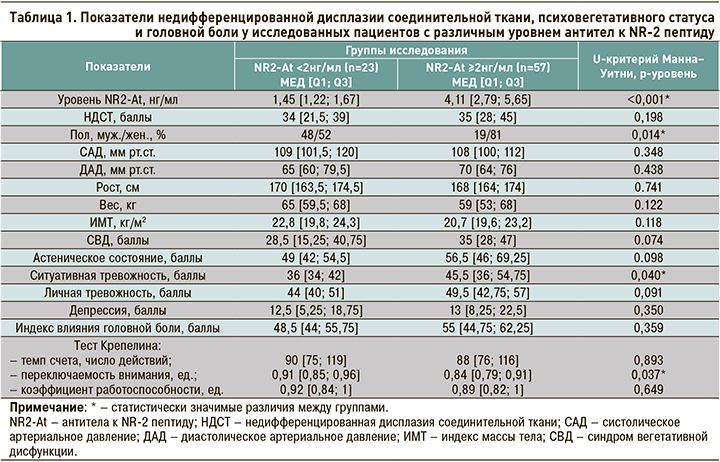
По количеству баллов НДСТ исследуемые группы не имели статистически значимых различий, однако при изучении уровня NR2-At в подгруппах с разной степенью выраженности НДСТ было обнаружено значимое увеличение титра маркера ишемии головного мозга у участников с выраженной соединительнотканной дисплазией относительно тех, кто не имел диспластических фенотипических признаков (3,7 и 2,2 нг/мл соответственно, р=0,012; рис. 1).
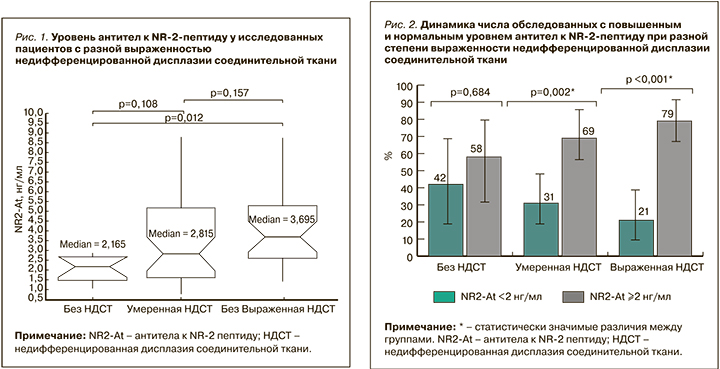
На рисунке 2 показано увеличение числа лиц, перенесших ишемию головного мозга, по мере увеличения степени выраженности диспластического процесса: это число достигло практически 4-кратного преобладания в подгруппе участников с выраженной НДСТ.
Исследование структуры НДСТ продемонстрировало, что в группе сравнения (участники с повышенной концентрацией NR2-At) количество обследованных с выраженной дисплазией было в 2,4 раза больше, чем в группе с нормальным уровнем маркера церебральной ишемии (42,1 и 17,4% соответственно). При этом в группе повышенного титра NR2-At доля студентов без дисплазии составила всего 8,8 против 21,7% в группе контроля.
Результаты лабораторных исследований крови обследованных лиц представлены в таблице 2.
Было обнаружено снижение показателей красной крови, а также тенденция к снижению других форменных элементов крови в группе лиц, имевших повышенные уровни маркера церебральной ишемии NR2-At, со слабой отрицательной корреляционной связью, близкой к статистически значимой (гемоглобин – r=-0,22, р=0,056; MCH – r=-0,22, р=0,055; тромбоциты – r=-0,21, р=0,077; лейкоциты – r=-0,23, р=0,042; из лейкоцитарной формулы особого внимания заслуживают моноциты – r=-0,22, р=0,064). В группе с выраженной НДСТ отмечалась значимая сильная обратная связь с уровнем ферритина (r=-0,80). При этом маркеры воспаления (ФНО-α, ИЛ-1, ИЛ-6) в группе сравнения не отличались от показателей группы контроля.
Уровень факторов роста эндотелия сосудов (медиаторов ангиогенеза, а также, по данным последних исследований, нейрогенеза и нейропротекции) и фибробластов-21 (маркера митохондриальной цитопатии) оказался значимо ниже в группе сравнения, что, вероятно, служит свидетельством снижения ангио- и нейрогенного потенциала (r=-0,32, р=0,012), а также энергетического дефицита при ХИГМ.
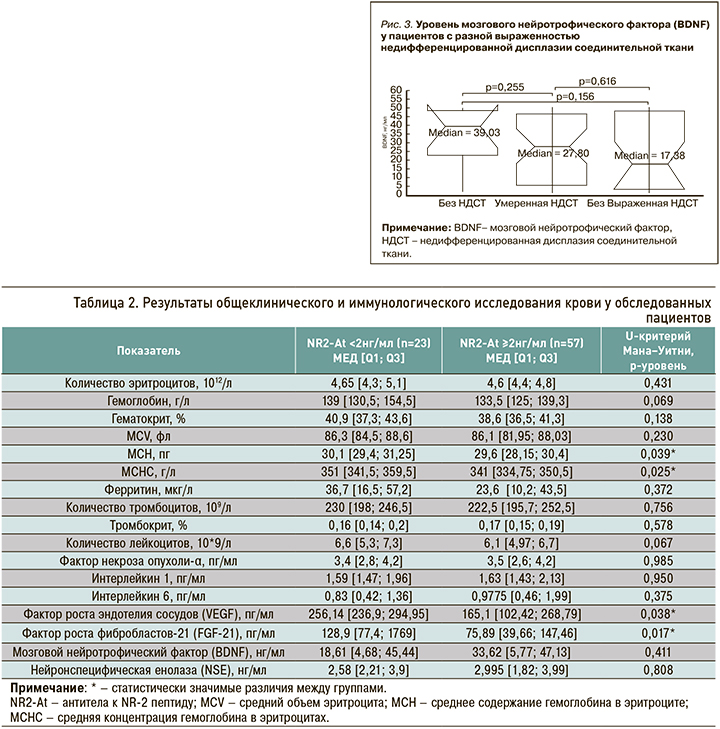
Увеличение содержания маркеров нейротрофики (BDNF) и нейродегенерации (NSE) в сыворотке крови у пациентов с повышенным уровнем NR2-At демонстрирует стимулирующее влияние ишемии головного мозга на его трофическое обеспечение, на что указывает практически двукратный рост нейротрофического фактора (впрочем, не достигший статистически значимой разницы, по-видимому, в силу малого количества наблюдений), но при этом не сопровождается повреждением нейронов. Этот аспект, однако, требует дальнейшего наблюдения.
При определении уровня BDNF в подгруппах без НДСТ, с умеренно выраженной и выраженной НДСТ была обнаружена четкая тенденция к снижению нейротрофина при переходе из одной подгруппы в другую (рис. 3).
Стимулирующее действие ишемии на выработку BDNF, вероятно, может быть ограничено у пациентов с выраженной НДСТ, что связано с более низким регенераторным потенциалом у таких пациентов.
В результате исследования кровотока по брахиоцефальным сосудам не было выявлено статистически значимых различий диаметров сосудов и скоростных показателей по экстракраниальным сосудам как каротидного, так и вертебробазилярного бассейнов (табл. 3).
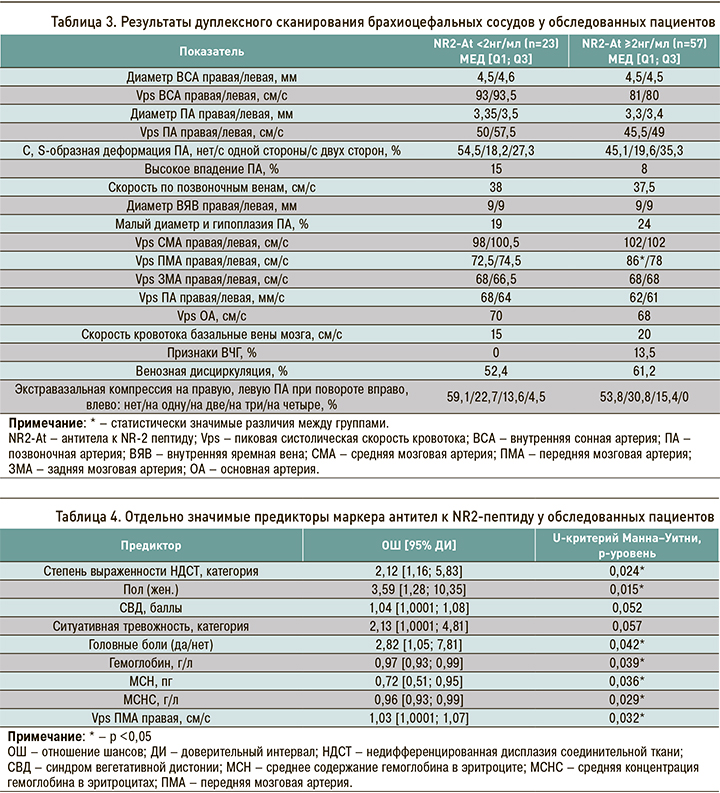
Обращает на себя внимание тенденция к более низкой скорости кровотока по артериям на экстракраниальном и к более высокой на интракраниальном (средняя и передняя мозговые артерии) уровнях и по базальным венам мозга, а также более частая встречаемость малого диаметра и гипоплазии позвоночных артерий, их деформации и экстравазальной компрессии в группе пациентов, перенесших церебральную ишемию. При этом высокое впадение позвоночной артерии не влияет на развитие ишемии головного мозга.
При построении однофакторных моделей логистической регрессии предикторами, ассоциированными с увеличением шансов развития церебральной ишемии, явились наличие НДСТ, головных болей и анемии, увеличение скорости кровотока по передней мозговой артерии справа и женский пол (табл. 4).
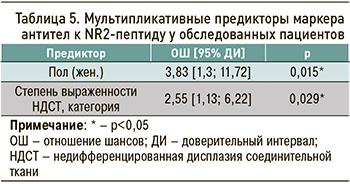
Построение многофакторной модели логистической регрессии выявило комбинацию НДСТ и женского пола как двух значимых мультипликативных предикторов регрессии, позволяющих говорить о том, что у женщин, имеющих выраженную НДСТ, шанс обнаружения церебральной ишемии в 24,9 раза больше, чем у мужчин без НДСТ (табл. 5).
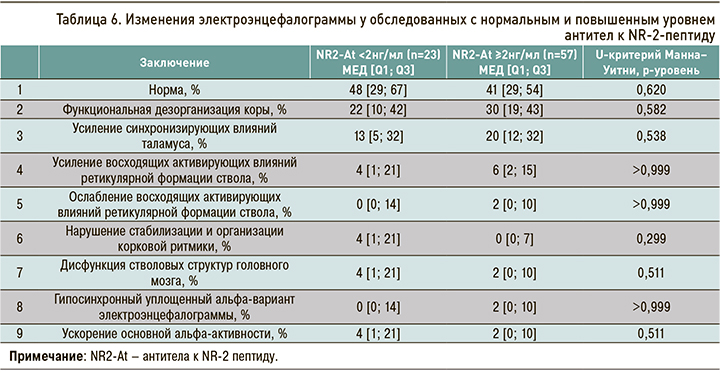
В результате изучения биоэлектрической активности головного мозга у более половины обследованных была установлена высокая частота изменений на электроэнцефалограмме, однако взаимосвязи этих изменений с перенесенной церебральной ишемией не обнаружено (табл. 6).
В последних исследованиях, где в качестве биомаркера использовался NR2-At, у пациентов с острыми и хроническими ишемическими повреждениями головного мозга удалось определить 3 степени риска развития ишемического инсульта: низкий (уровень NR2-At 2,0–3,0 нг/мл), средний (3,0–5,0 нг/мл) и высокий (>5,0 нг/мл). Исходя из этого, среди 80 участников нашего исследования низкий риск ишемических событий имеют 20 (25%), средний – 17 (21%), высокий – 20 обследованных (25%).
ОБСУЖДЕНИЕ
Среди 80 обследованных нами студентов в возрасте 18–22 лет маркер ишемии головного мозга NR2-At оказался повышен у 57 человек (71,3%), что подтверждает ранний дебют ХИГМ, несмотря на отсутствие наиболее значимых факторов риска ЦВЗ, таких как артериальная гипертензия и атеросклероз магистральных церебральных артерий. Это указывает на сложность механизмов возникновения и прогрессирования хронической сосудистой мозговой недостаточности.
Перенесенная в течение предыдущих 3–6 мес ишемия головного мозга способствует увеличению проявлений астеновегетативного синдрома, тревожно-депрессивных расстройств и усилению влияния головной боли на повседневную жизнь. Важное значение в развитии этих нарушений имеет наличие и степень выраженности НДСТ. Так, при выраженной дисплазии выявлен статистически значимо более высокий уровень NR2-At по сравнению с обследованными без НДСТ.
В нашем исследовании нашел подтверждение тот факт, что снижение показателей красной крови (гемоглобина, MCH, MCHC) связано с развитием ишемии головного мозга. Возможно, в этом процессе свою роль играет не только снижение морфологического субстрата переноса кислорода, но и большее количество молодых форм эритроцитов, обладающих меньшей способностью к деформируемости. Женский пол также является неблагоприятным в отношении развития ишемии головного мозга фактором, что частично связано с более низким уровнем гемоглобина у женщин и, видимо, другими гормонозависимыми факторами, требующими дальнейшего изучения. Подобные данные, продемонстрирующие большую степень повышения уровня NR2-At в остром периоде ишемического инсульта и при транзиторной ишемической атаке у женщин по сравнению с мужчинами, приводятся в работах М.Н. Топузовой и соавт. [14, 15].
Нормальный уровень маркера повреждения нейронов NSE в группе с повышенным титром NR2-At доказывает отсутствие органического поражения мозга после перенесенной церебральной ишемии у молодых людей, возможно, за счет увеличения нейротрофического фактора, выполняющего ключевую функцию в механизмах нейропротекции. Однако следует обратить внимание на значимое снижение в условиях ишемии головного мозга медиатора ангио- и нейрогенеза VEGF и митохондриальную дисфункциию, о чем свидетельствует снижение фактора роста фибробластов-21. Такие изменения могут быть значимы для последующего прогрессирования клинических проявлений в условиях продолжающейся ХИГМ и требуют дальнейшего наблюдения.
На основании результатов дуплексного сканирования головного мозга можно говорить об отсутствии влияния диаметров и скоростных показателей магистральных сосудов на развитие ишемии головного мозга у молодых пациентов, по всей видимости, за счет хорошей компенсации и неизмененной сосудистой выстилки в этой возрастной группе. Большего внимания заслуживает изучение влияния нарушений венозного оттока на интракраниальном уровне на развитие ишемических событий.
По данным электроэнцефалограммы, в нашем исследовании выявлена высокая частота функциональных нарушений регуляции головного мозга на разных уровнях, однако эти изменения не связаны с ишемией головного мозга у пациентов молодого возраста.
ЗАКЛЮЧЕНИЕ
Проведенное исследование позволяет сделать вывод о том, что выраженная НДСТ влияет на развитие церебральной ишемии, поэтому коррекция диспластического процесса может стать важным звеном в профилактике и лечении хронических ишемических событий в головном мозге, а также различных неврологических и непсихотических психических заболеваний, таких как синдром вегетативной дисфункции и тревожно-депрессивный синдром, у лиц молодого возраста.
Полученные результаты позволяют рассматривать выраженную НДСТ в качестве независимого фактора риска развития ХИГМ.



