ВВЕДЕНИЕ
Сахарный диабет (СД) оказывает неблагоприятное воздействие на скелетную мускулатуру, приводя к развитию вторичной диабетической миопатии, которая характеризуется снижением силы, мышечной массы, а также патоморфологическими изменениями мышц [1–4]. Дыхательные мышцы являются одним из важнейших компонентов системы дыхания, и их недостаточная работа может приводить к клинически значимым нарушениям вентиляции легких [5].
Однозначной точки зрения относительно наличия и преобладания того или иного типа нарушения вентиляции легких у больных СД нет. В ряде работ упоминалось, что при этом заболевании не выявляются изменения спирометрических показателей [6, 7]. По мнению других авторов, при СД изменения вентиляции легких могут протекать с развитием обструктивного или рестриктивного паттерна, которые сопровождаются снижением газообмена [8–12]. Учитывая, что осложнения диабета связаны с его длительностью, вызывает интерес изучение силы дыхательных мышц у пациентов с разной продолжительностью этого заболевания.
Цель исследования – оценить изменение функции внешнего дыхания у больных СД 2-го типа с наличием вторичной диабетической миопатии.
МАТЕРИАЛ И МЕТОДЫ
Исследование было одобрено локальным этическим комитетом ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России. В соответствии с критериями включения и исключения были обследованы 87 человек:
- основную группу исследования образовали 47 больных СД 2-го типа;
- в группу сравнения, рандомизированную с основной группой по возрасту, вошли 40 пациентов без нарушений углеводного обмена.
Диагноз СД устанавливался согласно Алгоритмам специализированной медицинской помощи больным сахарным диабетом (9-й выпуск, 2019 г.) [13].
Критерии включения в исследование: возраст 30–69 лет; СД 2-го типа; способность к выполнению дыхательных маневров при проведении респираторной нагрузочной пробы; информированное добровольное согласие на участие в исследовании.
Критерии исключения: инфаркт миокарда и острое нарушение мозгового кровообращения в анамнезе; сложные нарушения ритма сердца; хроническая сердечная недостаточность IIБ–III стадии; острые и хронические заболевания дыхательной системы; патологические формы и деформации грудной клетки; операции на органах грудной клетки; заболевания центральной нервной системы и периферической нервной системы, сопровождающиеся нарушением нервно-мышечной проводимости; применение лекарственных средств, замедляющих нервно-мышечную проводимость; ожирение 3-й степени (индекс массы тела >40 кг/ м2); отказ от участия в исследовании.
С учетом длительности течения СД 2-го типа пациенты были разделены на 2 подгруппы: 1-я – 29 человек с длительностью заболевания менее 5 лет; 2-я – 18 человек с длительностью заболевания более 5 лет.
Исследование параметров вентиляции легких выполнялось на компьютерном спирографе СМП-21/01-«Р-Д» («Монитор», Россия). Определение силы дыхательных мышц производилось путем измерения максимальных уровней статичного давления на уровне полости рта, которые пациент создает во время максимального вдоха (максимальное инспираторное давление, maximal inspiratory pressure, MIP) и максимального выдоха (максимальное экспираторное давление, maximal expiratory pressure, MEP) при закрытых дыхательных путях, согласно руководству Американского торакального общества (American Thoracic Society)/ Европейского респираторного общества (European Respiratory Society) от 2002 г. [14], с помощью прибора для измерения силы дыхательных мышц MicroRPM (Micro Medical Ltd., Великобритания). Пробы прекращали после достижения различий между тремя значениями менее 10%. Для анализа использовались максимальные значения MIP и MEP, полученные в результате выполнения трех попыток. Значения MIP и MEP более 80 см вод.ст. свидетельствовали о сохраненной силе дыхательных мышц [15]. В зависимости от результатов этого теста включенные в исследование больные СД были разделены на 2 подгруппы: 1-я – 25 пациентов с выявленной слабостью инспираторных мышц; 2-я – 22 пациента с сохраненной силой инспираторных мышц.
Статистический анализ материала осуществлялся с использованием непараметрических методов в пакете прикладных программ STATISTICA 10 (StatSoft, Russia). Достоверными считались показатели при р <0,05. Данные представлены в виде Me (Q1; Q3). Для оценки достоверности различий между группами применялся критерий Манна–Уитни, корреляционный анализ проводился с помощью коэффициента корреляции Спирмена (r).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Все обследованные пациенты были рандомизированы по возрасту. В 1-й группе средний возраст больных был 59 (54,5; 62) лет, во 2-й – 57 (50; 62) лет.
Среди сопутствующих патологий преобладали заболевания сердечно-сосудистой системы. Артериальная гипертония наблюдалась у всех пациентов обеих групп, частота ишемической болезни сердца (ИБС) и хронической сердечной недостаточности была незначительно выше в группе СД. Из осложнений СД в 1-й группе преобладала диабетическая полинейропатия (преимущественно сенсорная форма), кроме нее встречались ИБС, синдром диабетической стопы и диабетическая нефропатия. Средняя длительность СД у пациентов, попавших в 1-ю группу, составила 5 (2; 10) лет, средний уровень гликемии натощак – 7,9 (5,9; 9,0) ммоль/л, среднее значение гликированного гемоглобина – 7,4 (7,1; 7,8) %. Уровень креатинина среди исследованных больных СД равнялся 78,5 (72,0; 92,0) мкмоль/л, скорость клубочковой фильтрации – 89,5 (80,0; 98,0) мл/мин/1,73 м2; такие показатели свидетельствовали об отсутствии хронической почечной недостаточности.
Поскольку развитие осложнений при СД прямо связано с длительностью патологического процесса, нами был проведен анализ клинических характеристик пациентов СД с разной длительностью заболевания – до 5 лет и больше 5 лет. Больные с большим стажем диабета закономерно превосходили пациентов с продолжительностью болезни ≤5 лет по частоте развития осложнений СД и тяжести коморбидной патологии.
Средние значения показателей MIP и MEP в обеих группах исследования были выше 80 см вод. ст., однако у больных СД медиана MIP оказалась на 28,6% ниже, чем у пациентов без нарушений углеводного обмена. Это говорит о сниженной, по сравнению с пациентами без СД, силе инспираторных мышц в 1-й группе (табл. 1).

При анализе показателей силы дыхательных мышц у больных СД с разной длительностью заболевания наблюдались более низкие значения показателя MIP у пациентов со стажем СД более 5 лет (табл. 2). При этом показатель медианы MIP во 2-й подгруппе был не только на 19,8% ниже, чем в 1-й подгруппе, но и на 6,3% ниже должного значения. Таким образом, можно предположить, что при СД уменьшается сила инспираторных мышц, причем при длительном течении заболевания (свыше 5 лет) развивается их слабость.
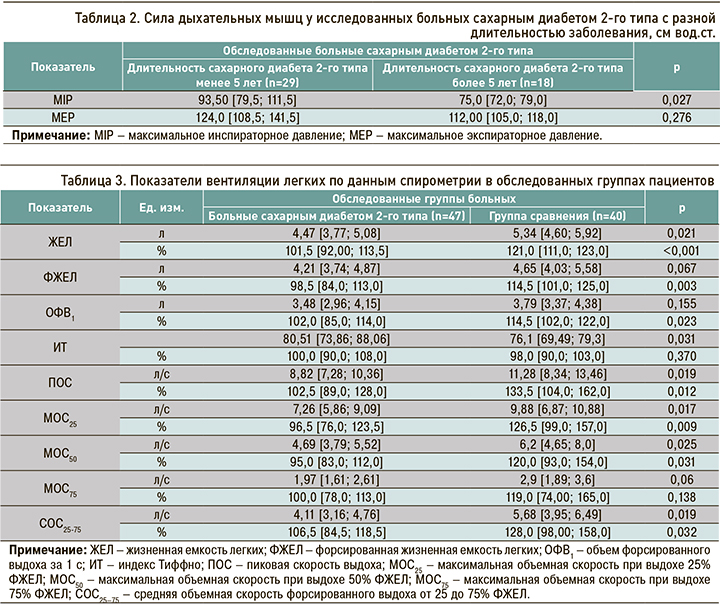
Абсолютные и относительные значения показателей вентиляции легких у исследованных пациентов представлены в таблице 3. В обследованных группах не было выявлено вентиляционных нарушений, что подтверждалось данными спирометрии, находившимися в пределах референсных значений. Вместе с тем у больных СД наблюдались более низкие, чем у пациентов без нарушений углеводного обмена, показатели вентиляции легких. Так, в 1-й группе исследования по сравнению со 2-й группой показатель жизненной емкости легких (ЖЕЛ) был ниже на 16,1% (р <0,001), форсированной жизненной емкости легких (ФЖЕЛ) – на 14% (р=0,003), объем форсированного выдоха за 1 с (ОФВ1) – на 10,9% (р=0,023). Скоростные показатели так же оказались ниже у больных СД: пиковая скорость выдоха (ПОС) и максимальная объемная скорость при выдохе 25% (МОС25) – на 23% (р <0,05), максимальная объемная скорость при выдохе 50% (МОС50) – на 20,8% (р=0,031), средняя объемная скорость форсированного выдоха от 25 до 75% (СОС25–75) – на 16,8% (р=0,032). При этом индекс Тиффно (ИТ) у больных СД был на 5,8% выше относительно группы сравнения (р=0,031), что связано с более низким уровнем показателя ЖЕЛ в 1-й группе.
Кроме того, показатели спирометрии были проанализированы в зависимости от длительности СД. У больных со стажем заболевания свыше 5 лет были обнаружены более низкие относительно пациентов с меньшей продолжительностью диабета показатели МОС25 (на 29,4%, р=0,012) и МОС50 (на 16,9%, р=0,048; табл. 4). Снижение значений этих параметров среди больных СД с большей длительностью заболевания свидетельствует об ухудшении у них вентиляции на уровне крупных и средних бронхов.
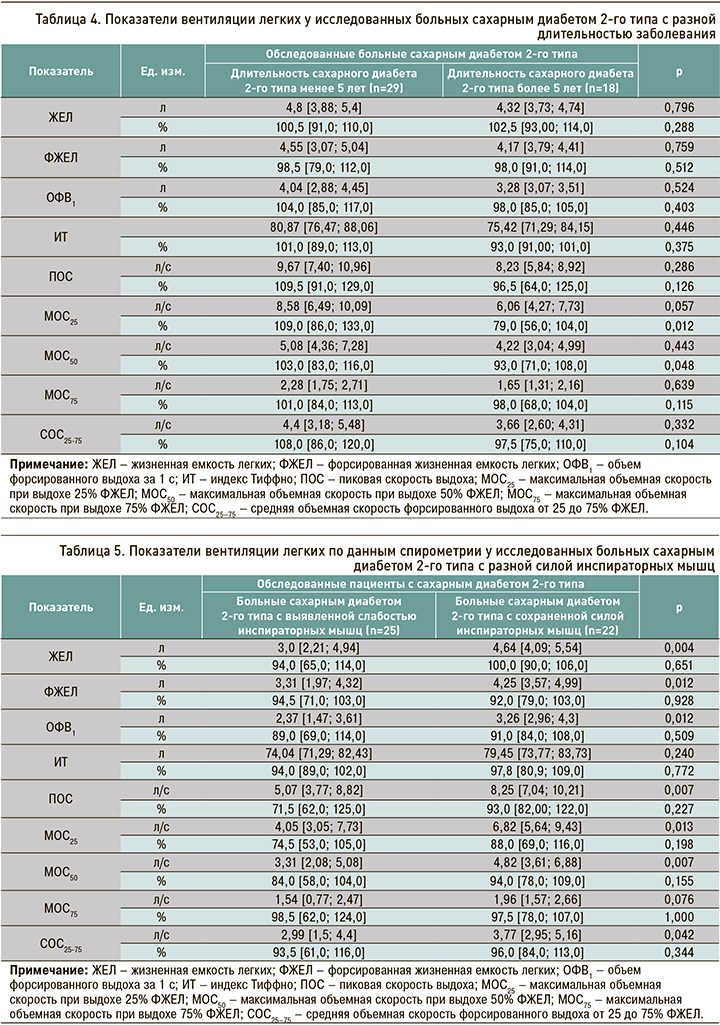
Легочная вентиляция сравнивалась нами и у больных СД с разным уровнем силы инспираторных мышц (табл. 5). У пациентов с диагностированной слабостью этих мышц были обнаружены более низкие абсолютные показатели спирометрии. Так, показатель ЖЕЛ в этой подгруппе был ниже относительно 1-й подгруппы на 35,3%, ФЖЕЛ – на 22,1%, ОФВ1 – на 27%, ПОС – на 38,5%, МОС25 – на 40,6%, МОС50 – на 31,3%, СОС25–75 – на 20,7%.
Таким образом, в группе пациентов с СД наблюдались более низкие показатели спирометрии по сравнению с больными без нарушения углеводного обмена. При увеличении длительности заболевания происходило ухудшение скоростных показателей. Кроме того, у больных СД с выявленной слабостью инспираторных мышц к изменениям скоростных динамических показателей присоединялись и сниженные статические показатели вентиляции легких.
Проведенный корреляционный анализ выявил в группе участников исследования с СД статистически значимые положительные корреляционные связи между спирометрическими данными и показателями MIP и МЕР (табл. 6).
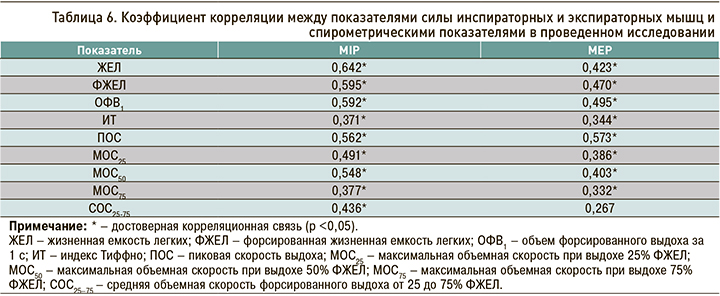
Обнаруженные изменения силы дыхательных мышц позволили предположить, что по мере снижения этой силы будет наблюдаться ухудшение вентиляции легких из-за нарушений механики дыхания. Это и было подтверждено при изучении данных спирометрии. Если у больных СД по сравнению с пациентами без нарушения углеводного обмена отмечались более низкие показатели спирометрии, находившиеся в обеих группах в пределах референсных значений, то по мере увеличения длительности заболевания более 5 лет нарастало ухудшение скоростных показателей. В дальнейшем при возникновении вторичной миопатии дыхательных мышц у больных СД с выявленной слабостью инспираторных мышц к изменениям скоростных динамических показателей присоединялось и снижение статических объемных показателей вентиляции легких. Положительная корреляционная связь между показателями силы инспираторных и экспираторных мышц со спирометрическими показателями при СД свидетельствовала о прямом влиянии изменений силы дыхательных мышц на вентиляцию легких.
ЗАКЛЮЧЕНИЕ
1. Длительное течение СД 2-го типа (более 5 лет) приводит к развитию вторичной диабетической миопатии, характеризующейся развитием слабости инспираторных мышц.
2. При стаже СД 2-го типа более 5 лет и возникновении вторичной диабетической миопатии происходит снижение показателей вентиляции легких.



