ВВЕДЕНИЕ
До 70% пациентов, которым назначают пероральные препараты железа, сообщают о побочных эффектах со стороны желудочно-кишечного тракта (ЖКТ). Наиболее часто пациентов при этом беспокоят тошнота, рвота, металлический привкус во рту, боли в эпигастрии, метеоризм, запор, диарея. В результате этого снижается комплаентность пациентов, что приводит к снижению эффективности фармакотерапии [1]. В связи с этим профессиональное сообщество рассматривает ряд стратегий, которые позволяют повысить переносимость пероральных препаратов железа. Основное направление – изменение режима дозирования путем снижения однократно принимаемой дозы или переход к применению препаратов с меньшим содержанием элементарного железа, увеличение интервала между приемом лекарственного препарата, введение интермиттирующего режима дозирования. Широко применяются технологические способы повышения переносимости фармакотерапии препаратами железа в виде выпуска жидких лекарственных форм для перорального приема и/ или лекарственных средств с модифицированным высвобождением, что способствует снижению повреждающего действия железа на ЖКТ [2]. Комбинированные лекарственные формы железа с фолиевой кислотой не только повышают эффективность, но и способствуют повышению безопасности фармакотерапии железодефицита [3].
ПРЕИМУЩЕСТВА ПРИМЕНЕНИЯ ЖЕЛЕЗА СУЛЬФАТА
Согласно действующим клиническим рекомендациям, в качестве препаратов первой линии лечения железодефицитных состояний рассматриваются лекарственные формы для перорального приема.
Терапия железодефицитных состояний заключается в применении препаратов железа в количестве, необходимом для нормализации уровня гемоглобина (у женщин – 120–140 г/л, у мужчин – 130–160 г/л) и восполнения тканевых запасов железа (ферритин сыворотки >40–60 мкг/л) [4]. Для лечения и профилактики используются пероральные препараты двухвалентного (код В03АА по АТХ-классификации) или трехвалентного железа (код В03АВ по АТХ классификации). Среди двухвалентных соединений наиболее часто применяется железа сульфат. Процент всасывания железа из сульфатных соединений наиболее высок по сравнению с другими солями железа. Систематический обзор, включивший 111 исследований с данными о 10 695 пациентах, в котором проводился анализ переносимости различных соединений Fe, показал, что частота нежелательных явлений при приеме глюконата железа составила 30,9%, сульфата железа без мукопротеозы – 32,3%, фумарата железа – 47,0%. Для сукцинилата протеина железа и глицинсульфата железа, имеющих кишечнорастворимую оболочку, частота нежелательных явлений составила 7,3 и 23,5% соответственно. Самая низкая частота побочных эффектов была установлена для сульфата железа с мукопротеозой: 4,1% для всех нежелательных явлений и 3,7% для желудочно-кишечных [5].
Высокий риск возникновения побочных эффектов, интоксикации железом при терапии содержащими его солевыми препаратами обусловлен механизмом всасывания Fe2+ путем пассивной диффузии. Хотя заместительная терапия дефицита железа с помощью солевых препаратов железа является достаточно эффективной, высокий риск развития тяжелых побочных реакций снижает их терапевтические возможности. Выход из ситуации был найден в снижении дозы солевых препаратов железа, что существенно уменьшает частоту побочных явлений [6].
НИЗКИЕ ДОЗЫ КАК СТРАТЕГИЯ ПОВЫШЕНИЯ БЕЗОПАСНОСТИ ПРИ ФАРМАКОТЕРАПИИ ЖЕЛЕЗОДЕФИЦИТА
В соответствии с рекомендацией Всемирной организации здравоохранения (ВОЗ) оптимальная доза железа для лечения железодефицитной анемии (ЖДА) составляет 120 мг/сут, для лечения латентного дефицита железа – 60 мг, для профилактики железодефицита – 30–60 мг/сут [7].
Решение коллегии Евразийской экономической комиссии «Об утверждении Руководства по установлению допустимых пределов воздействия на здоровье в целях идентификации рисков при производстве лекарственных средств на общих производственных (технологических) линиях от 14.01.2020» дает ряд важных определений и понятий, которые лежат в основе современной стратегии лекарственного обеспечения.
«Доза, не оказывающая видимого нежелательного эффекта» (No-Observed Adverse Effect Level, NOAEL) – наибольшая концентрация или количество действующего вещества, не оказавшее в эксперименте нежелательного влияния на морфологию, функционирование, рост, развитие или продолжительность жизни организма-мишени при заданных условиях экспозиции (масса активной фармацевтической субстанции в мг/кг массы тела).
«Наименьшая доза, оказывающая явный нежелательный эффект» (Lowest Observed Adverse Effect Level, LOAEL) – наименьшая концентрация или количество действующего вещества, оказавшее в эксперименте нежелательное влияние на морфологию, функционирование, рост, развитие или продолжительность жизни организма-мишени при заданных условиях экспозиции.
Для соединений железа значение NOAEL составляет от 18 до 65 мг/сут. Значение LOAEL (наименьший уровень воздействия, при котором наблюдаются нежелательные эффекты, Lowest Observable Adverse Effect Level) определено на уровне 60 мг/ сут для солей железа и 70 мг/сут для других соединений [8].
Согласно действующим отечественным клиническим рекомендациям, рекомендовано использовать дозы препаратов железа нижнего диапазона. Более высокие дозировки потенциально усиливают побочные эффекты из-за избытка неабсорбированного железа, остающегося в ЖКТ. Формируется мнение, что разовая суточная доза 40–60 мг или несколько более высокая дозировка (80–100 мг) в альтернирующем режиме (через день) является предпочтительным режимом дозирования для уменьшения побочных эффектов и оптимизации доли поглощенного элементарного железа [9, 10].
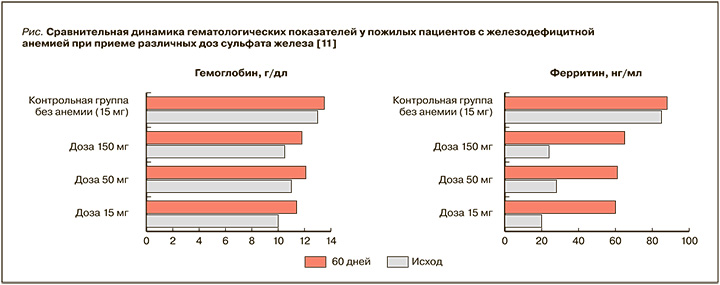
Предположение о том, что желаемый эффект может достигаться назначением препаратов с меньшим содержанием элементарного железа, что обеспечивает оптимальную биодоступность и меньший риск развития побочных эффектов, подтверждается рядом клинических испытаний. Наибольший интерес представляют результаты рандомизированного исследования, в которое вошли 90 больных ЖДА в возрасте старше 80 лет. После приема в течение 2 мес пероральных препаратов железа, содержащих 15, 50 и 150 мг элементарного железа, темпы повышения показателей гемоглобина и ферритина были примерно одинаковыми и не зависели от дозы (рис.). При этом частота побочных эффектов была значительно меньше при назначении препаратов железа с более низким содержанием элементарного железа. Так, уровень гемоглобина повысился с 10,0 до 11,3 г/ дл при терапии железом в дозе 15 мг/сут и с 10,2 до 11,6 г/дл – при 150 мг/сут. Дискомфорт в животе, тошнота, рвота, изменения в опорожнении кишечника и черный стул значительно чаще наблюдались при применении более высоких доз железа. Исследователи сделали вывод, что лечение низкими дозами железа эффективно у пожилых пациентов с ЖДА. Такой режим может заменить обычно используемые более высокие дозы и значительно уменьшить нежелательные явления терапии [11].
СХЕМЫ НАЗНАЧЕНИЯ ПЕРОРАЛЬНЫХ ПРЕПАРАТОВ ЖЕЛЕЗА
В настоящее время накапливаются доказательства того, что применение препаратов железа в низких дозах короткими курсами (2 нед в месяц) или альтернирующими режимами (через день в течение месяца) имеет более высокую эффективность и меньшую частоту нежелательных явлений, чем применявшиеся ранее препараты железа в высоких дозах, в том числе в виде повторных (2–3 раза/сут) приемов [7].
Поскольку клетки кишечника ограниченно могут усваивать железо, а их обновление происходит каждые 5–6 дней, прием дозы препарата через день приводит к улучшению всасывания перорального железа, так как дает доступ к ионам металла новым эпителиальным клеткам. При снижении концентрации свободных ионов железа уменьшается риск развития оксидативного стресса. Все это также сокращает частоту и выраженность побочных эффектов со стороны ЖКТ.
Проведенные в последнее время исследования абсорбции железа и влияющих на нее факторов при наличии железодефицита могут служить поводом для пересмотра традиционных схем назначения препаратов железа. Как известно, абсорбция железа регулируется белком гепсидином, продуцирующимся в печени. В исследовании Moretti D. et al. (2015) проводилась оценка абсорбции железа, меченного радиоактивным изотопом, у женщин с наличием железодефицита (ферритин менее 20 нг/ мл) при отсутствии анемии на фоне приема пероральных препаратов железа в разной дозировке (от 40 до 80 мг элементарного Fe). Показано, что при более высокой дозе и частом приеме препаратов железа повышается уровень гепсидина, что ведет к снижению абсорбции железа. Повышенный уровень гепсидина сохраняется около 48 ч после однократного приема препарата железа, в связи с чем абсорбция этого микроэлемента после приема очередной дозы препарата через 1 сут снижается под влиянием еще сохраняющегося повышенного уровня гепсидина. Однако полученные данные требуют подтверждения и уточнения, поскольку исследование проводилось у женщин с наличием железодефицита без анемии, которые могут отвечать на препарат железа иначе, чем больные с манифестной ЖДА. Тем не менее эти результаты представляются принципиально важными, поскольку могут менять парадигму режима дозирования препаратов железа (суточная доза и кратность приема) у больных ЖДА. Возможно, эффект может достигаться назначением препаратов железа с меньшим содержанием элементарного железа и с бόльшим интервалом приема (через день), что обеспечивает оптимальную биодоступность и меньший риск развития побочных эффектов [12].
Последующие рандомизированные исследования женщин с дефицитом железа, с анемией или без нее, также задокументировали улучшение всасывания железа при дозировании через день по сравнению с ежедневным приемом. Например, в исследовании 2017 г., в котором 40 женщин были случайным образом распределены на прием железа перорально (60 мг FeSO4) 1 раз/сут в течение 14 дней или 1 раз через день в течение 28 дней (та же кумулятивная доза), второй режим терапии приводил к большей абсорбции железа (131 против 175 мг всего). В группе, принимавшей лекарственное средство через день, наблюдалась тенденция к уменьшению тошноты; при этом частота возникновения запора в этом исследовании не оценивалась [13].
КОМБИНАЦИЯ С ФОЛИЕВОЙ КИСЛОТЫ КАК СПОСОБ ПОВЫШЕНИЯ БЕЗОПАСНОСТИ ФАРМАКОТЕРАПИИ ПРЕПАРАТАМИ ЖЕЛЕЗА
Эффекты совместного применения железа и фолиевой кислоты, в том числе в условиях дефицита Fe, пока остаются недостаточно изученными. Интерес представляет проведенное исследование по содержанию железа в печени, почках, сердце, селезенке и поджелудочной железе у экспериментальных животных при пероральном приеме железа, фолатов и железа совместно с фолатами. Экспериментальные животные были разделены на две группы: первая группа (Д) получала рацион дефицитный по железу и фолатам (полусинтетический рацион на основе рациона AIN-93M), вторая (С) – стандартную диету (содержание железа 56 мг/кг, фолиевой кислоты – 2 мг/ кг). По истечении 28 дней на втором этапе первая группа на дефицитной диете была разделена на группы животных, получавших дополнительно 150 мг железа/кг рациона (Fe); фолиевую кислоту 6 мг/ кг рациона (Fol); 150 мг железа/кг и фолиевую кислоту 6 мг/кг рациона (Fe + Fol). Содержание железа в тканях определялось с помощью пламенной атомно-абсорбционной спектрометрии (атомно-абсорбционный спектрофотометр ZA3000, Хитачи, Токио, Япония; табл.) [14].

Полученные результаты продемонстрировали, что значительное влияние на принимаемой одновременно с железом фолиевой кислоты на концентрацию железа в тканях печени, селезенки и поджелудочной железы было выявлено на 10-й день наблюдения и усилилось к 21-му дню. Авторы сделали вывод о влиянии фолиевой кислоты на распределение железа в организме, особенно при длительном приеме, что способствует повышению безопасности фармакотерапии препаратами железа. Повышенное накопление Fe в мягких тканях оказывает на них повреждающее действие. Избыточное накопление железа в печени ассоциировано с развитием фиброза, цирроза, а в некоторых случаях – злокачественных новообразований печени [15].
Фолиевая кислота уменьшает воспалительные процессы в печени и печеночный стеатоз [16]. При этом в случае низких концентраций фолиевой кислоты в сыворотке крови может усугубляться повреждение этого органа [17]. Fe-зависимое повреждение связано с окислительным стрессом, катализируемым железом [18].
Ряд клинических исследований показал, что пероральные препараты железа улучшают статус пациентов по гематологическим показателям, но также усиливают окислительный стресс даже у женщин с низкими запасами железа [19, 20].
В экспериментальном исследовании Wahyuwibowo J. et al. (2020) было выполнено изучение влияния применения комбинации железа и фолиевой кислоты в течение 20 дней на уровни метилмалонового диальдегида (МДА), глюкозы, креатинина и содержание эритроцитов. Среди экспериментальных животных контрольная группа не получала дополнительно железо и фолиевую кислоту, группа 1 получала 1,8 мг железа и 2,3 мкг фолиевой кислоты, группа 2 – 3,6 мг железа и 4,5 мкг фолиевой кислоты, группа 3 – 5,4 мг железа и 6,8 мкг фолиевой кислоты на 200 г массы тела. Максимальная доза, использованная в эксперименте, была эквивалентна обычно применяемым у беременных женщин в Индонезии дозировкам, – 200 мг сульфата железа (эквивалентно 60 мг элементарного Fe) и 400 мкг фолиевой кислоты. Уровень окислительного стресса был самым низким в группе 3, получавшей дозу, соответствующую рекомендуемой, самым высоким – в контрольной группе (МДА 5,94±0,71 против 2,34 ±0,31 ммоль/л; р <0,001). Также в группе 3 при контрольном обследовании был выявлен самый низкий уровень креатинина, глюкозы и наибольшее число эритроцитов (р <0,001). Полученные результаты свидетельствуют об оптимизации деятельности антиоксидантной системы при применении комбинации железо + фолиевая кислота, что предупреждает повреждение белков, липидов, ДНК и профилактирует нарушения в работе сигнальной клеточной системы [21].
Полученные результаты, указывающие на наиболее высокий уровень МДА и глюкозы в контрольной группе, не получавшей железо и фолиевую кислоту, согласуются с ранее полученными экспериментальными данными о том, что уровень окислительного стресса и воспалительные процессы играют ключевую роль в физиологических и патофизиологических процессах, связанных с инсулинорезистентностью и прогрессированием сахарного диабета 2-го типа. Увеличение количества свободных радикалов может вызвать воспалительную реакцию с последующей миграцией и инфильтрацией макрофагов в периферические ткани, включая поджелудочную железу, печень и жировую ткань [22].
Как дефицит железа, так и перегрузка железом при длительной фармакотерапии значимо влияют на состояние антиоксидантной системы организма. Фолиевая кислота – витамин, который имеет большое значение в эпигенетических механизмах, определяющих изменения в экспрессии генов. Дефицит фолиевой кислоты способствует усугублению повреждающего действия оксидативного стресса, так как приводит к снижению продукции метионина, что, в свою очередь, влечет за собой уменьшение выработки природных антиоксидантов (глутатиона) и аминокислот, содержащих серу (таурина и цистеина). Протективный эффект фолиевой кислоты при одновременном приеме с железом ассоциирован с ее способностью регулировать транскрипцию генов, связанных с окислительным стрессом печени, активностью 5’-ампактивированной протеинкиназы (AMPK), влиянием на активность переносчиков ионов двухвалентного железа (DMT1) и ZRT/IRT-подобный белок [23, 24].
ФОРМЫ ВЫПУСКА И ТЕХНОЛОГИИ ПРОИЗВОДСТВА ПРЕПАРАТОВ ЖЕЛЕЗА
Препараты Fe2+ для перорального приема обладают более высокой биодоступностью (30–40%) по сравнению с препаратами, содержащими Fe3+, чья иодоступность составляет около 10%. Более высокая биодоступность обеспечивает более высокую клиническую эффективность препаратов Fe2+: время, необходимое для нормализации уровня гемоглобина при их приеме варьирует от 2 нед до 2 мес (при использовании препаратов трехвалентного железа – в среднем 2–4 мес); насыщение депо железа – в течение 3–4 мес (против в среднем 5–7 мес у препаратов Fe3+) [25, 26].
При этом результаты сравнительных клинических исследований во всех группах пациентов (взрослые и дети различных возрастных групп с ЖДА, беременные женщины на разном сроке гестации) продемонстрировали большее количество нежелательных явлений при применении препаратов двухвалентного железа [27].
В связи с этим производители применяют различные технологические способы повышения безопасности данной группы лекарственных средств. На рынке представлены жидкие лекарственные формы препаратов железа для перорального приема. В связи с тем что в них элементарное железо находится уже в растворенном состоянии, происходит равномерное распределение лекарственного средства по слизистой ЖКТ и увеличение поверхности всасывания, создаются меньшие локальные концентрации железа, достигается более плотный контакт с ворсинками кишечника, что обеспечивает наилучшую способность солевого соединения к всасыванию при минимальном повреждающем действии на ЖКТ [28].
Следующим этапом повышения безопасности препаратов, содержащих железо, стала разработка лекарственных форм с модификацией скорости и места высвобождения. На сегодняшний день оптимальным соотношением «эффективность/безопасность» обладают лекарственные препараты сульфата железа с модифицированным высвобождением. Постепенный выход железа по мере транспортировки лекарственной формы через ЖКТ, с одной стороны, уменьшает его повреждающее действие на слизистые оболочки и соответственно снижает частоту нежелательных явлений, а с другой, способствует повышению биодоступности за счет увеличения площади всасывания.
При производстве препаратов железа в основном применяются матриксные системы. Скорость высвобождения Fe2+ зависит от характеристик препарата, которые определяются в том числе и используемыми вспомогательными веществами. В том случае, если активное вещество высвобождается путем диффузии, не всегда удается обеспечить равномерное высвобождение и поступление лекарственного средства в кровь. Более надежными являются системы резервуарного типа, которые состоят из оболочки (мембраны), образующей резервуар, и ядра, в котором находится активное действующее вещество. Такая технология используется при производстве препарата Ферро-Фольгамма Нео® (ООО Верваг Фарма, Германия).
В созданной лекарственной форме сульфат железа содержится в ядре таблетки. Также в ядре находится используемая в качестве вспомогательного компонента аскорбиновая кислота, покрытая специальной оболочкой с открытыми порами, обеспечивающими реализацию антиоксидантного эффекта. Аскорбиновая кислота защищает железо в двухвалентной форме (Fe2+) от окисления в трехвалентную форму (Fe3+) в щелочной среде двенадцатиперстной кишки. На ядро таблетки (содержащее сульфат железа и аскорбиновую кислоту, покрытую оболочкой) наносится изолирующий слой, затем – кишечнорастворимая оболочка из соединений акриловой кислоты, хорошо известных в фармацевтическом производстве своей пригодностью для нанесения оболочек, резистентных к кислотной среде желудка. Попадая в ЖКТ, производные акриловой кислоты образуют в кислой среде нерастворимый гелевый слой. При более высоких значениях рН (например, в слабощелочной среде) они переходят в растворимую форму, высвобождая тем самым лекарственные вещества из ядра таблетки [29].
Поверх кишечнорастворимой акриловой оболочки наносится слой, содержащий фолиевую кислоту (т.е. витаминосодержащий слой). Таким образом, это соединение находится в дополнительном слое снаружи кишечнорастворимой оболочки. В комбинированных препаратах железа фолиевую кислоту следует отделять от FeSO4, так как птеридиновая часть фолиевой кислоты имеет тенденцию образовывать комплексы с ионами металлов. Между компонентами наносится слой кишечнорастворимого покрытия, который выполняет две функции: отделяет фолиевую кислоту и сульфат железа друг от друга и обеспечивает высвобождение FeSO4 не в желудке, что снижает количество нежелательных явлений со стороны ЖКТ.
Использование в составе вспомогательных компонентов небольшого количества аскорбиновой кислоты, покрытой оболочкой, в качестве восстанавливающего вещества (антиоксиданта) и катализатора окислительно-восстановительного процесса так же способствует снижению количества нежелательных реакций со стороны ЖКТ.
В результате лекарственные формы с модифицированным высвобождением позволяют решать все основные задачи по оптимизации фармакотерапии: изменять скорость, продолжительность и место высвобождения лекарственного вещества, а также интенсивность терапевтического эффекта.
ЗАКЛЮЧЕНИЕ
Количественный и качественный состав лекарственных препаратов железа сильно варьирует: двух- и трехвалентные соединения, высоко- и низкодозированные, односоставные и комбинированные, немедленного и модифицированного высвобождения. Все препараты предназначены для проведения длительной заместительной терапии, в связи с чем одним из ключевых факторов ее эффективности является комплаентность пациента. Ключевые стратегии повышения безопасности фармакотерапии железодефицита обеспечивают снижение частоты и выраженности нежелательных явлений и способствуют повышению эффективности фармакотерапии железодефицитных состояний.



