Сердечно-сосудистые заболевания (ССЗ) являются причиной 38% всех летальных исходов в Северной Америке и самой частой причиной смерти европейских мужчин в возрасте до 65 лет и второй по частоте причиной у женщин. Оценка и модификация корректируемых факторов риска ССЗ (гипертония, ожирение, курение) эффективно уменьшает риск сердечно сосудистых событий. Метаболический синдром (МС), также известный как синдром X или синдром инсулинорезистентности (ИР), представляет собой сочетание различных расстройств обмена веществ, каждое из которых является независимым фактором риска ССЗ. Наличие МС ассоциируется с повышенным риском ССЗ и сахарным диабетом (СД) 2 типа. Идентификация МС в комбинации с оценкой 10-летнего риска ССЗ может использоваться для выделения групп пациентов, которые нуждаются не только в модификации образа жизни, но и в специфической медикаментозной терапии.
Многочисленные эпидемиологические исследования показали, что пациенты с хроническими ревматическими болезнями имеют высокий риск ССЗ, а также более высокую заболеваемость и смертность от ССЗ. Однако ответственные за это патогенетические факторы полностью еще не установлены. МС может обеспечивать при этих заболеваниях дополнительную связь между прогрессированием атеросклероза и активным воспалением.
Еще в 1988 г. Ревен определил ИР как центральный механизм СД 2 типа, артериальной гипертензии (АГ), коронарной болезни сердца [1–4]. В последующие годы были изучены связь между ИР, отдельными метаболическими нарушениями и их вклад в риск ССЗ. МС рассматривается как независимый фактор риска ССЗ и атерогенеза за счет увеличения содержания свободных жирных кислот, триглицеридов (ТГ), снижения уровней холестерина (ХС) липопротеидов высокой плотности (ЛПВП) и аполипопротеина B, а также наличия абдоминального ожирения, ИР, нарушений углеводного обмена и АГ [5–9]. Однако, несмотря на многочисленные исследования и полученные достоверные данные о роли отдельных метаболических нарушений в патогенезе ССЗ, до сих пор существуют разногласия в определении параметров, оптимально отражающих наличие МС. Так, в настоящее время существуют три основные дефиниции МС, предложенные Всемирной организацией здравоохранения (ВОЗ), Национальной образовательной программой по холестерину (оригинальные и модифицированные) и критерии Международной федерации диабета (МФД). Хотя эти критерии широко распространены, до сих пор ведутся дебаты относительно отдельных из них. Так, наибольшую критику вызывает снижение критерия абдоминального ожирения для мужчин – окружности талии (ОТ) со 102 до 94 см в рекомендациях МФД [10]. Как выяснилось, данное занижение показателей привело к увеличению числа пациентов с МС в эпидемиологических исследованиях, в то время как частота ССЗ и, что более важно, смертность от ССЗ значительно выше именно среди пациентов с ОТ более 102 см [11–14].
В настоящее время в России приняты рекомендации Всероссийского научного общества кардиологов по диагностике и лечению МС, при этом для установки диагноза применяются именно критерии МФД с некоторыми дополнениями [15].
Несмотря на то, что связи между подагрой и АГ, почечной недостаточностью, кардиоваскулярной патологией изучаются с конца XIX столетия, в конце XX века вновь возник интерес к изучению этой проблемы, но уже в свете основных приоритетов современной медицины, а именно в плане снижения заболеваемости и смертности от ССЗ. Так, в ряде клинических исследований показаны корреляции между МС и АГ, ИР, СД и подагрой. В 2007 г. H.K. Choi и соавт. [16] на основании обзора данных NHANES III оценили взаимосвязь МС и подагры. МС был выявлен у 62,8% пациентов с подагрой и только у 25,4% без данного заболевания, при этом распространенность МС была главным образом связана с высокой выявляемостью АГ, избыточной массы тела и СД. Кроме того, распространенность МС при подагре увеличивалась с возрастом пациентов и составила 70% в группе больных старше 40 лет. В одном из исследований H.G. Yoo и соавт. [17] показали, что частота выявления ИР среди больных с подагрой на 35% выше, чем в группе пациентов без нее.
 Помимо очевидной связи МС и синдрома ИР с подагрой, в последнее десятилетие довольно широко изучается связь гиперурикемии (ГУ) с отдельными компонентами МС. В первую очередь интересна взаимосвязь АГ и ГУ. По данным ряда исследований [18], АГ выявляется у 20–50% пациентов с подагрой, при этом среди 20–40% больных АГ выявляется подагрический артрит. Накоплены данные о связи этих синдромов, однако, ранее АГ у пациентов с подагрическим артритом рассматривалась преимущественно в контексте патологии почек, развивающейся при наличии и подагры. В последнее время многочисленные лабораторные и клинические данные свидетельствуют о том, что ГУ, даже при отсутствии подагры, может вызывать повышение АД. Исследователи показали, что ГУ, во-первых, может вызывать прямую стимуляцию ренин-ангиотензиновой системы в почках, во-вторых, ингибирует сосудистый синтез NO, являющегося потенциальным вазодилататором, в-третьих, стимулирует пролиферацию гладкомышечных клеток в сосудистой стенке, тем самым усиливая вазоконстрикцию, в-четвертых, вызывает повреждение почек (интерстициальный нефрит или повреждение канальцев), косвенно приводя к развитию АГ [19–22]. Таким образом, роль ГУ в развитии АГ несомненна, однако изучение этой проблемы требует проведения более масштабных исследований среди пациентов с эссенциальной АГ и подагрой для решения вопроса о необходимости коррекции ГУ при отсутствии подагрического артрита.
Помимо очевидной связи МС и синдрома ИР с подагрой, в последнее десятилетие довольно широко изучается связь гиперурикемии (ГУ) с отдельными компонентами МС. В первую очередь интересна взаимосвязь АГ и ГУ. По данным ряда исследований [18], АГ выявляется у 20–50% пациентов с подагрой, при этом среди 20–40% больных АГ выявляется подагрический артрит. Накоплены данные о связи этих синдромов, однако, ранее АГ у пациентов с подагрическим артритом рассматривалась преимущественно в контексте патологии почек, развивающейся при наличии и подагры. В последнее время многочисленные лабораторные и клинические данные свидетельствуют о том, что ГУ, даже при отсутствии подагры, может вызывать повышение АД. Исследователи показали, что ГУ, во-первых, может вызывать прямую стимуляцию ренин-ангиотензиновой системы в почках, во-вторых, ингибирует сосудистый синтез NO, являющегося потенциальным вазодилататором, в-третьих, стимулирует пролиферацию гладкомышечных клеток в сосудистой стенке, тем самым усиливая вазоконстрикцию, в-четвертых, вызывает повреждение почек (интерстициальный нефрит или повреждение канальцев), косвенно приводя к развитию АГ [19–22]. Таким образом, роль ГУ в развитии АГ несомненна, однако изучение этой проблемы требует проведения более масштабных исследований среди пациентов с эссенциальной АГ и подагрой для решения вопроса о необходимости коррекции ГУ при отсутствии подагрического артрита.
Метаболические нарушения, развивающиеся при подагре вследствие ГУ и синдрома ИР, в особенности наиболее важные из них – АГ, нарушения липидного и углеводного обмена, ожирение, тесно ассоциированы с атеросклерозом и рассматриваются как независимые факторы риска ССЗ. Данный факт, несомненно, обязывает расценивать подагру как общемедицинскую проблему, для которой характерен высокий риск фатальных сердечно-сосудистых катастроф, связанных с атеросклерозом. Так, в 2000 г. ВОЗ причислила подагру к заболеваниям, тесно связанным с ожирением, таким как АГ, коронарный атеросклероз и СД 2 типа. Подагру можно рассматривать как метаболическое заболевание; данный факт подтверждается многочисленными исследованиями, выявившими высокую распространенность коморбидной патологии, в частности ССЗ, среди больных подагрическим артритом.
Помимо влияния ГУ на формирование коронарного атеросклероза, в ряде исследований показана тесная связь данного фактора с развитием атеросклеротического поражения сонных артерий, инсультом, преэклампсией и сосудистой деменцией [23, 24]. Общепринятое в течение более 30 лет положение о том, что ГУ является следствием, а не самостоятельной причиной ССЗ и высокой смертности от них, может быть подвергнуто сомнению с учетом вышеизложенных данных, что особенно актуально для пациентов с подагрой.
В данном исследовании нами были исследованы основные компоненты МС, такие как АГ, ожирение, нарушение углеводного обмена и липидного спектра, у пациентов с подагрой и в группе контроля.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 86 больных, из числа которых основную группу составили 56 пациентов с первичной хронической подагрой, диагностированной на основании классификационных критериев S. Walles [25], и МС. В группу сравнения вошли 30 добровольцев с МС без подагры и другого иммуновоспалительного процесса.
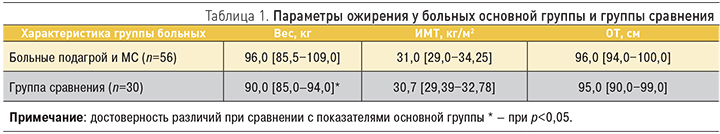
Согласно рекомендациям МФД, в качестве основного критерия МС рассматривается абдоминальное ожирение. Вес пациентов основной группы составил от 71,0 до 170,0 (медиана 96,0 [85,5–109,0]) кг, в группе изолированного МС – от 82,0 до 106,0 (медиана 90,0 [85,0–94,0]) кг. В основной группе величина индекса массы тела колебалась от 23,0 до 52,0 (медиана 31,0 [29,0−34,25]) кг/м2, в группе изолированного МС – от 29,05 до 40,39 (медиана 30,7 [29,39–32,78]) кг/м2. Основные параметры ожирения у больных представлены в табл. 1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Масса тела в группе больных МС без подагры оказалась достоверно ниже, чем в основной группе (p<0,05). Ожирение (ИМТ ≥30 кг/м2) в основной группе наблюдалось у 38 (67,85%) больных, в остальных случаях констатирован избыток массы тела. Распределение пациентов по степеням ожирения происходило следующим образом: ожирение I степени – у 26 (46,42%), II степени – у 8 (14,28%), III степени – 4 (7,14%) больных.
 В группе сравнения без подагры ожирение выявлено у 18 (60,00%) больных: I степень ожирения определена у 15 (50,00%), II степень – у 2 (6,66%), III степень – у 1 (3,33%) больного.
В группе сравнения без подагры ожирение выявлено у 18 (60,00%) больных: I степень ожирения определена у 15 (50,00%), II степень – у 2 (6,66%), III степень – у 1 (3,33%) больного.
Абдоминальный тип ожирения (ОТ >94см для мужчин и >80 см для женщин) одинаково часто выявлялся у пациентов с избытком массы тела в основной группе и группе МС без подагры. Необходимо отметить, что ожирение II и III степени чаще диагностировалось у пациентов с подагрой – 14,28 и 7,17% в сравнении с 6,66 и 3,33% для больных без подагрического артрита.
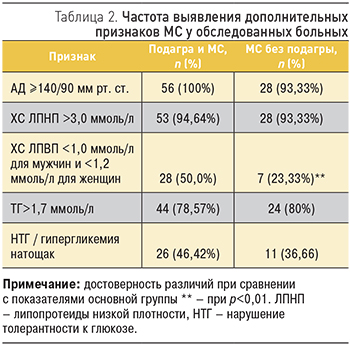
Распространенность дополнительных признаков МС была высокой в обеих сравниваемых группах и представлена в табл. 2.
Таким образом, АГ выявлялась у пациентов с МС независимо от наличия подагры (p<0,001). Гипертриглицеридемия с одинаковой частотой выявлялась в обеих группах, а снижение уровня ХС ЛПВП было более характерно для больных основной группы в сравнении с пациентами с изолированным МС (p<0,01). Как минимум 1 дополнительный признак МС был выявлен у всех обследованных больных. У 13 (23,21%) пациентов основной группы и 1 (3,33%) больного из группы МС без подагры были выявлены все 5 дополнительных признаков. У пациентов основной группы чаще выявлялось более 3 дополнительных признаков МС в сравнении с группой изолированного МС: 28 (50,00%) и 10 (33,30%) больных соответственно.
Также в рамках исследования для всех пациентов (86 человек) был оценен индивидуальный риск развития ССЗ по шкалам SCORE и PROCAM. К основным оцениваемым факторам риска, исходя из рекомендаций для данных шкал, относились возраст и пол пациентов, курение, уровень систолического артериального давления, наличие СД, наследственный анамнез ранних ССЗ, а также уровни общего ХС, ХС ЛПВП, ХС ЛПНП, ТГ. Значения SCORE и PROCAM у пациентов сравниваемых групп представлены в табл. 3.
Суммарный риск ССЗ по шкале SCORE у пациентов основной группы был достоверно выше в сравнении с группой изолированного МС (p<0,01 для SCORE и p<0,05 для PROCAM). Таким образом, наличие подагры у пациентов с МС увеличивает риск ССЗ по оценочным шкалам, что может быть обусловлено нарушениями липидного обмена, возникающими у данных больных и тесно коррелирующими с выраженностью ГУ.
При оценке частоты встречаемости сосудистых событий (ишемическая болезнь сердца [ИБС], острые нарушения мозгового кровообращения [ОНМК], хроническая сердечная недостаточность), а также СД 2 типа было выявлено, что данная патология преобладает у пациентов группы подагры в сочетании с МС. Так, ИБС была выявлена у 9 (16,07%) пациентов, среди них у 3 (5,37%) в анамнезе имелся инфаркт миокарда. ОНМК в анамнезе имело место у 2 (3,57%) пациентов. СД 2 типа при первичном осмотре отмечен у 9 (16,07%) пациентов, при этом медикаментозную терапию получали только двое. В группе МС без подагры у 11 (36,66%) человек выявлялись различные нарушения углеводного обмена, в т.ч. у 2 (6,66%) – СД 2 типа. ИБС констатирована у 7 (23,33%). Пациентов с указанием на ОНМК в анамнезе не было.
ЗАКЛЮЧЕНИЕ
Таким образом, пациенты с хроническими ревматическими заболеваниями, в т.ч. страдающие подагрой, имеют повышенный риск заболеваемости и смертности от ССЗ. Среди них выявляется высокая распространенность традиционных факторов риска и МС. Эти данные позволяют предположить, что хроническое воспаление можно рассматривать как один из ключевых моментов, вносящих вклад в развитие МС и прогрессирование атеросклероза. Агрессивное лечение основного заболевания с коррекцией воспаления, а также устранение традиционных факторов риска может уменьшить заболеваемость и смертность от ССЗ. Оценка критериев МС наряду с оценкой 10-летнего риска ССЗ должна применяться для того, чтобы идентифицировать пациентов, нуждающихся в модификации образа жизни и/или лекарственной терапии.


