Смертность от сердечно-сосудистых заболеваний составляет более 50% в структуре общей смертности в России, в 2–3 раза превышая этот показатель в экономически развитых странах [1, 2]. Ежегодно в России из каждых 100 тыс. жителей 43 человека умирают от острого инфаркта миокарда (ОИМ) и 190 – от цереброваскулярных заболеваний, причем 65–75% всех острых нарушений мозгового кровообращения (ОНМК) составляют ишемические инсульты [2, 3, 4].
Своевременное восстановление коронарного кровотока – наиболее эффективный метод снижения риска смерти и других неблагоприятных исходов у больных ОИМ с подъемом сегмента ST ЭКГ (ОИМпST) вне зависимости от метода реперфузии. В настоящее время «золотым стандартом» достижения коронарной реперфузии считаются чрескожные коронарные вмешательства (ЧКВ) [5], однако в странах с большой территорией их выполнение во многих случаях затруднительно из-за логистических проблем. Тромболитическая терапия (ТЛТ) служит единственным альтернативным методом реперфузии миокарда у больных ОИМпST. ТЛТ остается методом выбора также в случаях занятости ангиографической операционной, отсутствия согласия больного на проведение ЧКВ, непереносимости контрастных веществ, тромботических осложнений в ходе ЧКВ и ряда иных (в том числе социально-экономических) обстоятельств [6].
По сводным данным крупных рандомизированных исследований, включавших больных с подозрением на ОИМпST, ТЛТ, начатая в 1-й час заболевания, снижает 35-дневную смертность в среднем на 27% и почти в 40% случаев останавливает развитие инфаркта, тогда как терапия, начатая через 7–12 ч, снижает смертность только на 13%. Применение ТЛТ позволяет спасти дополнительно 30 жизней на каждую 1 тыс. больных, леченных в первые 6 ч заболевания, и 20 – на каждую 1 тыс. больных, леченных в интервале 7–12 ч. Благоприятное влияние ТЛТ сохраняется как минимум на протяжении последующих 20 лет [7, 8].
В клинической практике в России наибольшее распространение получили такие тромболитические агенты, как стрептокиназа, урокиназа, алтеплаза и тенектеплаза. Выбор агента для ТЛТ бывает затруднительным из-за их приблизительно одинаковой эффективности. Так, в исследованиях ISIS-3 и GISSI-2 не было выявлено статистически достоверных отличий по смертности при применении стрептокиназы и тканевого активатора плазминогена. При этом в исследовании GUSTO-I смертность за 30-дневный период при применении алтеплазы была достоверно ниже, чем при использовании стрептокиназы. Одновременно снижалось количество новых случаев хронической сердечной недостаточности (ХСН) и желудочковых аритмий при несколько более высоком риске инсульта на фоне применения алтеплазы. Эквивалентность проурокиназы алтеплазе доказана не была, а летальность и эффективность восстановления коронарного кровотока у получающих ее пациентов приблизительно соответствуют таковым у стрептокиназы при большей частоте внутричерепных кровоизлияний [9]. К преимуществам тенектеплазы по сравнению с другими препаратами относится не более высокая клиническая эффективность и безопасность, а удобство и простота в применении [10].
В нашей стране, несмотря на успехи в лечении ОИМ, ТЛТ применяется недостаточно широко. Это связано, помимо прочего, с высокой стоимостью зарубежных препаратов. В 2010 г. алтеплаза была включена в Перечень стратегически значимых лекарственных средств, производство которых должно быть обеспечено на территории Российской Федерации. В результате реализации этого проекта в России был создан полный цикл производства биоаналогичного рекомбинантного тканевого активатора плазминогена, получившего название Ревелиза®. Внедрение его в практику позволит увеличить доступность ТЛТ, повысить качество лечения и снизить зависимость от импорта.
На этапе доклинической разработки была показана сопоставимость лекарственных препаратов Ревелиза® и Актилизе® in vitro по физико-химическим свойствам (идентичность аминокислотной последовательности и молекулярной массы, сопоставимость пространственной структуры, посттрансляционных модификаций и содержания родственных примесей), а также по биологической активности (лизис фибринового сгустка, сродство к фибрину и PAI 1) [11]. В исследованиях in vivo была показана сопоставимая эффективность препаратов в различных дозах на животных моделях ОИМ, тромбоэмболии легочной артерии и тромбоэмболического инсульта. Также продемонстрирован схожий профиль токсичности, параметров токсикокинетики и иммуногенности препаратов.
В рамках 1 этапа доказательства клинической сопоставимости препаратов в 2012–2013 гг. было проведено пилотное открытое рандомизированное исследование в параллельных группах переносимости и фибринолитической активности препарата Ревелиза® у больных ОИМ в сравнении с препаратом Актилизе® (№ КИ-18/12, I–II фаза), которое показало отсутствие статистически значимых отличий по изучаемым показателям между препаратами. Частота резолюции сегмента ST ≥70% составила 57,6±34,2% в основной группе больных и 50,6±34,4% – в контрольной (р=0,75) [12].
Учитывая положительный результат этого исследования, было организовано многоцентровое, рандомизированное, простое слепое клиническое исследование в параллельных группах эффективности и безопасности препарата Ревелиза® в сравнении с препаратом Актилизе® у больных ОИМпST (REV-STEMI-III, III фаза).
Основной целью исследования стала оценка эффективности и безопасности препарата Ревелиза® в сравнении с препаратом Актилизе® у пациентов с ОИМпST на ЭКГ в период до 6 ч и от 6 до 12 ч с начала заболевания. Вторичными целями исследования были частота наступления реперфузии миокарда по резолюции сегмента ST на ЭКГ, оценка развития постинфарктных осложнений, летальности и частоты комбинированных событий «смерть от сердечно-сосудистых заболеваний + рецидив инфаркта миокарда + инсульт + сердечная недостаточность» в течение 3 мес с момента проведения тромболизиса. Также была проведена сравнительная оценка фармакокинетических показателей, частоты и тяжести нежелательных явлений.
МАТЕРИАЛ И МЕТОДЫ
Дизайн исследования
Рандомизированное, открытое, простое слепое исследование было проведено в 2014–2017 гг. в 21 клиническом центре 11 городов России в соответствии с принципами надлежащей клинической практики и требованиями российского законодательства. Перед началом исследования было получено одобрение локального этического комитета каждого центра.
Статистический анализ полученных данных был выполнен с использованием лицензионного программного пакета Stata (StataCorp, США), версия 14. Все применяемые гипотезы носили двусторонний характер (кроме гипотезы по первичной конечной точке эффективности), и во всех случаях уровнем статистической значимости было принято значение p <0,05. Для первичной конечной точки тестировалась гипотеза не меньшей клинической эффективности препарата Ревелиза® относительно референтного препарата Актилизе® по частоте наступления реперфузии согласно данным коронарографии.
Первичная переменная эффективности проанализирована в популяции «По протоколу» (PP), а также в «Полном наборе данных для анализа эффективности» (FAS). Для сравнения частотных показателей между группами использован χ2-критерий и в случае необходимости точный тест Фишера, а также построение модели логистической регрессии. Для сравнения вторичных конечных точек, представляющих частотные переменные, использовался χ2-критерий и в случае необходимости точный тест Фишера (если количество наблюдений было менее 5), а также модель логистической регрессии с включением в качестве независимой переменной группы пациента, а дозы препарата, пола, возраста, данных анамнеза – в качестве ковариат.
Для оценки сердечно-сосудистой смертности в период до 30 сут, а также общей смертности в течение 3 мес после перенесенного ОИМ использовались метод Каплана–Мейера и регрессия Кокса.
Конечными точками для оценки безопасности, согласно Протоколу, служили частота и тяжесть развития геморрагических осложнений, геморрагического инсульта и других нежелательных явлений. Для межгруппового сравнения этих показателей использован χ2-критерий и при необходимости точный тест Фишера.
Наблюдение за ходом исследования
Для текущей оценки результатов исследования был создан Независимый комитет по мониторингу данных, в чью обязанность в первую очередь входила кумулятивная оценка данных коронароангиографии и оценка риска геморрагических осложнений в результате системного тромболизиса.
Исследуемая популяция
В исследование были включены 180 пациентов мужского и женского пола в возрасте от 18 до 80 лет, давших письменное информированное согласие на участие в исследовании и проведение коронарографии. У всех у них по прошествии не более 12 ч от начала болей (продолжительностью не менее 20 мин) в грудной клетке (на момент скрининга) присутствовал на ЭКГ подъем сегмента ST (в точке J) в 2 или более последовательных отведениях свыше 0,2 мВ у мужчин или 0,15 мВ у женщин в отведениях V2–V3 либо более 0,1 мВ – в других отведениях.
Критериями невключения в исследование были тяжелая сопутствующая патология, а также состояния и заболевания, при которых системный тромболизис сопряжен с риском развития тяжелых геморрагических осложнений.
После проверки соответствия критериям включения в исследование пациенты были подвергнуты стратифицированной рандомизации 1:1 для проведения тромболизиса препаратами Ревелиза® (АО «ГЕНЕРИУМ», Россия) либо Актилизе® («Берингер Ингельхайм Фарма» ГмбХ, Германия). Стратификация проводилась в зависимости от давности появления первых симптомов ОИМ (до 6 ч и от 6 до 12 ч) в соотношении 2:1.
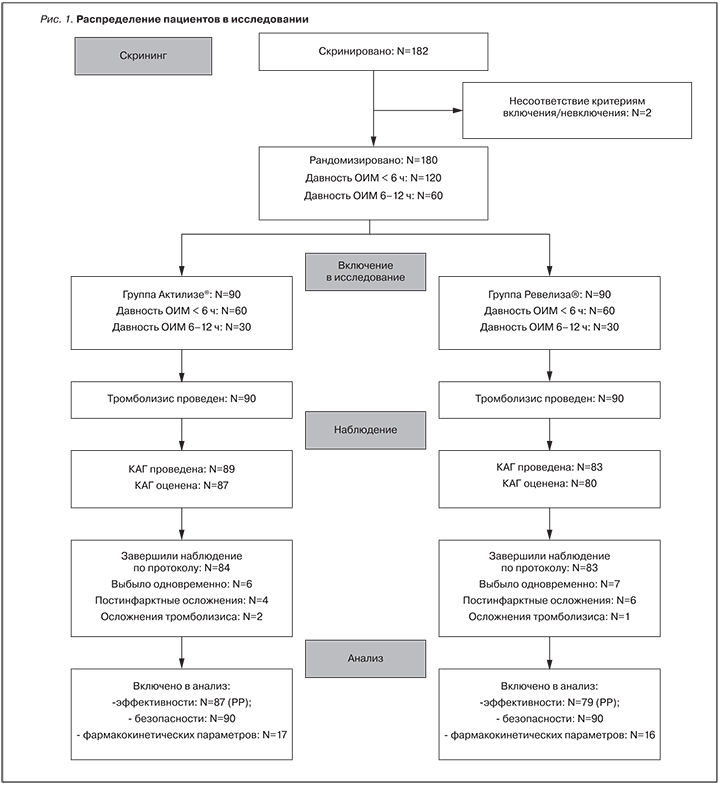
Распределение пациентов на группы в исследовании представлено на рис. 1.
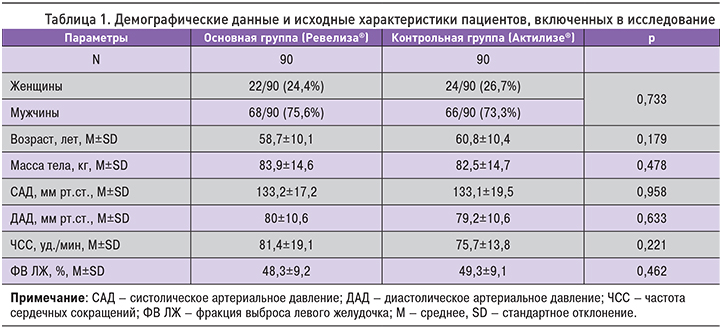
Группы пациентов были сопоставимы по исходным характеристикам (пол, возраст, масса тела), основным показателям гемодинамики и фракции выброса левого желудочка (ФВ ЛЖ) согласно данным эхокардиографии (табл. 1). Также не отмечалось различий по частоте сопутствующей патологии и получаемой терапии.
Сравниваемые группы были сопоставимы также по показателю элевации сегмента ST на исходной ЭКГ в 12 отведениях: сумма элевации по всем отведениям составила 1,10±0,75 и 1,12±0,74 мВ для основной и контрольной групп соответственно, р=0,586.
Всем пациентам, вошедшим в исследование, назначали стандартную терапию ОИМпST согласно рекомендациям Европейского общества кардиологов (ESC, 2012). В зависимости от времени, прошедшего с момента появления первых симптомов ОИМ, использовался один из двух режимов дозирования тромболитика:
- 90-минутный режим – у пациентов с давностью ОИМ менее 6 ч после появления симптомов: 15 мг – внутривенно струйно, 50 мг – внутривенно капельно в течение 30 мин с последующей инфузией 35 мг в течение 60 мин до достижения максимальной дозы 100 мг. Для пациентов с массой тела менее 65 кг: 15 мг – внутривенно струйно, 0,75 мг/кг (максимум 50 мг) – внутривенно капельно в течение 30 мин с последующей инфузией 0,5 мг/кг (максимум 35 мг) в течение 60 мин;
- 3-часовой режим – при сроках ОИМ от 6 до 12 ч (10 мг – внутривенно струйно, 50 мг – внутривенно капельно в течение 60 мин с последующей инфузией 40 мг в течение 120 мин до достижения максимальной дозы 100 мг). У пациентов с массой тела менее 65 кг суммарная доза в этом случае не превышала 1,5 мг/кг.
Тромболизис проводился в соответствии с рекомендациями инструкции по медицинскому применению референтного препарата Актилизе®.
Критерии оценки эффективности и безопасности
Основным критерием эффективности была частота реперфузии миокарда по данным коронароангиографии (КАГ). КАГ проводилась в течение первых суток после тромболизиса, но не ранее 3 ч после начала инфузии в случае достижения эффекта (признаков реперфузии миокарда) и немедленно в отсутствии эффекта от ТЛТ по данным ЭКГ (снижение сегмента ST менее чем на 50% через 90 мин от начала введения препарата у больных ОИМ в период до 6 ч и через 180 мин в период от 6 до 12 ч с начала заболевания).
Оценка эффективности реперфузии миокарда по результатам КАГ в соответствии с критериями TIMI [13] осуществлялась централизованно командой независимых сертифицированных специалистов (рентгенэндоваскулярных хирургов), не осведомленными о целях и задачах этого исследования, назначенной терапии и не имеющих доступа к клиническим данным пациентов.
Пациенты, у которых отсутствовали результаты КАГ или если оценка не могла быть проведена независимыми специалистами, не включались в основной анализ эффективности.
Показателями реперфузии миокарда считалась 3 или 2 степень коронарного кровотока по критериям TIMI:
- 3 степень – нормальная коронарная перфузия (антеградный кровоток и вымывание контраста дистальнее места обструкции не отличаются от таковых в непораженном сосуде);
- 2 степень – неполная коронарная перфузия (полное контрастирование коронарной артерии дистальнее места обструкции, однако отмечается задержка заполнения дистального русла или замедление вымывания контраста).
Дополнительными критериями эффективности служили:
- частота реперфузии миокарда согласно данным ЭКГ – по резолюции сегмента ST на 30, 50, 70% и более через 90 мин от начала введения препарата у больных ОИМ в период до 6 ч и по резолюции сегмента ST на 50% и более через 180 мин от начала введения препарата у больных ОИМ в период от 6 до 12 ч с начала заболевания;
- частота проведения ЧКВ;
- сердечно-сосудистая смертность в период до 30 сут и в течение 3 мес после перенесенного ОИМ;
- частота развития постинфарктных осложнений (истинного кардиогенного шока, клинических признаков застойной сердечной недостаточности, острой аневризмы левого желудочка, разрыва сердца, ранней постинфарктной стенокардии, повторного инфаркта миокарда, инфаркта мозга) в первые 30 сут, за исключением нарушений ритма;
- частота развития комбинированных событий «смерть от сердечно-сосудистых заболеваний + рецидив инфаркта миокарда + инсульт» и «смерть от сердечно-сосудистых заболеваний + рецидив инфаркта миокарда + инсульт + сердечная недостаточность» в течение 30 и 90 сут после перенесенного ОИМ. Комбинация подобных событий, отражающих течение и исход заболевания, является общепризнанной конечной точкой в исследованиях препаратов для лечения ОИМ [14, 15].
Также у 33 пациентов, поступивших в клинику в период до 6 ч с момента появления симптомов ОИМ и получавших тромболизис в ускоренном режиме, выполнялся забор образцов крови для изучения фармакокинетических параметров сравниваемых препаратов.
Определение концентрации алтеплазы в плазме крови
Концентрацию алтеплазы в образцах плазмы пациентов, приготовленных с использованием К2-ЭДТА в качестве антикоагулянта, определяли методом твердофазного иммуноферментного анализа (ИФА), разработанным и валидированным в ООО «МБЦ «Генериум» (Россия). Принцип его основан на специфичном взаимодействии алтеплазы, присутствующей в образцах плазмы, с поликлональными кроличьими антителами, специфичными к rtPA, которые предварительно иммобилизованы в лунках микропланшета. Образующийся комплекс «алтеплаза–антитело» детектируется с помощью поликлональных антител к rtPA, конъюгированных с пероксидазой хрена, и синтетического хромогенного субстрата (тетраметилбензидина) с последующим измерением оптической плотности при длине волны 450 нм. По калибровочному графику зависимости оптической плотности от логарифма концентрации алтеплазы определяют концентрацию алтеплазы в исследуемых образцах. Анализ был проведен с соблюдением подтвержденных в ходе валидации метода сроков и условий хранения, обеспечивающих стабильность исследуемых образцов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ эффективности. Частота реперфузии по данным КАГ
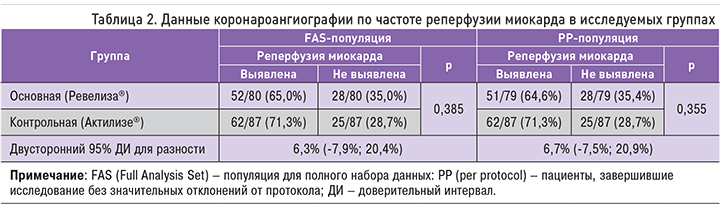
Тромболизис был проведен 180 пациентам, результаты КАГ оценены у 89 пациентов основной группы и 87 – контрольной. В основной группе КАГ не была проведена 7 пациентам: у 1 из них были противопоказания к КАГ, 6 скончались в течение первых суток после ТЛТ (1 по причине развития геморрагического инсульта, 5 – из-за осложнений ОИМ). В контрольной группе КАГ не была проведена 1 пациенту вследствие развития геморрагического инсульта. Еще у 3 пациентов основной группы и 2 пациентов контрольной группы результаты КАГ не могли быть оценены, так как не определялась инфаркт-связанная артерия. Таким образом, КАГ была оценена у 80/90 пациентов основной группы и 87/90 – контрольной. Проведенный анализ первичного параметра эффективности показал, что в основной группе (Ревелиза®) реперфузия отмечалась у 52 из 80 пациентов (65,0%), тогда как в контрольной группе (Актилизе®) доля пациентов с реперфузией составила 62/87 (71,3%) (табл. 2).
Между группами отмечалась схожая динамика в степени восстановления кровотока по классификации TIMI:
- 0 степень – 22 пациента (27,5%) в основной группе (Ревелиза®) и 20 пациентов (23,0%) – в контрольной (Актилизе®);
- 1 степень – 6 (7,5%) в основной группе и 5 (5,8%) в контрольной;
- 2 степень – 14 (17,5%) в основной группе и 17 (19,5%) в контрольной;
- 3 степень – 38 (47,5%) в основной группе и 45 (51,7%) в контрольной.
Межгрупповое сравнение с помощью χ2-критерия не выявило статистически значимых отличий между группами (p=0,855).
Тестирование нулевой гипотезы исследования проводилось с помощью построения двустороннего 95% доверительного интервала (ДИ) для разности долей ответчиков в сравниваемых группах (контрольная группа – основная группа). Двусторонний 95% ДИ составил (-7,9%; 20,4%) и не пересек установленную протоколом границу не меньшей эффективности 22%. Этот факт позволяет отбросить нулевую гипотезу о том, что исследуемый препарат хуже препарата сравнения, в пользу альтернативной гипотезы о том, что исследуемый препарат не хуже препарата сравнения.
Такой вывод, полученный для популяции всех пациентов, включенных в исследование (FAS-популяция), подтверждается на популяции пациентов, завершивших исследование без существенных отклонений от протокола (PP-популяция). Так, 95% ДИ для разницы в эффективности двух препаратов среди пациентов PP-популяции составил (-7,5%; 20,9%).
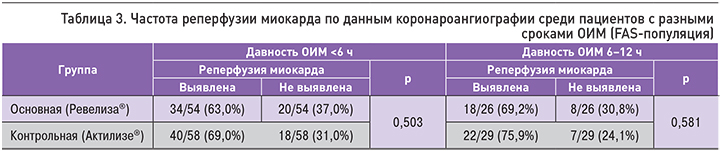
Дополнительный анализ частоты реперфузии миокарда у пациентов с различной давностью ОИМ также не выявил статистически значимых отличий (табл. 3).
Анализ результатов реперфузии по снижению сегмента ST на ЭКГ показал, что в подгруппе пациентов с ОИМ в период до 6 ч через 90 мин от начала введения препарата снижение сегмента ST на ≥70% наблюдалось у 47,2% пациентов в основной группе (Ревелиза®) и у 47,5% – в контрольной (Актилизе®). Снижение сегмента ST на 50–70% отмечалось у 26,4% пациентов в основной группе и у 23,7% в группе контроля; на 30–50% – у 5,3 и 5,1% соответственно. Точный тест Фишера не выявил статистически значимых различий между препаратами по частоте реперфузии согласно результатам резолюции сегмента ST (р=0,970).
В подгруппе больных ОИМ давностью 6–12 ч (FAS-популяция) через 90 мин от начала введения препарата снижение сегмента ST на ≥50% наблюдалось у 70,4% пациентов в группе, получавшей препарат Ревелиза®, и у 55,2% в группе Актилизе® (р=0,240). У 3 больных на ЭКГ после окончания ТЛТ отмечался идиовентрикулярный ритм, что затрудняло оценку динамики сегмента ST, но косвенно указывало на эффективность ТЛТ. Еще один пациент скончался до повторной регистрации ЭКГ.
Анализ данных по частоте проведения ЧКВ с помощью критерия χ2 также не выявил значимых различий между группами. Частота ЧКВ в основной группе составила 80,5%, в контрольной – 86,5% (p=0,287).
Сердечно-сосудистая смертность в период 30 и 90 сут после перенесенного ОИМ
Сердечно-сосудистая смертность в краткосрочном (30–45 дней) периоде после ОИМпST в соответствии с руководством EMA по разработке фибринолитических препаратов для терапии ОИМ расценивается как важный критерий эффективности тромболизиса [14]. Поэтому для этого вторичного критерия эффективности протоколом была предусмотрена оценка не меньшей эффективности по отношению к референтному препарату с заданной границей 15%. В рамках настоящего исследования была оценена смертность в течение 30 и 90 дней с момента перенесенного ОИМ.
В период до 30 сут после ОИМ в основной группе (Ревелиза®) произошло 7 (7,8%) сердечно-сосудистых смертей, в контрольной группе (Актилизе®) – 5 (5,6%). Таким образом, точечная оценка для разности в доле умерших составила 2,2% с 95% ДИ (-5,1%; 9,5%) и не пересекла заложенную протоколом границу не меньшей эффективности в 15,0% по этой конечной точке.
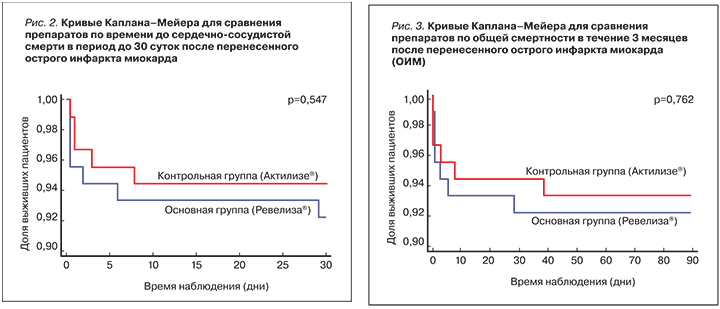
Для анализа данных по сердечно-сосудистой смертности в период до 30 сут после перенесенного ОИМ был использован метод Каплана–Мейера (рис. 2). Сравнение кривых выживаемости в двух группах с помощью лог-ранг-теста не выявило статистически значимых отличий (p=0,547).
В дополнительной регрессионной модели Кокса с учетом возможных ковариатов (возраст, пол и время операции (до 6 ч или 6–12 ч после ОИМ)) для фактора препарата (Ревелиза®=1 vs Актилизе®=2) было получено соотношение рисков (HR) = 0,653 с 95% ДИ (0,205; 2,081), p=0,471.
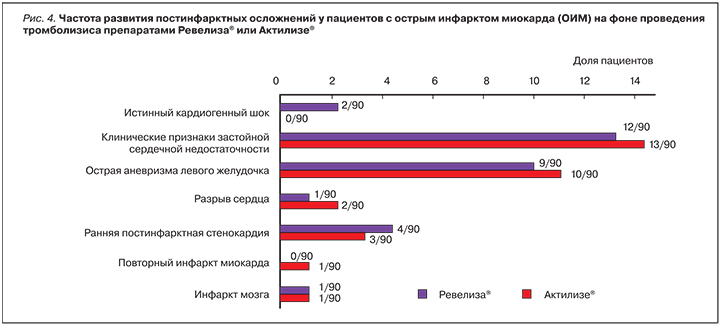
Аналогично был проведен анализ общей смертности в течение 90 дней после перенесенного ОИМ (рис. 3). Общее число смертей составило 7 (7,8%) в основной группе (Ревелиза®) и 6 (6,7%) – в контрольной (Актилизе®). Таким образом, точечная оценка для разности в доле умерших составила 1,1% с 95% ДИ (-6,5%; 8,7%).
При использовании дополнительной регрессионной модели Кокса для фактора препарата (Ревелиза®=1 vs Актилизе®=2) было получено соотношение рисков (HR) = 0,775 с 95% ДИ (0,258; 2,331), p=0,650.
Все 13 смертей, зарегистрированных в этом исследовании, были сердечно-сосудистыми. Не выявлено статистически значимых различий между группами пациентов, получавших препараты Ревелиза® и Актилизе®, по срокам наступления летальных исходов, что свидетельствует о том, что эффективность Ревелизы® сопоставима с Актилизе® в отношении влияния на сердечно-сосудистую смертность в первые 30 сут и в течение 3 мес после перенесенного ОИМ.
Частота развития постинфарктных осложнений
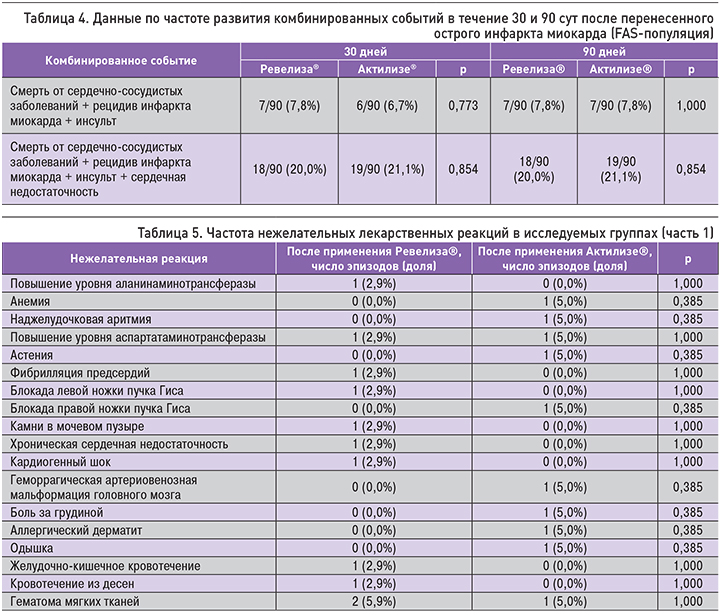
Данные по частоте развития постинфарктных осложнений были проанализированы с помощью χ2-критерия либо точного теста Фишера (если количество наблюдений в какой-либо из ячеек было менее 5). Анализ не выявил статистически значимых отличий между группами по указанным параметрам (p >0,05) (рис. 4).
Для сравнения выраженности ферментемии на различных визитах относительно скрининга использовался тест Уилкоксона, а для межгруппового сравнения – тест Манна–Уитни. Для коррекции на множественность сравнения уровнем статистической значимости было принято значение 0,01. Было отмечено резкое увеличение уровня тропонина на вторые сутки ОИМ после проведения ТЛТ (p <0,0001) и его последующее снижение, что характерно для течения ОИМ. Статистически значимой разницы между группами не выявлено (p >0,05).
По влиянию на уровень фибриногена и D-димера в динамике статистически значимые различия между препаратами Ревелиза® и Актилизе® также не наблюдались.
Частота развития комбинированных событий
Данные по частоте развития комбинированных событий в течение 30 и 90 сут после перенесенного ОИМ (табл. 4) были проанализированы с помощью χ2-критерия либо точного теста Фишера. Анализ не выявил статистически значимых отличий между группами по указанным параметрам (p >0,05).
Таким образом, выбор препарата для проведения тромболизиса не оказывал влияния на течение и исходы ОИМ. Эффективность Ревелизы® сопоставима с эффективностью Актилизе® в отношении частоты развития комбинированных событий.
Безопасность
Исследование продемонстрировало сопоставимый профиль безопасности обоих препаратов. Всего было зарегистрировано 371 нежелательное явление (НЯ), из них – 193 в основной группе (Ревелиза®) и 179 – в группе контроля (Актилизе®). Наибольшее количество НЯ было отнесено к «нарушениям со стороны сердца»: число эпизодов таких НЯ в основной группе (Ревелиза®) составило 25,4% от общего числа НЯ в группе, в контрольной группе (Актилизе®) аналогичный показатель был равен 30,2%. При сравнении частоты развития «нарушений со стороны сердца» в основной группе (Ревелиза®) они встречались у 31,1% пациентов, в контрольной (Актилизе®) – у 35,6% пациентов.
Профиль нежелательных явлений, связанных, по мнению исследователей, с применением исследуемых препаратов (табл. 5, 6), также не имеет статистически значимых отличий, кроме локальных гематом в месте введения препарата.
В исследовании было зарегистрировано 22 серьезных нежелательных явления (СНЯ), в том числе 13 летальных исходов. В основной группе (Ревелиза®) выявлено 11 (50,0%) СНЯ, в том числе 7 летальных исходов; в контрольной группе (Актилизе®) аналогичные показатели составили 11 (50,0%) и 6.
Все нежелательные реакции, зарегистрированные в этом исследовании, являются ожидаемыми и подробно описаны в инструкции по медицинскому применению препарата Актилизе®.
При изучении показателей коагулограммы достоверных различий между терапевтическими группами в отношении уровней и динамики активированного частичного тромбопластинового времени (АЧТВ), международного нормализованного отношения (МНО) и D-димера выявлено не было, уровень фибриногена на визите скрининга у пациентов в контрольной группе (Актилизе®) исходно был статистически выше, чем в основной (Ревелиза®) (р=0,026). Уровень D-димера на 3-е сутки после проведения ТЛТ был статистически выше в основной группе (Ревелиза®) (р=0,008).
Геморрагические осложнения
Геморрагические осложнения, особенно внутричерепные кровоизлияния, относятся к наиболее серьезным рискам при проведении системного тромболизиса. Поэтому геморрагические события находились в фокусе оценки сопоставимости безопасности исследуемого и референтного препаратов.
Геморрагические осложнения оценивались по частоте и тяжести в соответствии с классификацией TIMI [16]:
- большие кровотечения (внутричерепные и любые видимые кровотечения, в том числе выявляемые различными методами визуализации, со снижением гемоглобина на 50 г/л и более или гематокрита на 15% и более);
- умеренные кровотечения (любые кровотечения, в том числе видимые и выявляемые различными методами визуализации, со снижением гемоглобина на 30–50 г/л или гематокрита на 9–15% и более);
- минимальные кровотечения (любые клинически значимые кровотечения со снижением гемоглобина менее чем на 30 г/л или гематокрита менее чем на 9%).
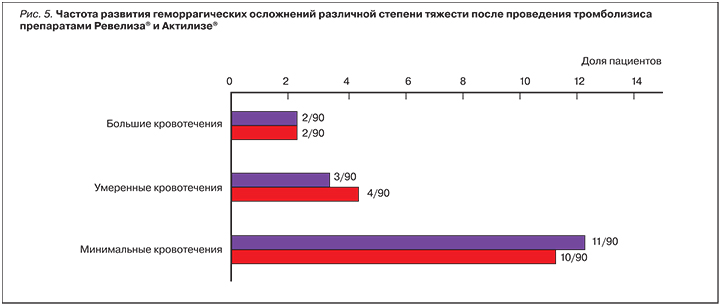
Всего было зарегистрировано 32 эпизода кровотечений: 16 после тромболизиса препаратом Ревелиза® и 16 после препарата Актилизе®. В обеих группах преобладали минимальные кровотечения, такие как локальные гематомы или гематомы в месте введения (рис. 5).
Всего в исследовании было зафиксировано 2 геморрагических инсульта, развившихся, по мнению врачей-исследователей, как осложнение ТЛТ – по одному в каждой группе исследования. У пациента, получившего Актилизе®, инсульт был связан с врожденной аномалией сосудов головного мозга. Два других больших кровотечения составили множественные гематомы (в том числе гематома паховой области и забрюшинная гематома), которые привели к тяжелой острой геморрагической анемии, геморрагическому шоку и летальному исходу у пациентки, получившей Актилизе®, и макрогематурия у пациента, получившего препарат Ревелиза®.
Фармакокинетика
Для оценки сопоставимости фармакокинетических параметров у части пациентов, получавших ускоренную инфузию препаратов, были взяты образцы плазмы крови для определения концентрации алтеплазы. Забор образцов был проведен в 16 временных точках: за 5–15 мин до начала введения, а также в интервале от 1 до 210 мин после начала введения исследуемого или референтного препарата. Анализ усредненных фармакокинетических кривых показал, что они имеют два выраженных пика: первый приходится на точку 15 мин после начала введения с концентрацией препарата около 3500 нг/мл, второй наблюдается в интервале 45–85 мин со значением концентрации около 2000 нг/мл. Это хорошо согласуется с литературными данными о двустадийной фармакокинетике алтеплазы [17, 18].
Для оценки фармакокинетических параметров был использован некомпартментный метод. Фармакокинетические параметры, оцененные по зарегистрированным значениям концентрации в актуальные моменты времени взятия образцов после однократного введения препарата, характеризовались высокой межиндивидуальной вариабельностью с коэффициентами вариации более 50%. AUC0-t для Ревелизы® и Актилизе® составила 233 777,9±156 637,8 и 251 046,6±133 822,8 нг × мин/ мл, Cmax – 4190,1±4044,9 и 4309,6±2581,8 нг/ мл соответственно.
Сравнение полученных фармакокинетических параметров между группами было проведено исходя из предположения о лог-нормальном распределении показателей Cmax и AUC0-t после их логарифмического преобразования с помощью t-теста. Анализ показал, что точечная оценка для всех фармакокинетических параметров находится в диапазоне 80–125%, что указывает на сопоставимый характер фармакокинетики двух препаратов.
ЗАКЛЮЧЕНИЕ
Полученные данные позволяют сделать вывод, что препарат Ревелиза® не уступает Актилизе® по основному параметру эффективности, а также сопоставим с ним по дополнительным параметрам эффективности и показателям безопасности.
Доказана гипотеза не уступающей эффективности о том, что изучаемый препарат Ревелиза® не хуже препарата сравнения Актилизе® в отношении доли пациентов, у которых была выявлена реперфузия миокарда, а также по показателю сердечно-сосудистой смертности в период до 30 сут и в течение 3 мес после ОИМ.
По вторичным конечным точкам эффективности (таким как частота реперфузии миокарда, согласно данным ЭКГ, частота проведения ЧКВ, частота развития постинфарктных осложнений в первые 30 сут, выраженность ферментемии в течение первых 14 дней ОИМ и уровень фибриногена и D-димера в динамике) препарат Ревелиза® статистически не отличается от препарата сравнения Актилизе®.
По основным параметрам безопасности (таким как частота и тяжесть геморрагических осложнений, частота развития геморрагического инсульта, частота и тяжесть других нежелательных явлений, связанных с применением препарата, динамика показателей клинического и биохимического анализов крови, общего анализа мочи) изучаемый препарат Ревелиза® также статистически не отличается от Актилизе®.



