Понятие «острое почечное повреждение» (ОПП) было введено в практику рабочей группой по разработке и внедрению рекомендаций по заболеваниям почек Центра Университета Тафтс (KDIGO): оно означает острое снижение функции почек, включающее в том числе и острую почечную недостаточность, но не ограничивающееся ею. ОПП развивается не только в результате специфических заболеваний почек (острый интерстициальный нефрит, острые гломерулярные и сосудистые поражения почек), но и как следствие ишемии, токсического повреждения или экстраренальных нарушений (преренальная азотемия и острая постренальная обструктивная нефропатия) [1].
ОПП представляет собой серьезную проблему в клинической практике: оно развивается примерно у 13,3 млн человек в год. Вероятно, что ОПП может являться причиной примерно 1,7 млн летальных исходов в год. Этот синдром широко встречается у больных терапевтического, хирургических, онкологических отделений, в практике педиатров и, конечно же, отделений реанимации и интенсивной терапии (ОРИТ) [1].
Основными диагностическими критериями ОПП служат динамика и уровень повышения сывороточного креатинина или снижения диуреза. Наряду с этим предложена система стадирования ОПП, которая отражает количественные изменения сывороточного креатинина и диуреза [2].
Одним из распространенных этиологических факторов развития рассматриваемой патологии выступает медикаментозная терапия: лекарственные нефропатии составляют около 20% всех фиксируемых случаев ОПП [3]. В частности, прием ингибиторов АПФ, блокаторов рецепторов ангиотензина II (БРА), диуретиков и нестероидных противовоспалительных препаратов (НПВП) может стать причиной преренального ОПП [4, 5]. Снижение почечной перфузии или кровотока является причиной 35–70% всех случаев ОПП [6].
При приеме лекарственных препаратов возможен и прямой нефротоксический эффект, который приводит к развитию ОПП. Такой вариант ОПП предполагает прямое повреждение канальца под действием нефротоксического агента, которым, в частности, могут выступать те же ингибиторы АПФ, БРА, некоторые антибиотики (левофлоксацин, ванкомицин, амикацин), йодосодержащие контрастные вещества [7]. Также развитие ОПП связывают с приемом аминогликозидов, НПВП, противовирусных препаратов, иммуносупрессоров [8]. Руководство Национального института качества клинической помощи Великобритании (NICE) относит ингибиторы АПФ и БРА к «нефротоксинам»; вместе с тем в действительности эти препараты редко нефротоксичны, но за счет влияния на внутрипочечную гемодинамику могут вызывать обратимое снижение скорости клубочковой фильтрации (без структурных повреждений), которое, в свою очередь, приводит к развитию ОПП [9].
Как сказано выше, прямым нефротоксическим эффектом обладает ряд антибиотиков. Так, в ретроспективном анализе распространенность ОПП среди пациентов, получавших ванкомицин в ОРИТ, составила 21% (300/1430), смертность в исследуемой популяции достигла 20% (288/1430) [10]. Имели место сообщения о возможном нефротоксическом действии левофлоксацина [11, 12].
Целью нашего исследования стала оценка частоты ОПП лекарственного генеза методом ретроспективного анализа по данным историй болезни больных терапевтического, кардиологического и ревматологических отделений стационара.
МАТЕРИАЛ И МЕТОДЫ
Всего было проанализировано 2400 историй болезни пациентов терапевтического, кардиологического и ревматологического отделений. Критерием для отбора больных в терапевтических отделениях с целью изучения частоты развития ОПП служило применение ими ингибиторами АПФ, БРА, фуросемида, НПВП и нефротоксических антибиотиков (левофлоксацина, ванкомицина, амикацина). Больные, получавшие иммуносупрессорную, противовирусную терапию или контрастные вещества, в исследование не включались.
Наступление ОПП регистрировалась нами в соответствии с критериями клинических практических рекомендаций KDIGO, основанных на изменениях уровня креатинина в сыворотке крови и объема мочи после первичного назначения и/ или изменения дозы вышеуказанных препаратов с высоким риском развития ОПП. Другая ранее проводимая терапия не изменялась. Тяжесть ОПП также оценивалась по критериям клинических практических рекомендаций KDIGО [1].
РЕЗУЛЬТАТЫ
 По результатам исследования уровня креатинина и клубочковой фильтрации признаки ОПП были обнаружены у 101 больного. Таким образом, частота ОПП составляла 4,2% (95% доверительный интервал (ДИ): 3,43–5,1%). Клиническая характеристика больных с этим заболеванием приведена в таблице.
По результатам исследования уровня креатинина и клубочковой фильтрации признаки ОПП были обнаружены у 101 больного. Таким образом, частота ОПП составляла 4,2% (95% доверительный интервал (ДИ): 3,43–5,1%). Клиническая характеристика больных с этим заболеванием приведена в таблице.
Средний возраст больных составлял 71,4 лет, большинство из них были старше 65 лет – 70 человек (70%). 15 (15%) пациентов находились в возрастной группе 85 лет и старше, 30 (30%) – 40–65 лет, у 1 больного возрасте 28 лет с внебольничной пневмонией отмечалась ОПП на фоне терапии левофлоксацином. Женщин и мужчин среди больных с ОПП было примерно равное количество.
Основным диагнозом при выписке больных была артериальная гипертензия (АГ) и связанные с ней осложнения: 2 и 3 стадии АГ в соответствии с классификацией Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов имели 48 (47,5%) больных.
У 25 (24,8%) пациентов основным клиническим диагнозом являлся постинфарктный кардиосклероз, у 7 (6,9%) – стабильная стенокардия, у 2 – хронический нефрит, у 1 – осложнения ревматического порока сердца.
У 19 (18,8%) пациентов причиной ОПП служило применение антибиотиков в связи с внебольничной пневмонией.
По результатам оценки состояния почек при поступлении и до назначения вышеуказанных препаратов практически у трети больных (29,7%) уровень клубочковой фильтрации соответствовал хронической болезни почек (ХБП) 0 ст., у 48 (47,5%) – ХБП 3 ст., у 23 (22,7%) – тяжелым стадиям ХБП.
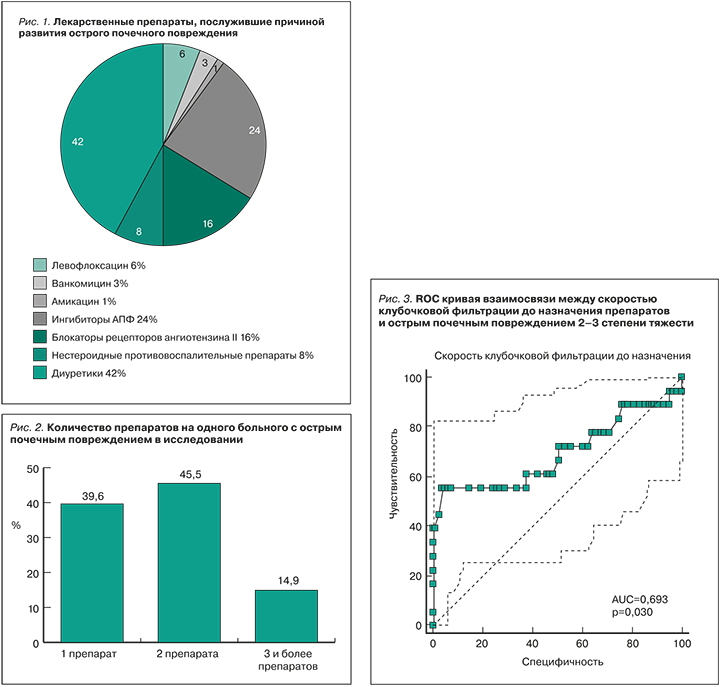
Лекарственные препараты, вследствие назначения которых развилось ОПП у исследуемых пациентов, приведены на рисунке 1.
В общей сложности 101 больному с ОПП перед его развитием было сделано 180 назначений лекарственных препаратов. В 42% случаев развитие ОПП было зарегистрировано после назначения фуросемида, в 24% – ингибиторов АПФ, в 16% больных – БРА. У 14 (8%) пациентов ОПП было связано с назначением НПВП, у 10% – антибиотиков.
Около половины больных – 46 (45,5%) – одновременно получали два препарата из оцениваемой группы. 40 (39,6%) пациентам было назначено одно из лекарственных средств, 15 (14,9%) применяли 3 и более нефротоксичных препарата одновременно (рис. 2).
40 (39,6%) больным в дополнение к ранее проводимой терапии был назначен 1 препарат и/ или изменены дозировки одного препарата. У 16 (15,8%) человек это был фуросемид, у 13 (12,9%) – БРА, у 7 (6,9%) – ингибиторы АПФ, у 2 (2%) – левофлоксацин, у 2 (2%) – НПВП.
46 (45,5%) больным дополнительно к проводимой терапии были назначены и/или изменены дозировки 2 препаратов. Наиболее часто – у 24 (23,7%) человек – совместно использовались ингибиторы АПФ и фуросемид, у 12 (11,9%) – БРА и фуросемид, у 6 (5,9%) – антибиотики и фуросемид, у 4 (4%) – НПВП и фуросемид.
Еще у 14 (13,9%) больных в рамках проводимой терапии применялись и/или были изменены дозы 3 препаратов, а у 1 больного – сразу 4 лекарственных средств. Чаще других среди этих пациентов встречались комбинации ингибитор АПФ + фуросемид + НПВП – 5 (5%) случаев, а также ингибитор АПФ + фуросемид + левофлоксацин – 4 (4%). Остальные сочетания изучаемых препаратов были единичными. У 1 больного к проводимой терапии были одновременно добавлены ингибитор АПФ + ванкомицин + амикацин + диуретики.
Наиболее угрожающей была комбинация ингибитор АПФ/БРА + НПВП + диуретик из-за частого ее назначения пациентам и высокой вероятности развития ОПП при ее применении. Такое сочетание препаратов получило название «тройной удар»; было неоднократно показано, что использование указанной лекарственной комбинации связано с повышенным риском ОПП у взрослых [13–15].
У большинства 83 (82,2%) больных в нашем исследовании развилось ОПП 1 степени, у 8 (7,9%) – 2 степени, у 10 (9,9%) – 3 степени. Тяжесть ОПП была взаимосвязана с функциональным состоянием почек до коррекции терапии. При проведении ROC анализа между тяжестью ОПП и уровнем клубочковой фильтрации обнаружена статистически значимая взаимосвязь (рис. 3): AUCROC=0,693 (95% ДИ: 0,594–0,781; р=0,03).
Количество назначаемых препаратов не оказывало достоверного влияния на тяжесть ОПП: так, у всех 15 больных, получавших 3 и более препарата, отмечалась ОПП 1 стадии. Среди 46 человек, применявших 2 препарата, у 3 (6,5%) отмечалась ОПП 2 степени, у 5 (10,9%) – 3 степени, у остальных 38 (82,6%) – 1 степени. В когорте 40 больных, использовавших 1 препарат, ОПП 2 степени наблюдалась у 5 (12,5%) человек, 3 степени – у 5 (12,5%), у остальных 30 (75%) – 1 степень ОПП. Статистическая значимость дисперсии такого распределения была невысока: c2=4,99, р=0,217.
ЗАКЛЮЧЕНИЕ
1. Частота развития ОПП среди больных терапевтического стационара в нашем исследовании составила от 3,43 до 5,1%.
2. Поступление больного в стационар в связи с обострением или ухудшением течения АГ, хронической сердечной недостаточности и других заболеваний приводит к интенсификации ранее проводимой терапии или замене препаратов. Такая коррекция лечения может быть сопряжена риском развития ОПП.
3. Коррекция доз или интенсификация терапии у указанных пациентов чаще всего происходит за счет назначения ингибиторов АПФ/БРА и фуросемида.
4. При назначении препаратов с риском развития ОПП врачи не всегда учитывают текущее функциональное состояние почек, что влечет за собой развитие тяжелых форм ОПП.


