ВВЕДЕНИЕ
Артериальная гипертония (АГ) в XXI в. приобрела характер пандемии – ее распространенность растет с каждым годом [1]. Изучение механизмов поражения органов-мишеней при АГ привело исследователей к выводу, что ключевая роль в их развитии принадлежит ремоделированию сосудистой стенки, которое характеризуется повышением артериальной жесткости, снижением эластичности, дисфункцией эндотелия и повышением сосудистого тонуса. Уже в рекомендациях Европейского общества по артериальной гипертензии (ESH) / Европейского общества кардиологов (ESC) по лечению АГ от 2013 г. было указано, что артериальная жесткость служит независимым фактором риска развития сердечно-сосудистых осложнений (ССО) [2].
Изменение структуры и свойств сосудистой стенки на всех уровнях артериального русла – от аорты до капилляров – представляет собой сложный многофакторный процесс, лежащий в основе нарушений функции органов-мишеней, прежде всего головного мозга, сердца, почек, органов зрения и слуха.
Церебральная микроангиопатия – наиболее частая причина развития когнитивных расстройств (КР) у пациентов с АГ. Сосудистые КР по этиологии, патогенезу и клиническим проявлениям в определенной степени соответствуют дисциркуляторной энцефалопатии / хронической ишемии головного мозга (ДЭП/ХИГМ) [3, 4]. КР − одна из самых частых причин инвалидности и развития зависимости у людей пожилого возраста. Они включают нарушения ментальных функций различной тяжести − от мягких когнитивных нарушений до деменции. По данным Всемирной организации здравоохранения (ВОЗ), в настоящее время 35,6 млн людей страдают деменцией, и каждый год регистрируется от 5 до 7 млн новых случаев этого заболевания. Число больных деменцией может увеличиться в 3 раза к 2050 г., поэтому предупреждение развития и прогрессирования КР расценивается как одна из первостепенных задач здравоохранения [5].
Деменция и КР проявляются в двух основных формах – болезни Альцгеймера и сосудистой деменции. Последняя характеризуется цереброваскулярной патологией – поражением белого вещества мозга, лакунарными инфарктами и ишемической перивентрикулярной лейкоэнцефалопатией [6–8].
АГ, особенно в сочетании с другими факторами риска, прежде всего сахарным диабетом (СД) 2-го типа, приводит к развитию эндотелиальной дисфункции на уровне мелких сосудов, вызывая снижение их реактивности и соответственно дефицит перфузии активных участков мозга, а также к изменению состояния сосудистой стенки (липогиалиноз, фибриноидный некроз или микроатероматоз) мелких пенетрирующих артерий и артериол (гипертоническая артериопатия). К наиболее уязвимым участкам головного мозга относятся подкорковые базальные ганглии и глубинные отделы белого вещества больших полушарий головного мозга. В результате развивается феномен «разобщения» корковых (прежде всего лобных) и подкорковых структур за счет повреждения проводящих путей в белом веществе мозга. При этом возникает дисфункция параллельных лобно-подкорковых кругов, которые регулируют как двигательные, так и психические функции. Это определяет доминирующую роль КР и сложных нарушений двигательного контроля в клинической картине ДЭП [9].
Поскольку АГ является наиболее мощным фактором риска развития КР и деменции, особенно когда эти состояния возникают на фоне СД 2-го типа, то исследователей интересовал вопрос наличия у современных антигипертензивных препаратов способности снижать риск таких инвалидизирующих осложнений гипертонии. Метаанализ нескольких крупных рандомизированных клинических исследований показал, что это свойство обнаружено и подтверждено в отношении сартанов, антагонистов кальция и ингибиторов АПФ [10–13]. Однако проблема заключается в том, что у многих пациентов не всегда удается поддерживать рекомендованный уровень артериального давления (АД) в силу тех или иных причин.
В связи с этим в качестве другого эффективного подхода к лечению и профилактике сосудистых КР рассматривается использование препаратов, способных уменьшать эндотелиальную дисфункцию, как основополагающий механизм, запускающий процессы сосудистого ремоделирования, восстанавливать сопряжение между мелкими церебральными сосудами, нейронами и глиальными клетками. Один из таких подходов, на наш взгляд, применение лекарственных средств, индуцирующих синтез оксида азота (NO).
К числу таких препаратов относится мельдоний, под влиянием которого в плазме крови увеличивается концентрация предшественника карнитина гамма-бутиробетаина (ГББ), способного активизировать эндотелиальную NO-синтазу. Кроме того, установлено, что эфиры ГББ обладают мощным ацетилхолиноподобным эффектом в отношении тонуса кровеносных сосудов. Следовательно, существуют и карнитин-независимые эффекты мельдония, определяющие его положительное влияние на процессы микроциркуляции.
Следует отметить, что ни в одном исследовании еще не проводилась оценка параметров микроциркуляции и их динамики in vivo на фоне терапии мельдонием, что могло бы значительно расширить и конкретизировать наше представление о механизмах его действия.
На сегодняшний день исследования микроциркуляции можно проводить неинвазивным способом in vivo с применением капилляроскопов. Предметом изучения в данном случае выступают капилляры ногтевого ложа или бульбарной конъюнктивы и лимба. Изучение последних предпочтительно, так как капилляры ногтевого ложа хуже визуализируются и больше подвержены внешним влияниям. Кроме того, микрососуды конъюнктивы глазного яблока достаточно объективно отражают состояние капиллярного кровотока во всем организме. Вместе с тем анатомическое единство сосудистых бассейнов глазного яблока и головного мозга, а также общность фило- и онтогенеза головного мозга и глазного яблока служат основанием для оценки биомикроскопии микрососудов конъюнктивы и в оценке мозговой гемодинамики. Поэтому сегодня конъюнктива глазного яблока является достаточно информативным тест-объектом как для оценки прижизненного состояния микроциркуляции, так и для выявления расстройств мозгового кровотока.
Целью нашего исследования стала оценка влияния мельдония (Милдронат®, компания «Гриндекс») на параметры микроциркуляции, степень КР и состояние здоровья у пациентов общетерапевтического профиля с АГ и хроническими ишемическими заболеваниями сердечно-сосудистой и центральной нервной системы с помощью ноу-хау капилляроскопа «ОКО».
МАТЕРИАЛ И МЕТОДЫ
В открытое сравнительное контролируемое исследование, проводившееся на базе Центра терапевтической офтальмологии с июля по сентябрь 2019 г., был включен 31 пациент с АГ в сочетании с ХИГМ; 71% участников страдал ишемической болезнью сердца (стенокардией I–II функциональных классов). Все пациенты получали стандартную базовую терапию бета-блокаторами, ангиагрегантами (ацетилсалициловая кислота по 100 мг/сут), статинами, ингибиторами АПФ/сартанами. У 21 пациента из 31 дополнительно к базовой применялась терапия мельдонием в дозе 1000 мг/сут (первые 10 дней – парентерально капельно, далее 30 дней в капсулах перорально в режиме 500 мг 2 раза/сут): именно они составили основную группу исследования. В свою очередь, 10 больных, получавших только базовую терапию, образовали контрольную группу. Ни один из участников на момент включения не принимал цитопротективную терапию (триметазидин, ранолазин, мельдоний) по крайней мере на протяжении последних 3 мес.
К критериям исключения в нашем исследования относились неконтролируемая АГ; инсульты или транзиторные ишемические атаки в анамнезе любых сроков давности, а также другие клинически значимые неврологические заболевания; инфаркты миокарда в анамнезе; хроническая сердечная недостаточность II–IV функциональных классов по NYHA (Нью-Йоркской классификации); СД 2-го типа; выраженные нарушения функции печени и почек; онкологические заболевания; психические расстройства; активные заболевания конъюнктивы.
Всем пациентам дважды проводилась капилляроскопия бульбарной конъюнктивы и лимба глаза с помощью капилляроскопа офтальмологического «ОКО» (патент № 132699 от 2013 г.). Офтальмологический капилляроскоп оснащен специальной оптической системой и камерой, которая обеспечивает бесконтактную съемку капилляров, артериол и венул с возможностью оценивать как количественные, так и качественные показатели микроциркуляции. К количественным показателям мы отнесли диаметр артериол (ДА, мм) и венул (ДВ, мм), а также скорость кровотока в артериолах (СкА, микрон/с) и венулах (СкВ, микрон/с). Среди качественных показателей оценивались наличие эритроцитарных агрегатов (сладжей) и их стаза, а также наличие шунтов между артериолами и венулами (АВШ), вызывающими прохождение крови, минуя капилляры («синдром обкрадывания»). Нормальное состояние микрососудов принималось за 0; все наблюдаемые изменения оценивались в баллах, при этом степень отклонения, равная 1, характеризовалась как слабо выраженная, а 2 – как сильно выраженная [14]. Это позволяет в режиме online выявлять снижение кровотока в микрососудах конъюнктивы, вызывающее нарушение обменных процессов и гипоксию тканей, оценить in vivo систему гемостаза, а также эффективность воздействия медикаментозных средств на микроциркуляцию.
Преимуществами исследования микроциркуляции с помощью капилляроскопа офтальмологического «ОКО» можно назвать быстроту проведения (15 с), бесконтактность, получение не только фото- (с 200-кратным увеличением), но и видеоизображения (скорость видеосъемки 100 кадров/ мин), компьютерную обработку данных с получением заключения сразу же после проведения исследования.
До и после проведения терапии участникам выполнялась статическая периметрия (СП), в ходе которой определялись границы поля зрения пациента и области выпадения части поля зрения (скотомы). Имеющиеся данные свидетельствуют, что у пациентов с ХИГМ, как правило, снижено внимание, которое влияет на восприятие исследуемых объектов; это приводит к сужению поля зрения за счет относительных скотом. При статистической обработке данных нами использовалось значение максимального количества исследуемых точек, которые фиксировались пациентом в процессе СП.
Оба исследования проводились на обоих глазах каждого пациента до начала терапии и сразу после ее окончания в обеих группах. Статистической обработке подвергались показатели параметров микроциркуляции, полученные на обоих глазах.
Кроме этого, до и по окончании терапии Милдронатом у пациентов оценивался уровень когнитивных нарушений по Монреальской когнитивной шкале (MoCA), а также качество жизни с помощью опросника EQ-5D.
Статистическая обработка результатов осуществлялась с использованием программного пакета Statistica for Windows, Release 7.0. Количественные данные представлены в виде медианы и интерквартильного размаха. Достоверность различий количественных показателей определялась при помощи критерия Вилкоксона (сравнение двух связанных групп). Результаты считались статистически достоверными при р <0,05.
РЕЗУЛЬТАТЫ
Характеристика исследуемых групп до начала терапии представлена в таблице 1. Группы были сравнимы по возрасту, полу, показателям когнитивной функции и большинству качественных и количественных показателей конъюнктивальной капилляроскопии, а также количеству воспринимаемых объектов при СП. Обращало на себя внимание, что в контрольной группе диаметр артериол был на 20% больше (p <0,05), чем в основной, но, на наш взгляд, это было несущественным с точки зрения поставленных целей исследования.

В таблице 2 представлены результаты 6-недельной терапии препаратом Милдронат® в основной группе, где было отмечено достоверное улучшение количественных показателей капилляроскопии: в частности, выявлено ускорение скорости кровотока как по артериолам (на 12%), так и венулам (на 5%). Качественные характеристики также продемонстрировали положительную динамику: достоверно уменьшилась степень выраженности сладжирования эритроцитов (p <0,05), очаговых стазов (p <0,05), АВШ (p <0,05).
Описанные изменения показателей капилляроскопии сопровождались достоверным увеличением количества объектов, воспринимаемых пациентами при проведении СП со 156 (137; 168) до 163 (148; 178; p <0,05), что свидетельствует о расширении поля зрения на фоне терапии препаратом Милдронатом.
Согласно тесту МоСА и опроснику EQ-5D, когнитивные функции и качество жизни пациентов также достоверно улучшились: сумма баллов по тесту MoCA увеличилась с 21 (19; 22) до 25 (22; 26; p <0,05), а оценка состояния здоровья самим пациентом выросла с 75 (70; 80) до 85% (80; 85) (p <0,05).
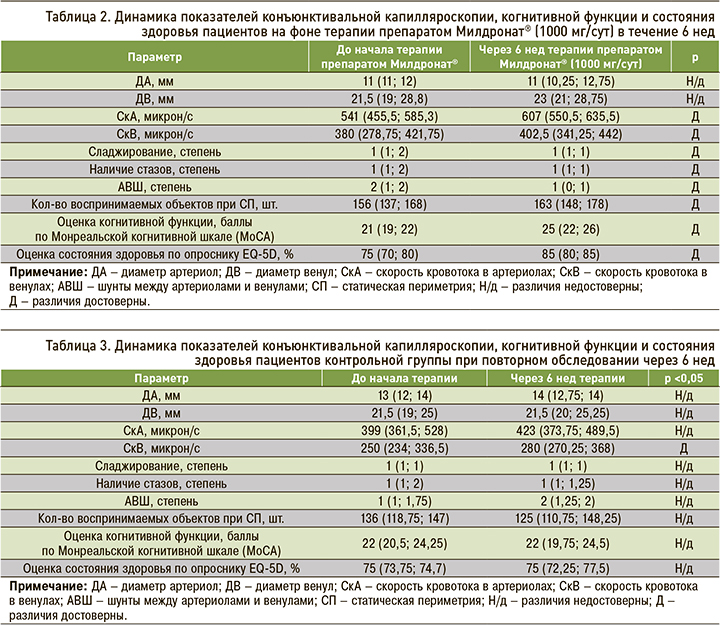
Повторные обследования пациентов контрольной группы через 6 нед (табл. 3) не выявили достоверных изменений ДА, ДВ, СкА, качественных показателей конъюнктивальной микроциркуляции, СП, а также параметров когнитивной функции и качества жизни пациентов. Единственным показателем, который достоверно изменился, был СкВ: он достоверно увеличился с 250 (234; 336,5) до 280 (270,25; 368; p <0,05).
ОБСУЖДЕНИЕ
Улучшение когнитивных функций, показателя качества жизни пациентов в сочетании с расширением поля зрения на фоне улучшения показателей конъюнктивальной микроциркуляции, на наш взгляд, объективно свидетельствует об улучшении микроциркуляторных процессов в головном мозге пациентов по окончании 6-недельной терапии препаратом Милдронат®. Именно совокупное улучшение показателей кровотока в артериальном и венозном звене, а также качественных параметров микроциркуляции достоверно свидетельствуют об ангиопротективных свойствах Милдроната, его способности положительно влиять на эндотелиальную функцию.
На сегодняшний день имеются достоверные данные об эффективности применения Милдроната при лечении пациентов с такими сердечно-сосудистыми патологиями, как ИБС, облитерирующий атеросклероз артерий нижних конечностей. Высокая безопасность и антиишемическая эффективность препарата продемонстрирована целым рядом исследований при кардиоваскулярных заболеваниях. Наиболее крупные из них –исследования с участием больных стенокардией (MILSS I, MILSS II) [15–16], инфарктом миокарда [17–19], пациентов, перенесших аортокоронарное шунтирование [20]. Исследователями разных стран мира отмечен благоприятный эффект препарата Милдронат® в плане повышения толерантности к физической нагрузке, уменьшения клинических проявлений стенокардии, снижения потребления нитратов. Продемонстрирована целесообразность его применения в комбинированной терапии как систолической, так и диастолической хронической сердечной недостаточности [21, 22]. Кроме того, в рандомизированном двойном слепом плацебо-контролируемом исследовании MI&CI (Mildronate® – Efficacy And Safety In Patients With Intermittent Claudication), посвященном оценке эффективности и безопасности терапии Милдронатом в дозе 500 мг 2 раза/сут в сочетании со стандартным лечением больных с болезнью периферических артерий в течение 24 нед, было установлено достоверное увеличение дистанции ходьбы до появления симптомов перемежающейся хромоты в группе пациентов, получавших мельдоний, по сравнению с группой плацебо [23]. Есть данные об эффективности Милдроната как при лечении пациентов с острым нарушением мозгового кровообращения [24, 25], так и при профилактике когнитивных нарушений у пациентов с АГ [26–28]. Однако ни в одном из этих исследований не было проведено наглядной оценки влияния Милдроната на показатели микроциркуляции как одного из механизмов, лежащих в основе его эффективности.
Как показало наше наблюдение, конъюнктивальная микроскопия – доступный и наглядный способ оценки состояния микроциркуляции, который может использоваться для определения тяжести имеющихся изменений и эффективности ангиопротективной терапии при различных сосудистых патологиях.
Результатом 6-недельной терапии Милдронатом пациентов с ишемическими заболеваниями сердечно-сосудистой и центральной нервной системы в нашем исследовании стало отчетливое клиническое улучшение, что, по всей видимости, обусловлено способностью препарата положительно влиять на функцию эндотелия; это сопровождается улучшением показателей гемореологии в микроциркуляторном русле и соответственно оксигенации клеток и тканей.
ЗАКЛЮЧЕНИЕ
Таким образом, Милдронат® может быть рекомендован пациентам с хроническими ишемическими заболеваниями сердечно-сосудистой и центральной нервной систем в общеклинической практике для профилактики прогрессирования основного заболевания и поражений органов-мишеней (головного мозга, органов зрения).


