ВВЕДЕНИЕ
Острые респираторные вирусные инфекции (ОРВИ), включая грипп и COVID-19, рино- и аденовирусные инфекции, относятся к наиболее часто встречающимся инфекционным заболеваниям: на их долю приходится 90% всех заболеваний этой группы. В России до пандемии COVID-19 ежегодно ОРВИ и гриппом болели свыше 30 млн человек (10–15% трудоспособного населения, 45–60% – дети). Ежегодный экономический ущерб от сезонного гриппа в России достигает 100 млрд руб. [1], что соответствует 80% ущерба от всех инфекционных болезней [1].
На сегодняшний день, по данным Роспотребнадзора, ОРВИ продолжают удерживать лидерство в структуре инфекционной заболеваемости человека в первую очередь вследствие пандемии COVID-19 и сезонных вспышек респираторных вирусных инфекций [2], и остаются самой частой причиной первичного обращения пациентов за медицинской помощью. Проблема остается актуальной и в связи с тем, что пандемия накладывается на другие ОРВИ, которые остаются неконтролируемыми из-за широкого спектра возбудителей, циркуляции их на протяжении всего года, высокой трансмиссивности и контагиозности, отсутствия для большинства респираторных вирусных инфекций вакцинопрофилактики, а также формирующейся невосприимчивости и/или устойчивости к лекарственным препаратам. При этом поиск и внедрение в практику новых противовирусных препаратов являются сложной задачей из-за высокого уровня изменчивости вирусного генома и повышения резистентности к методам терапии.
Мировая статистика относит семейство Coronaviridae (CoV) к одним из основных патогенов как человека, так позвоночных, демонстрирующих различный спектр хозяев и пантропизм. В структуре этиологии респираторных вирусных инфекций доля коронавирусов до пандемии была сопоставима с вирусами гриппа и составляла около 15%. Среди этого большого семейства выделяют несколько групп инфекционных агентов, которые вызывают заболевания от легких форм воспаления верхних дыхательных путей до тяжелых; примером последних могут служить вспышки инфекций, вызванных β-коронавирусами MERS- CoV и SARS-CoV, представляющих наибольшую опасность для человека.
Сегодня мы являемся свидетелями пандемии, вызванной новым коронавирусом – SARS-CoV-2, который постоянно мутирует. С начала апреля 2022 г. зафиксирован новый рост заболеваемости COVID-19. Согласно последним опубликованным данным, в мире зарегистрировано 499 млн случаев этого заболевания и 6,18 млн летальных исходов [3]. Зафиксированные в последнее время крупнейшая с начала пандемии вспышка COVID-19 в Китае, подъемы заболеваемости в США, Европе и Африке связаны с новой линией мутировавшего SARS-CoV-2 – омикроном ВА2.1. Омикрон имеет больше мутаций, чем другие штаммы, – всего 72. Наиболее опасные мутации делают вирус более трансмиссивным и способным уклоняться от иммунной системы и вакцин. По оценкам датских исследователей, эффективное число воспроизводства омикрона в 3,19 раза больше, чем у дельта-штамм SARS-CoV-2, чей средний индекс репродукции равен 5 (в диапазоне от 3,2 до 8) [4]. Точно так же японские исследования пришли к выводу, что омикрон в 4,2 раза более заразен, чем дельта. Риск заразиться COVID-19 возрос в 5 раз даже у тех, кто ранее уже перенес эту инфекцию и/ или был вакцинирован.
В начале пандемии COVID-19 был определен как инфекция, вызывающая тяжелые формы пневмонитов (вирусных пневмоний), но далее, с появлением новых мутаций SARS-CoV-2, новая коронавирусная инфекция показала себя как системное заболевание. Собранный мировым медицинским сообществом материал по клинике этой инфекции показывает значительную разнообразность симптомов за счет пантропизма вируса. Кроме того, вирус зачастую не выявляется при полимеразной цепной реакции (ПЦР) в отличие от других инфекций. Это, в частности, показали исследователи из Сеченовского университета, сотрудники Имперского колледжа Лондона, Пизанского университета, Университета Отто фон Герике в Магдебурге и Оксфордского университета, которые провели масштабное исследование проблемы диагностики COVID-19 в России и других странах, изучив течение заболевания у 3,5 тыс. больных. У половины из них наличие вируса было подтверждено лабораторным тестом, у остальных же наблюдались отрицательные результаты, хотя специфические симптомы и состояние легких указывали на COVID- 19. В общей сложности тесты ПЦР «ошибались» более чем в половине случаев [5].
Все это обусловливает необходимость дифференцированного подхода к диагностике COVID- 19, однако в условиях пандемии такая диагностика затруднена. Экспресс-тесты, предложенные для таких целей, при первичном обращении не вносят ясности из-за частых ложноотрицательных результатов. Анализ данных литературы по изменчивости SARS-CoV-2 показал, что вирус научился уходить от иммунного ответа и давал нетипичные ответы при иммуноферментном анализе (ИФА). Первыми появлялись иммуноглобулины класса G и только потом IgМ [6].
Теперь доказано, что коронавирусная инфекция как системное заболевание имеет дальнейшее развитие в виде постковидного синдрома. Варианты мутаций вирусов дают клинику с преобладанием тех или иных симптомов. Установлено, что циркулирующие два основных варианта коронавируса – дельта и омикрон – отличаются по заразности, симптомам, степени тяжести и защите от вакцины.
Схожесть, размытость клинических проявлений COVID-19 и ОРВИ, риск развития тяжелых инфекционных и постинфекционных поражений органов и систем побуждают исследователей к поиску эффективных методов ранней этиотропной терапии. Особую озабоченность вызывают вирусы гриппа и коронавирусы, так как они приводят к развитию острых респираторных синдромов, а также вирусных ринитов, фарингитов, ларингитов и более опасных состояний, вплоть до летального исхода. При этом значительная часть пациентов может переносить COVID-19 субклинически, что, в свою очередь, представляется опасным в эпидемиологическом аспекте [7, 8].
Одним из методов борьбы с РНК-вирусами, к которым относятся возбудители большого числа ОРВИ, служит прямое (противовирусное) воздействие на РНК- зависимую РНК-полимеразу (RdRp), что влечет за собой ингибирование вирусной репликации [9]. Противовирусные молекулы, обладающие такими свойствами, оказывают терминирующее действие не только на SARS-CoV-2 и вирус гриппа, но и другие РНК-вирусы. Аналоги нуклеозидов (адениновые, гуаниновые производные) влияют на активность RdRp, блокируя синтез вирусной цепи РНК у широкого спектра РНК- вирусов, включая SARS-CoV-2 [10].
Одной из современных молекул, способных подавлять РНК-вирусы, является фавипиравир (6-флуоро-3-гидрокси-2-пиразинкарбоксамид). Он активен в отношении различных РНК-вирусов (вирусов гриппа, в том числе штаммов H1N1, H5N1, H7N9, фило- и буньявирусов, в том числе тех, которые вызывают острую лихорадку с тромбоцитопеническим синдромом, аренавирусов, норовирусов, флавивирусов, альфавирусов, гантавирусов), что было продемонстрировано в клинических и экспериментальных исследованиях [11–17].
Фавипиравир, представляющий собой синтетический селективный ингибитор RdRp, применялся как мощный ингибитор вирусной репликации в исследованиях штаммов вируса гриппа типа А, В и С, включая штаммы, резистентные к другим противовирусным средствам, таким как ингибиторы нейраминидазы и М2 [18, 19]. Активная форма фавипиравира селективно взаимодействует с RdRp, включается в формирующуюся цепь вирусной РНК или связывается с сохраненными доменами полимеразы, блокируя репликацию вирусной РНК, приводит к утилизации «дефектной» РНК и исчезновению вирусного генома.
История лечения фавипиравиром до пандемии показала значимое снижение смертности и повышение уровня выживаемости на фоне его приема во время эпидемии лихорадки Эбола (2014, 2016 г.), а также эффективность применения препарата для постконтактной профилактики [18].
Следует заметить, что, по данным исследований, не выявлено ни одного штамма вируса, резистентного к фавипиравиру. Вызываемый препаратом «фатальный» мутагенез у широко распространенных коронавирусов, а также ингибирование RdRp, описанное у других РНК-содержащих вирусов, позволяет рассматривать фавипиравир как универсальный ингибитор эпидемиологически значимых РНК-содержащих вирусов [20].
РНК-зависимая РНК-полимераза обладает высокой консервативностью с точки зрения возникновения мутаций, которые преимущественно возникают в элементах внешней оболочки вируса. Данное обстоятельство делает ее уязвимой мишенью в борьбе с наиболее распространенными РНК-вирусами – возбудителями ОРВИ – путем использования препаратов, направленных на гибель вируса [21, 22].
Зарегистрированный в России и широко используемый препарат прямого противовирусного действия Арепливир на основе фавипиравира, по данным клинических исследований, показал высокую эффективность и безопасность в сравнении со стандартной терапией у пациентов, госпитализированных с COVID-19 [23]. В исследовании приняли участие 200 пациентов мужского и женского пола в возрасте от 18 до 80 лет включительно, госпитализированные с диагнозом «коронавирусная инфекция, вызванная SARS-CoV-2 (подтвержденная)» и рандомизированные в основную и контрольную группы после подписания формы информированного согласия. Результаты показали, что применение фавипиравира для лечения инфекции, вызванной коронавирусом SARS-CoV-2, позволяет сократить период до наступления клинического улучшения в среднем на 4 дня по сравнению со стандартной терапией, достичь улучшения состояния легких, по данным компьютерной томографии (КТ), и элиминации вируса более чем у 90% пациентов; все это способствует ускорению выздоровления. При этом терапия фавипиравиром характеризуется благоприятным профилем безопасности и хорошей переносимостью. Так, общая частота нежелательных явлений в группе, получавшей фавипиравир, была сопоставима с показателями на фоне стандартной терапии. Своевременное начало терапии фавипиравиром (Арепливир) способствует улучшению прогноза заболевания и снижению глобального социально-экономического бремени текущей пандемии [23].
Предложенная во Временных методических рекомендациях по профилактике, диагностике и лечению новой коронавирусной инфекции (15-я версия) схема ранней и эффективной прямой этиотропной терапии фавипиравиром уже на амбулаторном этапе имеет приоритет и предотвращает развитие тяжелых форм инфекции [24].
Цель настоящей работы – оценка безопасности и переносимости препарата Арепливир (фавипиравир) - таблетки, покрытые пленочной оболочкой - у взрослых пациентов с легким и среднетяжелым течением ОРВИ, имеющих хронические заболевания органов и систем и находящихся на амбулаторном лечении в период пандемии COVID-19, на основании динамики клинической картины и субъективного состояния.
МАТЕРИАЛ И МЕТОДЫ
Наблюдение за пациентами проводилось в соответствии с принципами надлежащей клинической практики с декабря 2021 г. по март 2022 г. в 3 субъектах Российской Федерации (Московская, Ленинградская и Смоленская области) на базе 7 амбулаторно-поликлинических лечебных учреждений.
Под наблюдением находились 137 пациентов, мужчин и женщин в возрасте от 18 до 80 лет включительно, обратившиеся в поликлинику с симптомами ОРВИ легкой и среднетяжелой степени. Интервал между появлением первых симптомов заболевания и включением в исследование не превышал 36 ч. Установленный диагноз острой респираторной инфекции верхних дыхательных путей (J00–J06) с другими респираторными проявлениями (J10.1; J11.2) легкого и среднетяжелого течения ставился исследуемым на основании отрицательного результата экспресс теста на COVID-19, наличия как минимум двух из общих симптомов ОРВИ с другими респираторными проявлениями (ринорея, заложенность носа, кашель, чихание, головная боль), а также астеновегетативного синдрома. Степень тяжести заболевания определялась с учетом выраженности астеновегетативного синдрома с респираторными проявлениями в соответствии с клиническими рекомендациями «Острые респираторные вирусные инфекции (ОРВИ) у взрослых» (утв. Минздравом России, 2022) [25]. Температура тела (аксиллярная) исследуемых пациентов находилась в пределах от 37,5 до 39 ˚С включительно.
В наблюдение не включались пациенты с повышенной чувствительностью к фавипиравиру или другим компонентам препарата в анамнезе; пациенты с синдромом мальабсорбции или другим клинически значимым заболеванием желудочно-кишечного тракта (ЖКТ); пациенты с выраженной почечной (скорость клубочковой фильтрации <30 мл/мин, клиренс креатинина, рассчитанный по формуле Кокрофта–Голта <45 мл/мин) или печеночной недостаточностью (аланинаминотрансфераза (АЛТ) и/или аспартатаминотрансфераза (АСТ) >3 значений верхней границы нормы (ВГН), общий билирубин >3 ВГН) по данным анамнеза; пациенты, участвовавшие в других клинических исследованиях лекарственных препаратов и/или медицинских изделий менее чем за 30 дней до визита скрининга и/или 5 периодов полувыведения препарата; пациенты с любым другим состоянием, препятствующим, по обоснованному мнению врача-исследователя, участию в исследовании.
Среди пациентов были 77 (56,2%) мужчин и 60 (43,8%) женщин. Средний возраст пациентов составил 48,78±12,06 лет (от 20 до 78 лет), масса тела – 83,63±12,04 кг (от 63 до 140 кг), рост – 167,71±5,85 см (от 154 до 187 см).
Все пациенты имели одно или несколько сопутствующих хронических заболеваний (вне обострения), подтвержденных в учетном медицинском документе – карте медицинской организации, оказывающей медицинскую помощь в амбулаторных условиях взрослому населению (учетная форма № 025/у).
Доля коморбидных пациентов составляла 89% (n=122), при этом они имели следующие заболевания: сахарный диабет 2-го типа (СД 2); ожирение (ОЖ) 1–3-й степени; артериальную гипертензию (АГ) 1–3-й степени; другие сердечно-сосудистые заболевания, включая ишемическую болезнь сердца (ИБС) в анамнезе; заболевания ЖКТ, в том числе неалкогольную жировую болезнь печени (НАЖБП); хронические заболевания легких, включая хроническую обструктивную болезнь легких (ХОБЛ) и др. 100 пациентов (73%) имели 2 и более сопутствующих заболевания: сочетание СД 2 + АГ, АГ + ОЖ, ОЖ + НАЖБП, ХОБЛ + ОЖ + АГ, АГ + ОЖ + СД 2. Таким образом, в исследование были включены пациенты с высоким риском развития жизнеугрожающих состояний и ухудшения прогноза.
Препарат Арепливир противопоказан беременным, а также мужчинам и женщинам во время планирования беременности, поэтому при назначении его женщинам, способным к деторождению (в том числе в постменопаузе менее 2 лет), до начала лечения подтверждался отрицательный результат теста на беременность. Пациенты были предупреждены о необходимости использовать эффективные методы контрацепции (презерватив со спермицидом) во время приема препарата и после его окончания – в течение 1 мес у женщин и в течение 3 мес у мужчин.
Пациенты, находясь на амбулаторном лечении, принимали Арепливир (фавипиравир) внутрь за 30 мин до еды по следующей схеме:
- пациенты с массой тела <75 кг – по 1600 мг (8 табл.) 2 раза в 1-й день терапии каждые 12 ч, далее (со 2-го по 10-й день терапии) – по 600 мг (3 табл.) 2 раза/сут;
- пациенты с массой тела >75 кг по 1800 мг (9 табл.) 2 раза в 1-й день терапии, далее (со 2-го по 10-й день терапии) – по 800 мг (4 табл.) 2 раза/ сут.
Общая продолжительность курса лечения составляла 10 дней, что является достаточным для достижения требуемой эффективности терапии. Кроме этого, пациенты получали симптоматическую терапию, включая жаропонижающие, болеутоляющие препараты, согласно клиническим рекомендациям «Острые респираторные вирусные инфекции (ОРВИ) у взрослых» (утв. Минздравом России, 2022).
Обследование больных проводили до лечения, на 5-й день терапии и после окончания терапии по общепринятым клиническим, лабораторным (клинический и биохимический анализы крови) и инструментальным методам. В день исследования до назначения терапии проводили забор биологического образца (мазок из рото- и носоглотки) на выявление антигенов коронавируса SARS-CoV-2 методом иммунохроматографического анализа (ИХА, экспресс-тестирование) производства компании Beijing Lepu Medical Technology Co. Ltd. Исследуемая терапия могла быть назначена пациентам до получения результатов этого анализа. Через 14 дней после лечения исследуемым пациентам проводили качественный тест (обнаружено/не обнаружено) на наличие в цельной крови антител (иммуноглобулинов М и G) против коронавируса SARS-CoV-2 и гриппа тем же методом ИХА (экспресс-тестирование).
В соответствии с протоколом исследования безопасность и переносимость препарата Арепливир (фавипиравир) в группе наблюдения оценивались по шкале степеней достоверности причинно-следственной связи «лекарственный препарат – нежелательная реакция» (табл. 1) [26], а также результатам анкетирования по протоколу COV19-QoL для определения качества жизни и ее динамики до и после лечения.

Статистическая обработка данных проводилась с помощью пакета программ STATISTICA 12.5. Показатели выборочных распределений были представлены как среднее значение (m) ± стандартное отклонение (SD). Уровень статистической значимости принят за p <0,05. Для оценки межгруппового различия использовался U-критерий Манна–Уитни. Значимость различия показателей до и после лечения оценивалась критерием Уилкоксона для связанных выборок. Взаимосвязь числовых показателей определялась коэффициентом корреляции Спирмена. Для оценки связи нечисловых данных применялся критерий Хи квадрат Пирсона или точный критерий Фишера.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Осень 2021 г. ознаменовалась новым подъемом заболеваемости COVID-19 и совпала с эпидемическим ростом ОРВИ в Северном полушарии. В ноябре 2021 г. линия омикрон SARS-CoV-2 была впервые обнаружена в Ботсване и Южно-Африканской Республике. Омикроном заболевают во всех возрастных группах, при этом новая мутация характеризуется способностью уходить от иммунного ответа и «пробивать» защиту у ранее переболевших COVID-19. Омикрон становится еще более заразным, чем линия дельта. Быстро распространившись более чем в 165 странах, в настоящее время он является доминирующим штаммом SARS-CoV-2 в мире. Сейчас известны 3 подветви омикрона – ВА.1, ВА.2 и ВА.3, причем у них намечаются дополнительные ответвления.
Таким образом, в России одновременно с другими респираторными вирусами стали циркулировать два штамма SARS-CoV-2 – дельта и омикрон. С подъемом заболеваемости ОРВИ на амбулаторную часть здравоохранения легла беспрецедентная нагрузка, которая требует оперативности в проведении лечения.
С учетом клиническо-эпидемиологических факторов и коморбидности пациентов в проведенном исследовании в первые 36 ч заболевания была оперативно назначена этиотропная терапия препаратом Арепливиром (фавипиравир), которая ориентированная на предотвращение возможных тяжелых проявлений болезни и минимизацию поражений различных органов и систем в постковидном периоде.
У исследуемых пациентов преобладали такие симптомы, как интенсивная головная боль (94%), першение в горле, осиплость голоса, переходящие в выраженную интенсивную боль в горле (74,5%), выраженная слабость, повышенная утомляемость и усталость (73%), ломота в теле, артралгии и миалгии (70,8%), частое чихание, насморк и обильные жидкие выделения из носа (67,9%), заложенность носа (47,4%), сухой кашель (53,3%), нарушение обоняния и/или вкуса (18,2%). Встречаемость симптомов ОРВИ в динамике в абсолютных показателях у пациентов (n=137), получавших фавипиравир, представлена на рисунке 1.
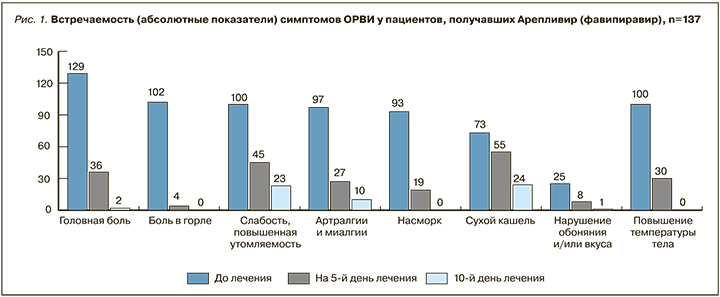
Длительность течения заболевания, сопровождающегося лихорадкой и описанными симптомами, оценена в днях и количеством пациентов в период исследования. Применение фавипиравира позволило добиться положительной динамики, характеризовавшейся купированием катарально-лихорадочного синдрома, а также исключить из схемы лечения жаропонижающие и нестероидные противовоспалительный препараты (НПВП) уже на 5-й день лечения в группе наблюдения у 70% пациентов. Ускорение клинического улучшения и сокращение времени выздоровления свидетельствуют о потенциальных фармакоэкономических преимуществах препарата Арепливир (фавипиравир) у коморбидных пациентов.
Встречаемость сопутствующих заболеваний (%) среди всех исследуемых пациентов (n=137), получавших противовирусную терапию препаратом Арепливир (фавипиравир), была следующей: СД – 35%; ОЖ 1-й степени (индекс массы тела, ИМТ >30) – 32,8%, 2-й степени (ИМТ ≥35) – 21,9%; АГ 1–2-й степени – 51,8%, 3-й степени – 10,2%; заболевания ЖКТ, в том числе НАЖБП, – 25,5%; хронические заболевания легких, включая ХОБЛ, – 19,7%.
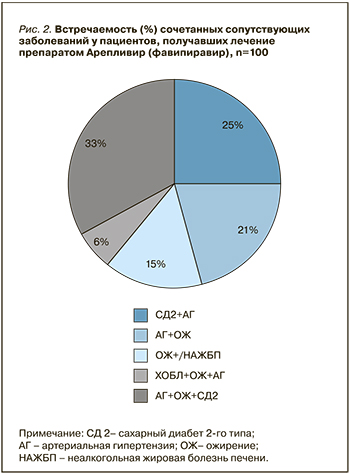
100 пациентов (73%) имели 2 и более сопутствующих заболевания. Среди них у 25 (25%) наблюдалось сочетание СД 2 + АГ, у 21 (21%) – АГ + ОЖ, у 15 (15%) – ОЖ + НАЖБП, у 6 (6%) – ХОБЛ + ОЖ + АГ, у 33 (33%) –АГ+ОЖ+СД2 (рис. 2).
В описанных законченных клинических исследованиях у пациентов с новой коронавирусной инфекцией (COVID-19) и гриппозной инфекцией при приеме фавипиравира наблюдались нежелательные реакции или явления (НЯ) со стороны нервной системы (головная боль, головокружение), сердца (фибрилляция предсердий), ЖКТ (диарея, тошнота, рвота, запор, глоссит, дискомфорт в эпигастральной области), кожи и подкожных тканей (зуд). Также отмечались отрицательные изменения данных лабораторных обследований: повышение активности АЛТ, ACT и других печеночных ферментов, повышение уровня мочевой кислоты в крови [23].
До недавнего времени доказательная медицина в основном была нацелена на лечение отдельных заболеваний, при этом очень мало исследований было посвящено коморбидным пациентам. Сегодняшняя клиническая практика ориентирована на пациента, имеющего несколько хронических заболеваний. Показано, что коморбидность связана с более высокими показателями смертности, инвалидности, побочными эффектами лечения, а также с более низким качеством жизни. По результатам нашего исследования, у коморбидных пациентов терапия препаратом Арепливир (фавипиравиром) характеризовалась благоприятным профилем безопасности. По оценке врачей, у пациентов наблюдалась хорошая переносимость препарата. Лишь у трети пациентов (n=46; 33,58%) имели место типичные для фавипиравира НЯ: со стороны ЖКТ – боли в животе неинтенсивного характера, тошнота, снижение аппетита (n=23; 16,8%); со стороны кожи и подкожных тканей – зуд (n=7; 5,1%); со стороны нервной системы – головокружение (n=16; 11,68%). Головная боль расценивалась врачами как симптом болезни, не связанный с приемом препарата. Все НЯ носили легкий характер и не потребовали отмены препарата.
В лабораторных показателях исследуемых пациентов, получавших фавипиравир, у 83 человек (60,6%) было выявлено транзиторное повышение АЛТ и АСТ: у 54 пациентов (39,4%) – не более 2 ВГН, у 29 (21,16%) – более 3 норм. Анализ пациентов с повышенными печеночными ферментами показал, что они имели НАЖБП и ОЖ как 1-й, так и 3-й степени. 2 пациента злоупотребляли алкоголем. После окончания терапии на 14-й день наблюдения (4-й день после отмены препарата) было отмечено снижение названных показателей у 92 пациентов, 1 пациент не прекратил употреблять алкоголь после лечения.
Другим нежелательным явлением на фоне приема фавипиравира в исследовании стала гиперурикемия (повышение мочевой кислоты в крови), отмечавшаяся у 85 пациентов (62,04%).
Отметим, что указанные изменения не сопровождались жалобами пациентов или другими клиническими проявлениями. После окончания терапии наблюдалась нормализация перечисленных лабораторных показателей.
По оценке врачей-исследователей, причинно-следственная связь возникновения НЯ с проводимой терапией исследуемым препаратом отсутствовала в 34 (40,96%) из 83 случаев. В 25 (30,12%) случаях эта связь была возможной, в 10 (12,04%) – вероятной, в 3 (3,61%) – условной, в 3 (3,61%) – сомнительной, в 8 (9,63%) – неклассифицируемой. Ни у одного пациента, принимавшего фавипиравир, не наблюдалось ухудшения состояния. Случаев отмены препарата из-за НЯ не было. Госпитализация не потребовалась ни одному амбулаторному пациенту, получавшему исследуемый препарат, за весь период наблюдения.
Ожидаемые изменения в клиническом анализе крови, такие как нейтропения, лейкопения также не были зафиксированы ни у одного пациента.
В ходе исследования у пациентов, получавших терапию фавипиравиром, отмечалась положительная динамика уровня маркеров воспаления – снижение D-димера и С-реактивного белка (СРБ). Содержание D-димера в крови у пациентов в ходе наблюдения статистически значимо (р ≤0,05) уменьшалось к 10-му дню – с 4,43 мг/л (до лечения/среднее значение) до 1,72 мг/л. Статистически значимым (р ≤0,05) оказалось и снижение СРБ – с 72,72 мг/л (до лечения/среднее значение) до 11,5 мг/л (после лечения, 10-й день).
Таким образом, проведенная терапия не оказала негативного влияния на лабораторные показатели (клинический и биохимический анализ крови, общий анализ мочи, коагулограмма), показатели жизненно важных функций, что свидетельствует о ее безопасности у коморбидных пациентов.
В данном исследовании также не наблюдалось негативного влияния терапии на показатели жизненно важных функций – артериальное давление, частоту сердечных сокращений, показатели ЭКГ. Ни в начале, ни в промежуточном периоде, ни в конце терапии не было отмечено связанного с приемом препарата ранее описанного удлинения интервала QTс, что говорит об отсутствии аритмогенного эффекта при терапии Арепливиром (фавипиравиром). Этот факт подтверждает установленные ранее данные о рациональности и целесообразности подобранной схемы приема исследуемого препарата в зависимости от веса и дозы [27].
Детальный анализ субъективного состояния пациентов позволил оценить переносимость фавипиравира. В группе наблюдения проводилось анкетирование по протоколу COV19-QoL для определения качества жизни и его динамики до и после лечения (табл. 2).
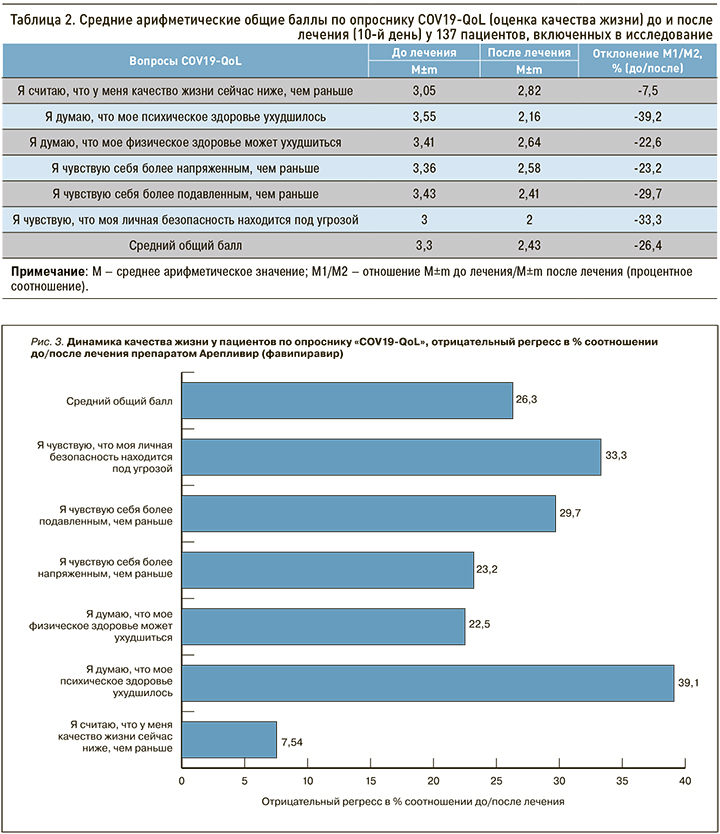
В динамике наблюдения за пациентами выявлено статистически значимое изменение общего среднего балла качества жизни по опроснику COV19- QoL (р <0,05), что свидетельствует об улучшении этого параметра. Общее значение COV19- QoL в выборке до лечения свидетельствует об умеренном уровне негативного воздействия заболевания на качество жизни (M=3,3); после проведенного лечения пациенты ощущали это влияние в сравнительно меньшей степени (M=2,43). При этом произошло снижение количества баллов по каждому пункту опросника COV19-QoL, т.е. наблюдался регресс по всей шкале COV19-QoL, по всем категориям вопросов при сравнении результатов до/после лечения. Наиболее выраженная динамика в контексте повышения качества жизни регистрировалась при ответе на вопросы: «Я думаю, что мое психическое здоровье ухудшилось» и «Я чувствую, что моя личная безопасность находится под угрозой» (рис. 3).
Таким образом, терапия препаратом Арепливир (фавипиравир) характеризуется предсказуемым профилем благоприятной переносимости у пациентов, имеющих статус коморбидности. Можно утверждать, что прием исследуемого препарата позволял предотвратить прогрессирование заболевания до более тяжелой формы и развитие угрожающих жизни состояний у таких пациентов.
Как уже отмечалось, по прошествии двух лет пандемии исследователи многих стран заявили, что ПЦР-метод, используемый для выявления РНК коронавируса, дает высокий процент ложноотрицательных результатов [5]. Это необходимо учитывать при масштабном скрининге во время эпидемического подъема ОРВИ. При постановке диагноза следует прежде всего сопоставлять симптомы и характер поражения легких, однако скудность клинических проявлений или бессимптомное течение COVID-19 могут способствовать ошибочному диагнозу и приводить к осложнениям в постковидном периоде.
Учитывая эти данные, в соответствии с протоколом исследования после окончания лечения через 14 дней пациентам были определены антитела (IgМ и IgG) в отношении COVID-19 и гриппа с помощью экспресс тестов иммунохроматографическим методом. Согласно описанию использованного теста, в ходе исследования устанавливалась качественная характеристика – наличие или отсутствие антител.
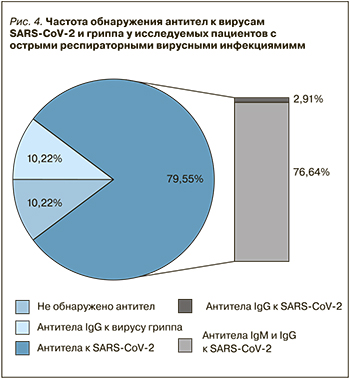
Из 137 исследуемых пациентов с установленным диагнозом ОРВИ при отрицательном результате ПЦР на COVID-19 суммарные антитела IgМ и IgG к SARS-CoV-2 имели 4 (2,91%) человека, только IgG – 105 (76,64%). У 14 пациентов (10,22%) были обнаружены IgG антитела к вирусу гриппа (рис. 4).
Пациентам, у которых были выявлены антитела класса G к SARS-CoV-2, был проведен дополнительный количественный тест ИФА с указанием уровня антител в единицах BAU (BAU – binding antibody units – единицы связывающих антител), принятых первым международным стандартом Всемирной организации здравоохранения (ВОЗ). При этом использовалась рекомендуемая ВОЗ шкала: 0–10 ВАU/мл – результат считать отрицательным, антител практически нет; 80–149,9 BAU/ мл – вирус-нейтрализующий эффект сохраняется только в 50% образцах проб; ≥150 BAU/ мл – все образцы обладают вирус-нейтрализующим эффектом; ≥500 BAU/мл – выработан максимальный уровень антител, вирус-нейтрализующий эффект ярко выражен. У 105 пациентов (76,64%) были обнаружены титры антител (к SARS-CoV-2) в следующих количествах: IgG >10 ВАU/мл – у 39 (28,46%), IgG >150 ВАU/мл – у 66 (48,17%) человек. Значений ≥500 ВАU/мл выявлено не было.
Следует отметить, что данный метод обнаружения антител по времени их накопления у пациентов с различным иммунным статусом при наличии коморбидности не может считаться рациональной оценкой истинной инфекции, вызванной вирусами SARS-CoV-2 или гриппа, поскольку может иметь место перенесенная инфекция без выработки достаточного количества антител. Однако опосредованно полученные результаты доказывают целесообразность назначения препарата Арепливир (фавипиравира) при ОРВИ даже в отсутствие положительного ПЦР-теста с учетом эпидемиологической обстановки, клинического статуса пациента, особенно коморбидных состояний, а также оценки пользы терапии/риска развития или утяжеления состояния и минимизации различных клинических проявлений в постковиде. С высокой долей вероятности можно предположить, что под общей маской ОРВИ мог протекать как COVID-19, так и/или сезонный грипп. Выбор терапии был оправдан по причине эффективного влияния препарата Арепливир (фавипиравир) на все штаммы SARS-CoV-2 и другие РНК-вирусы (вирус гриппа).
ЗАКЛЮЧЕНИЕ
1. Применение препарата Арепливир (фавипиравир) позволяет добиться положительной динамики у пациентов с ОРВИ (включая коморбидных пациентов) и приводит к быстрому регрессу катарально-лихорадочного синдрома.
2. Этиотропная терапия ОРВИ в условиях пандемии (при отрицательном тесте ПЦР на COVID-19) является обоснованной в контексте своевременного предотвращения прогрессирования заболевания до более тяжелой формы и развития угрожающих жизни состояний, снижает риск постинфекционных осложнений в случае ложно-отрицательных анализов на выявление SARS-CoV-2.
3. Анализ полученных результатов демонстрирует, что использование прямой противовирусной терапии (ингибиторов вирусной РНК-полимеразы) эффективно при ОРВИ, включая COVID-19 (SARS-CoV-2 и его различные штаммы) и грипп, а также может быть перспективным в отношении широкого спектра респираторно-вирусных инфекций, вызванных РНК-вирусами. Целесообразно проведения клинических исследований для дальнейшего изучения данного вопроса.
4. Своевременное и обязательное назначение этиотропной направленной противовирусной терапии, особенно в условиях пандемии, позволяет снизить фармакоэкономическую нагрузку на систему здравоохранения за счет превентивного влияния на возможные последствия перенесенных РНК-ассоциированных респираторных заболеваний, а также улучшить качество жизни пациентов.


