ВВЕДЕНИЕ
Синдром раздраженного кишечника (СРК) представляет собой хроническое заболевание кишечника, которое характеризуется наличием рецидивирующей абдоминальной боли, связанной с дефекацией, и изменением характеристик стула (его частоты и формы). Диагноз СРК устанавливается в соответствии с IV Римскими критериями функциональных гастроэнтерологических расстройств при исключении органических причин выявленных симптомов. Принято выделять 4 варианта этого синдрома: СРК с запором, СРК с диареей, смешанный и неклассифицируемый СРК. Являясь психосоматическим расстройством, заболевание часто ассоциируется с тревогой, депрессией, изменением функций мозга, ухудшением качества жизни [1].
По данным систематического обзора и метаанализа Lovell R.M., Ford A.C. (2012), охватившего 90 эпидемиологических исследований в 33 странах мира, заболеваемость СРК в мире дост гает 11,2% [2]. Более того, число случаев СРК неуклонно увеличивается прежде всего за счет постинфекционного СРК: по результатам последующего метаанализа Klem F. et al. (2017), общая распространенность этой формы заболевания в популяции составила 11,5% [3]. При этом в период пандемии новой коронавирусной инфекции ожидается его дальнейший рост.
Представления о патофизиологии СРК основаны на понимании роли изменений микробиоты кишечника, желчных кислот, пищевых антигенов, психосоциальных и генетических факторов, кишечного эпителиального барьера (участвует в формировании измененных реакций основных регуляторов сенсомоторных функций, включая иммунную и энтеральную нервную систему), оси «гипоталамус–гипофиз–надпочечники» и «кишечник–мозг» [4–7].
Кишечная микробиота вовлечена во множество физиологических реакций организма; наряду с прочим она значимо влияет на активность и поведение мозга, используя эндокринные, нервные и иммунные пути. Взаимодействуя с центральной нервной системой, кишечная микробиота участвует в регуляции химического состава мозга и влияет на нейроэндокринные системы, связанные с реакцией на стресс, тревогой и функцией памяти. Существенную роль в этом играют микробные метаболиты, воздействующие на гематоэнцефалический барьер, иммунную дисрегуляцию, модификацию вегетативных сенсомоторных связей и ось «гипоталамус–гипофиз–надпочечники» [8].
Модуляция видового состава и функционального состояния кишечной микробиоты через ось «мозг–кишечник» может влиять на развитие ряда психических заболеваний, включая депрессию, тревожно-депрессивные расстройства, аутизм, когнитивные нарушения (деменция), шизофрению [9–12], a прием антибиотиков, изменяя микробиом кишечника, модифицирует поведенческие реакции, вызывает нарушение пространственной памяти [13–15].
Оптимизация кишечной микробиоты с помощью пробиотиков является одной из ведущих составляющих терапии пациентов с СРК. Пробиотики способствуют сохранению колонизационной резистентности по отношению к патогенной и условно-патогенной микрофлоре, обеспечивают продукцию значимых метаболитов (короткоцепочечных жирных кислот), незаменимых аминокислот (триптофана), медиаторов, витаминов и других регуляторных молекул [16, 17].
Препараты, корригирующие качественный и количественный состав микробиоты кишечника (пре- и пробиотики), могут положительно воздействовать на психопатологические изменения у пациентов, оптимизировать эмоциональную, когнитивную, нервную сферы, оказывать антидепрессивный и анксиолитический эффекты. Благодаря этому они даже получили название «психобиотики» [18]. Как показательный пример можно привести данные систематического обзора и метаанализа Zhu G. et al. (2021), в которых было выявлено существенное влияние пробиотиков на когнитивную функцию, особенно у пациентов с легкими когнитивными нарушениями [19].
Среди средств для коррекции микробиоты кишечника на фармрынке России представляет интерес пробиотик Примадофилус® Бифидус, содержащий штаммы Bifidobacterium longum, Bifidobacterium breve, Lactobacillus rhamnosus, Lactobacillus acidophilus в суточной дозе 3,9×109 КОЕ и дополнительно включающий пребиотик мальтодекстрин. Продукт обладает антибактериальной активностью к кишечным патогенам, иммунокорригирующим и противовоспалительным действием, высоким профилем безопасности, что обеспечивает его эффективность при купировании проявлений диареи, метеоризма, абдоминальной боли у пациентов с функциональными заболеваниями органов пищеварения [20–23].
У штаммов, входящих в его состав, установлены позитивные психологические эффекты в отношении тревожно-депрессивных расстройств, стресса, анксиолитическое действие [24–26].
С учетом вышеизложенного целью нашего исследования стало изучение эффективности пробиотика, содержащего штаммы B. longum, B. breve, L. rhamnosus, L. acidophilus, в составе комплексной терапии больных СРК с диареей (СРК-Д), в том числе оценка его влияния на динамику проявлений диареи, метеоризма, абдоминальной боли, изменений психологических и когнитивных характеристик, показателей качества жизни.
МАТЕРИАЛ И МЕТОДЫ
С использованием метода сплошной выборки в исследование было включено 30 пациентов (11 мужчин и 19 женщин), страдающих СРК-Д. Средний возраст участников составил 35,2±8,7 лет.
Диагноз СРК был верифицирован в соответствии с IV Римскими критериями. Выраженность абдоминальной боли измерялась с помощью визуальной аналоговой шкалы (ВАШ), метеоризм – полуколичественно (0 – отсутствует, 1 – слабо выражен, 2 – умеренно, 3 – значительно). Консистенция стула определялась по Бристольской шкале, частота – по количеству дефекаций за сутки. Для оценки состояния микробиоты кишечника осуществлялся посев кала на дисбактериоз и условно-патогенную флору.
Дополнительно были проведены скрининг депрессии и тревоги (Госпитальная шкала тревоги и депрессии HADS), оценка когнитивной функции (Монреальская когнитивная шкала MoCA) и качества жизни (опросник SF-36).
У всех пациентов исследования выполнялись до и после окончания комплексной терапии.
Статистическая обработка данных проводилась с помощью пакетов программ Microsoft Office (Excel) и STATISTICA for Windows. Формат представления данных: количественные переменные – среднее значение ± стандартная ошибка среднего значения, категориальные переменные – абсолютное значение и проценты. Для оценки достоверности различий количественных переменных применялся критерий Стьюдента, непараметрических – критерий χ2. Различия считали достоверными при р <0,05.
Пациенты соблюдали диетические рекомендации и получали стандартную терапию СРК в соответствии с актуальными клиническими рекомендациями [1], которая включала спазмолитик (мебеверин по 200 мг 2 раза/сут курсом 4 нед), энтеросорбент (смектит диоктаэдрический, доза подбиралась индивидуально, продолжительность приема не превышала 7 дней). Дополнительно с целью коррекции состояния микробиома кишечника участникам исследования был назначен продукт, содержащий лиофилизированные пробиотические микроорганизмы (B. longum, B. breve, L. hamnosus и L. acidophilus) в количестве 3,9 млрд в одной капсуле (Примадофилус® Бифидус). Режим приема – по 1 капсуле в день во время еды сроком 8 нед.
РЕЗУЛЬТАТЫ
Добавление в комплексную терапию пациентов с СРК пробиотика способствовало регрессии клинических проявлений заболевания. Динамика проявлений боли и кишечной диспепсии на фоне проведенной терапии показана в таблице 1.
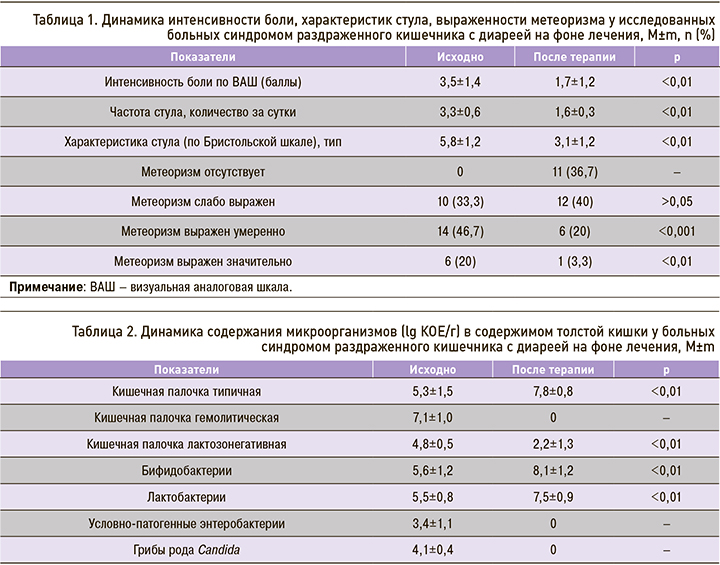
Как следует из таблицы 1, интенсивность боли в животе, оцененная с помощью ВАШ, у больных СРК-Д достоверно уменьшилась с 3,5±1,4 исходно до 1,7±1,2 баллов на фоне комплексной терапии с использованием пробиотика. Отмечена положительная динамика частоты (с 3,3±0,6 до 1,6±0,3) и типа стула (с 5,8±1,2 до 3,1±1,2).
Метеоризм выявлялся у всех наблюдаемых, при этом у 20% пациентов он был выражен значительно, у 46,7% – умеренно, у 33,3% – слабо. После 8-недельного использования пробиотика полная регрессия этого симптома установлена у 36,7% пациентов. Частота значительно выраженного метеоризма значимо уменьшилась с 20 до 3,3%, умеренно выраженного – с 46,7 до 20%.
Характерные изменения содержания микробиоты кишечника, ассоциированные с клиническими проявлениями заболевания, а также их закономерная динамика на фоне пробиотической терапии представлены в таблице 2.
Данные таблицы 2 свидетельствуют о наличии у наблюдаемых пациентов дисбиотических изменений микробиты кишечника, характеризующихся снижением содержания типичной кишечной палочки, бифидо- и лактобактерий, ростом условно-патогенных энтеробактерий, грибов рода Candida. Комплексная терапия, включающая пробиотик, способствовала положительной динамике состояния кишечной микробиоты: увеличению содержания типичной кишечной палочки (с 5,3±1,5 до 7,8±0,8 lg КОЕ/г), бифидобактерий (с 5,6±1,2 до 8,1±1,2 lg КОЕ/г), лактобактерий (с 5,5±0,8 до 7,5±0,9 lg КОЕ/г), а также элиминации условно-патогенных энтеробактерий, гемолитической кишечной палочки, грибов рода Candida.
Скрининг тревоги и депрессии, когнитивных изменений имеет большое значение у пациентов с СРК. Данные, отражающие эти параметры, приведены в таблице 3.

У наблюдаемых пациентов не выявлялись достоверно выраженные симптомы тревоги и депрессии, хотя исходно показатели шкалы HADS приближались к пограничному значению субклинической тревоги/депрессии (5,9±1,9 и 5,2±1,3 балла соответственно). После 8-недельной пробиотической терапии было отмечено достоверное снижение уровня тревоги с 5,9±1,9 до 3,2±0,7 балла. Использование Монреальской когнитивной шкалы продемонстрировало тенденцию к увеличению показателя когнитивных функций – с 25,2±2,9 балла исходно до 26,9±2,7 балла по окончании комплексной терапии.
При анализе результатов опросника SF-36 обнаружена тенденция к возрастанию показателей качества жизни у обследованных пациентов по всем шкалам. При этом достоверные отличия по сравнению с исходными показателями были установлены по шкалам психологического здоровья (71,8±11,7 против 42,9±14,5 балла), эмоционального функционирования (72,9±13,5 против 43,7±14,6 балла) и ролевого функционирования (76,3±12,9 против 50,2±11,3 балла).
ОБСУЖДЕНИЕ
Проведенное исследование было посвящено оценке эффективности пробиотика (B. longum, B. breve, L. rhamnosus, L. acidophilus 3,9×109 КОЕ/ сут) в комплексной терапии клинических проявлений СРК с диареей (абдоминальной боли, метеоризма, характеристик стула), а также модификации психологических, когнитивных особенностей и качества жизни пациентов.
В работе дана характеристика интенсивности абдоминальной боли (по ВАШ), частоты стула и его типа (по Бристольской шкале), наличия и выраженности метеоризма у пациентов с СРК с диареей. Полученные результаты в полной мере соответствуют данным литературы о клинической картине заболевания [1].
В основе патогенетических механизмов СРК, реализующихся в клинические проявления заболевания, лежат изменения кишечной микробиоты, оценка которых важна в клинической практике [4].
При бактериологическом исследовании кала у наблюдаемых пациентов были выявлены дисбиотические изменения микробиoты кишечника в виде снижения содержания типичной кишечной палочки, количества бифидо- и лактобактерий, пролиферации условно-патогенных энтеробактерий, грибов рода Candida. Отметим, что литературные данные свидетельствуют о широком спектре количественных и качественных изменений микробной популяции кишечника у пациентов с СРК, результирующие эффекты которых заключаются в изменении метаболома, протеома, генома пациента [4].
Особый интерес в клинической практике представляет оценка влияния кишечной микробиоты на функции мозга, особенно связанные с реакцией на стресс, тревогой и памятью. У исследованных пациентов показатели тревоги и депрессии, оцененные с помощью шкалы HADS, были близки к границе выявления субклинической тревоги/депрессии (8 баллов), в определенной степени отражая высокий риск развития этих состояний [27].
В систематическом обзоре и метаанализе Carson N., Leach L., Murphy K.J. (2018) было проведено определение диагностической точности применения теста MoCA в отношении развития умеренных когнитивных нарушений. В качестве пограничного показателя предложено использовать значения шкалы ≤23 баллов (ранее ориентиром был показатель 26 баллов), поскольку такой подход обеспечивает уменьшение частоты ложноположительных результатов и обладает более надежной диагностической ценностью и точностью [28, 29].
По данным Монреальской когнитивной шкалы, средний показатель у больных СРК-Д в нашем исследовании равнялся 25,2±2,9 балла, при этом у части пациентов (n=5; 16,7%) он составлял 23 балла и ниже (22,4±0,9), что свидетельствовало о наличии когнитивных нарушений.
Применение комплекса лиофилизированных пробиотических микроорганизмов (B. longum, B. breve, L. rhamnosus и L. acidophilus) по 1 капсуле (3,9 млрд микроорганизмов) в день в течение 8 нед в составе комплексной терапии СРК-Д способствовало улучшению состава кишечной микробиоты: нормализации содержания типичной кишечной палочки, бифидобактерий и лактобактерий, элиминации условно-патогенных энтеробактерий, гемолитической кишечной палочки, грибов рода Candida. На этом фоне отмечена положительная динамика клинической картины заболевания в виде снижения интенсивности абдоминальной боли, нормализации частоты и характера стула, уменьшения выраженности метеоризма. В связи с этим представляет интерес положительная динамика уровня тревоги в виде уменьшения ее показателя по шкале HADS. В то же время уровень депрессии по этой шкале значимо не изменился. Анализ данных Монреальской когнитивной шкалы продемонстрировал тенденцию к увеличению ее показателя на фоне терапии. При этом в группе пациентов (n=5) с исходно сниженным значением показателя по МоСА (22,4±0,9 балла) проведенное лечение с включением пробиотика привело к его достоверному увеличению (до 26,7±1,5 балла), что свидетельствовало о регрессии когнитивных нарушений. Улучшение качества жизни (опросник SF-36) было выявлено по шкалам психологического здоровья, эмоционального и ролевого функционирования.
В подтверждение полученных результатов положительные эффекты в отношении коррекции проявлений тревожного синдрома и депрессии были установлены у входящих в состав изучаемого пробиотика штаммов L. helveticus (acidophilus) R0052 и B. longum R0175 как на животных моделях, так и в клинической практике [24, 25].
По данным двойного слепого рандомизированного плацебо-контролируемого исследования, прием L. Acidophilus R0052 и B. longum R0175, в отличие от контроля, обеспечил улучшение общего индекса психического благополучия (лист регистрации симптомов Хопкинса) за счет снижения уровней по субшкалам соматизации, депрессии и гнева–враждебности, уменьшение общего балла по шкале HADS, а также способствовал регрессии стресс-индуцированных гастроэнтерологических симптомов (тошноты, боли в животе) [26].
Влияние пробиотика на когнитивные функции подтверждено выполненным в 2022 г. двойным слепым рандомизированным плацебо-контролируемым перекрестным исследованием пробиотического продукта, содержащего B. longum R0175 , L. helveticus R0052 и Lactiplantibacillus plantarum R1012 (всего 3×109 КОЕ/сут), в котором было показано его положительное воздействие на функциональные реакции мозга у здоровых субъектов во время задания на эмоциональное внимание (по данным функциональной магнитно-резонансной томографии) [30].
Полученные результаты подтверждают клиническую эффективность пробиотика, содержащего B. longum, B. breve, L. rhamnosus и L. acidophilus в количестве 3,9 млрд микроорганизмов в 1 капсуле (Примадофилус® Бифидус) в комплексной терапии больных СРК-Д, свидетельствуют о положительном влиянии продукта на психологические характеристики и когнитивные способности. При этом требуются дальнейшие исследования для уточнения степени выраженности, характера и механизмов влияния пробиотика на функции мозга.
ЗАКЛЮЧЕНИЕ
Включение пробиотика, содержащего B. longum, B. breve, L. rhamnosus и L. acidophilus 3,9×109 КОЕ в 1 капсуле (Примадофилус® Бифидус), в комплексную терапию больных СРК-Д способствовало снижению выраженности абдоминальной боли, нормализации характеристик стула, уменьшению проявлений метеоризма, понижению уровня тревоги, улучшению когнитивной функции у пациентов с предшествующим ее снижением, повышению качества жизни.



