Внебольничная пневмония (ВП) на сегодняшний день остается весьма частым заболеванием в популяции и одной из ведущих причин летальных исходов. Осложненное течение ВП, как правило, становится следствием несвоевременной диагностики, неверного определения тяжести состояния и степени риска, неадекватной терапии, неудовлетворительного контроля за динамикой воспалительного процесса и эффективностью проводимых лечебных мероприятий. Нередко нежелательные исходы развиваются из-за не выявленных или не скомпенсированных сопутствующих нарушений со стороны других органов и систем, в первую очередь сердечно-сосудистой системы. Немаловажную роль при этом играют нежелательные побочные действия применяемых препаратов, усиливающиеся в результате их несовместимости или полипрагмазии.
Считается, что только 20% больных ВП имеют показания для лечения в условиях стационара [1]. В остальных случаях подтверждение диагноза и лечение возможно осуществить в амбулаторных условиях. При этом терапия должна быть начата как можно быстрее, поскольку доказано, что ее задержка более чем на 8 ч приводит к значительному повышению летальности [2].
При выборе тактики терапии необходимо учитывать данные об этиологии ВП, различающейся в зависимости от региона, что в современных условиях повышенной миграции населения диктует необходимость установления эпидемиологического анамнеза у каждого пациента. Так, по данным исследования, проведенного в 2013–2014 гг. на Ближнем Востоке, в этиологической структуре ВП наиболее распространенным возбудителем был S. pneumoniae (24,4%), далее следуют Mycobacterium tuberculosis (17,5%), S. aureus (6,7%), вирус гриппа А (4,2%), Klebsiella pneumoniae, Brucella melitensis у 0,8% пациентов. Возбудители пневмонии оставались неизвестными у 40% пациентов [3]. В странах Азиатско-Тихоокеанского региона доминирующими возбудителями являются вирусы гриппа (18%), Klebsiella pneumoniae (14%) и S. pneumoniae (13%) [4]. В Европе 28% ВП являются чисто бактериальными, 15% только вирусной этиологии, 19% носят характер вирусно-бактериальной сочетанной инфекции. S. pneumoniae занимает лидирующие позиции в этиологии – 30%, вирусы гриппа –15%, риновирус – 12%. При этом этиологическая структура ВП носит ярко выраженный сезонный характер: зимой и весной вирусы обнаруживались чаще (45%, Р=0,01) и обычно в сочетании с бактериями (39%) [5].
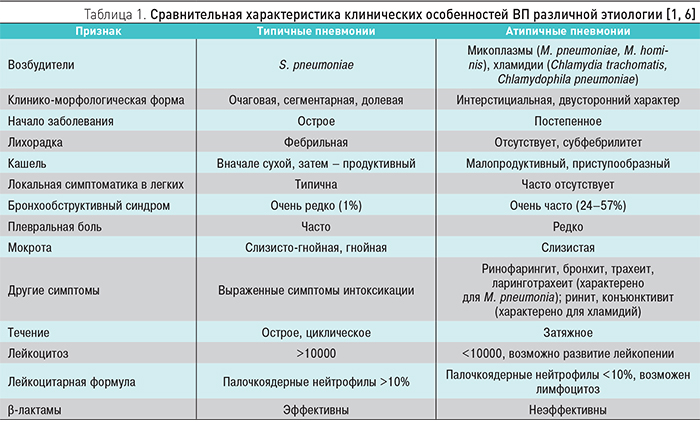
В нашей стране S. pneumoniae является этиологическим фактором в 30–50% случаев, на долю M. pneumoniae и C. pneumoniae приходится от 8 до 30% [1]. Для лиц, злоупотребляющих курением, наиболее характерна ассоциация H. influenzae и M. catarrhalis.
Клинические особенности ВП определяются этиологией заболевания (табл. 1).
Вне зависимости от выбранной тактики ведения всем пациентам с ВП необходимо проведение рентгенографического исследования органов грудной клетки для подтверждения диагноза пневмонии и последующей оценки динамики патологического процесса. Особенности инфильтрации легочной ткани в ряде случаев могут косвенно указывать на вероятность участия типичной или атипичной флоры в качестве возбудителя ВП, что помогает при выборе антибиотика. Так, для микоплазменной этиологии пневмонии характерны негомогенные инфильтраты, часто расположенные в верхних долях легких.
Клинический анализ крови помогает подтвердить диагноз. Но у некоторых больных ВП его показатели могут оставаться в пределах нормы, что нередко наблюдается при иммунодефицитных состояниях. Иногда воспалительный процесс сопровождается лейкопенией, которая свидетельствует о неблагоприятном течении пневмонии.
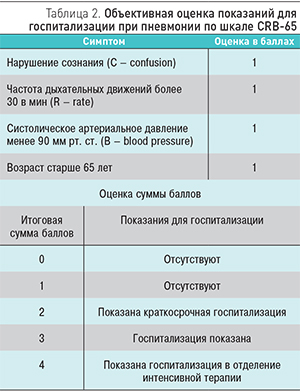
Госпитализации подлежат больные с тяжелыми формами ВП, признаками дыхательной недостаточности, декомпенсации сопутствующих заболеваний, при невозможности обеспечения адекватного ухода и лечения в домашних условиях. Для объективной оценки показаний к госпитализации пациентов при вероятном или подтвержденном диагнозе пневмонии на основании тяжести течения были предложены различные методы. Наиболее проста и удобна для использования в повседневной практике шкала СRB-65, представленная в табл. 2 [1, 7, 8]. Госпитализация необходима при одновременном сочетании 3 и более из следующих показателей: нарушение сознания, одышка, систолическая артериальная гипотензия, возраст старше 65 лет.
 Терапевтическая тактика при острых ВП включает в себя четыре основных компонента:
Терапевтическая тактика при острых ВП включает в себя четыре основных компонента:
- Этиотропная терапия:
- антибактериальные лекарственные средства (ЛС) для системного применения;
- антибактериальные ЛС для местного применения (по показаниям);
- антисептики для местного применения (по показаниям).
- Иммунотерапия (по показаниям):
- иммуномодуляторы;
- заместительная терапия;
- иммунотропные препараты для местного применения.
- Симптоматическая терапия:
- терапия лихорадки (жаропонижающие ЛС);
- противовоспалительные ЛС;
- комплексная терапия ринита и/или ринофарингита (элиминационные препараты, назальные деконгестанты);
- комплексная терапия синдрома кашля (отхаркивающие, муколитические, бронхолитические и прочие ЛС).
- Немедикаментозные методы лечения:
- массаж;
- дыхательная гимнастика;
- физиотерапия.
Общепризнано, что основой лечения пневмонии является антибактериальная терапия, которая назначается с учетом клинических данных, предполагаемого возбудителя, данных об антибиотикорезистентности и возможных нежелательных побочных эффектах. На сегодняшний день отмечается существенное увеличение вклада в этиологическую структуру пневмоний атипичной микрофлоры, в первую очередь Mycoplasma pneumoniae и Chlamydia pneumoniae, обладающих природной резистентностью к наиболее часто применяемым антибиотикам пенициллинового и цефалоспоринового ряда. В исследованиях было показано, что частота их выявления у больных ВП от 8 до 70% в зависимости от обследуемого контингента; чаще они обнаруживаются у лиц молодого возраста [7, 9]. Нередко имеет место сочетание этих патогенов с типичной флорой. Также следует отметить, что в настоящее время увеличивается число множественно-резистентных штаммов Streptococcus pneumoniae. Среди других частых возбудителей ВП можно отметить Moraxella catarrhalis и Haemophilus influenza; повышается доля бактерий, продуцирующих β-лактамазу.
Считается, что у некоторых пациентов антибиотик может быть единственным ЛС для успешного лечения ВП. В амбулаторных условиях предпочтение следует отдавать пероральному приему ЛС, т.к. их парентеральное введение нередко связано с риском развития осложнений и несоблюдением интервалов между инъекциями. В настоящее время отсутствуют убедительные доказательства преимущества парентерального введения антибиотиков перед пероральным [7, 10]. Вместе с этим антибактериальный препарат для амбулаторного лечения должен иметь широкий спектр действия, низкий риск побочных явлений и, по возможности, меньшую кратность приема.
Стартовый антибактериальный препарат для лечения ВП в абсолютном большинстве случаев назначается эмпирически. К антибиотикам первого ряда выбора в настоящее время относят полусинтетические пенициллины расширенного спектра действия (амоксициллин, амоксициллин/клавуланат) и макролиды (рокситромицин, азитромицин и др.). Учитывая значительную частоту микоплазменных и хламидийных пневмоний, высокую вероятность сочетанной этиологии заболевания, у большинства пациентов с диагностированной пневмонией в амбулаторных условиях следует отдавать предпочтение макролидам [1, 11]. Стоит отметить, что макролиды характеризуются наиболее благоприятным фармакологическим профилем с точки зрения клиницистов – это и широкий спектр антимикробного действия (грамположительные кокки, Moraxella catarrhalis, Haemophilus influenzae, Bordetella pertussis, легионелла, кампилобактер, листерии, спирохеты, хламидии, микоплазмы, уреаплазмы, анаэробы и др.), высокий профиль безопасности, хорошая переносимость и комплаетность.
Одним из перспективных антибактериальных средств группы макролидов является рокситромицин (Эспарокси), представляющий собой кислотоустойчивый полусинтетический 14-членный макролид. Для него доказана антибактериальная активность в отношении грамположительных кокков (S. pyogenes, S. pneumoniae, S. aureus), возбудителей коклюша, дифтерии, моракселл, легионелл, кампилобактеров, листерий, спирохет, хламидий (C. trachomatis, C. pneumoniae), микоплазм, уреаплазм, анаэробов (кроме B. fragilis) и простейших (T. gondii, Cryptosporidium spp.). Препарат также оказывает постантибиотический эффект, продолжающийся в отношении грамположительных микроорганизмов в течение 6–7 ч [13, 14].
Клиническая и фармакоэкономическая эффективность рокситромицина (150 мг 2 раза/сут) в терапии инфекций нижних дыхательных путей была подтверждена целым рядом исследований в сравнении с амоксициллином с клавулановой кислотой (625 мг 3 раза/сут) [15], цефаклором (250 мг 3 раза/сут) [16], эритромицином стеаратом (500 мг 2 раза/сут) [17], цефиксимом [18]. По данным клинических исследований, рокситромицин характеризовался хорошим терапевтическим профилем (сокращалась продолжительность лечения, выше комплаетность у пациентов, достоверно меньшая потребность в пролонгированных/повторных курсах антибактериальной терапии), высоким профилем безопасности (значительно меньше вероятность развития побочных эффектов [не более 4%], хорошая переносимость) и фармакоэкономической эффективностью (снижение стоимости курсового лечения).
Рокситромицин назначают внутрь, до еды, по 150 мг 2 раза/сут (утром и вечером) или 300 мг однократно.
Необходимо подчеркнуть, что наличие противовоспалительного действия у антибиотиков группы макролидов позволяет рассматривать данную группу как наиболее предпочтительную [19].
Оценка эффективности терапии проводится через 48–72 ч после первого приема антибиотика. Критериями, свидетельствующими о правильности выбора антибактериального ЛС, являются отсутствие интоксикации, нормальная температура тела, частота дыхательных движений менее 20 в мин. При отсутствии положительной динамики необходимо провести замену на препарат другой группы (цефалоспорины, фторхинолоны). Длительность антибактериальной терапии может составлять от 5 (при нетяжелом течении ВП на фоне лечения макролидами) до 14 сут и более. Отмена антибиотика производится при стойко нормальной температуре тела в течение не менее 3-х сут, отсутствии гнойной мокроты и интоксикации. При этом на рентгенограммах еще могут сохраняться инфильтративные изменения.
Воспалительный процесс в органах респираторного тракта сопровождается изменением вязкости трахеобронхиального секрета за счет уменьшения удельного веса воды и повышения концентрации гликопротеинов. Это, в свою очередь, снижает мукоцилиарный клиренс, способствует повышенной адгезии мокроты и патогенных микроорганизмов к слизистым оболочкам дыхательных путей, что диктует необходимость включения в комплексную терапию средств, направленных на снижение адгезивности и вязкости мокроты, а также на улучшение дренажной функции бронхов. В этой связи наиболее часто используют муколитические ЛС.
Во многих работах была показана высокая эффективность ацетилцистеина, карбоцистеина, бромгексина, амброксола (метаболит бромгексина) при различных бронхолегочных заболеваниях за счет их активного отхаркивающего и секретолитического действия.
ЛС, подавляющие кашлевой центр, противопоказаны при пневмонии, поскольку способствуют пролонгированию инфекционно-воспалительного процесса в легочной ткани.
Отхаркивающие средства как рефлекторного действия (повышают выработку слизи, активность эпителия в дыхательных путях за счет рефлекторного раздражения на слизистой оболочке желудка), так и прямого резорбтивного действия (оказывают раздражающее действие на слизистые бронхов, увеличивая тем самым секрецию мокроты) могут быть рекомендованы пациентам с адекватным кашлевым рефлексом, у которых увеличение количества мокроты не приведет к синдрому «заболачивания» легких. К этой категории препаратов относятся главным образом ЛС на основе растительного сырья – термопсиса, багульника, мать-и-мачехи, алтея, подорожника, чабреца и пр.



