Микробиота кишечника является важнейшей составной частью гомеостаза организма. Ее количественные и качественные нарушения традиционно относят к понятию «дисбактериоз». В последнее время широко используется термин «дисбиоз кишечника», образованный из латинских слов «dis» – затруднение, нарушение, расстройство и «bios» – жизнь. Дисбиоз – это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Дисбактериоз кишечника всегда вторичен и представляет собой клинико-лабораторный синдром, который развивается при целом ряде заболеваний и клинических ситуаций и характеризуется изменением качественного и/или количественного состава микрофлоры определенного биотопа, транслокацией различных ее представителей в несвойственные биотопы, а также метаболическими и иммунными нарушениями у части пациентов [1].
Термин «дисбактериоз» был введен в клиническую практику в 1916 г. немецким врачом A. Nissle [2] для обозначения явлений бродильной и гнилостной диспепсии. За рубежом чаще используют термин «синдром избыточного бактериального роста». Его определение носит более конкретный характер, и постановка диагноза базируется на обнаружении более 105 микроорганизмов в 1 мл аспирата из тощей кишки и/или появлении флоры, характерной для толстой кишки [4].
В последние годы проблема дисбактериоза вызывает немало дискуссий у специалистов различного профиля – клиницистов и бактериологов. По мнению многих из них, такой нозологической единицы не существует, хотя в отечественных публикациях часто встречаются термины «дисбактериоз» или «дисбиоз кишечника». Дисбактериоз описывают даже в качестве самостоятельного заболевания, однако в существующих международных классификациях болезней он отсутствует. Некоторые авторы подчеркивают, что дисбактериоз, или дисбиоз, – не заболевание, а отклонение от нормы одного из параметров гомеостаза. Он всегда вторичен и причинно обусловлен. Данная точка зрения имеет важное практическое значение, т.к. исключает принадлежность дисбактериоза к самостоятельным болезням человека. В то же время сама возможность наличия такого патологического состояния, как дисбактериоз, никем не отрицается, поскольку в основе его развития лежат многообразные изменения в качественном и количественном составе микрофлоры пищеварительного тракта [5].
Особого внимания заслуживают работы последних десяти лет, подчеркивающие важную роль микрофлоры кишечника в функционировании желудочно-кишечно-мозговой оси. По существу в настоящее время формируется точка зрения, что микрофлора является составной частью единой системы, включающей в себя ряд основных элементов центральной нервной системы, вегетативной нервной системы (симпатической и парасимпатической), диффузной нейроэндокринной системы и, конечно же, микрофлоры кишечника [6]. Синхронизация сигнализации вдоль данной оси облегчается функционированием сложной рефлекторной сети афферентных волокон, их проектированием на корковые структуры центральной нервной системы с последующим эфферентным влиянием на гладкие мышцы в стенке кишечника [7]. Существующая триада нейронных, гормональных и иммунологических воздействий обеспечивает моторные, сенсорные, вегетативные и секреторные функции желудочно-кишечного тракта (ЖКТ). Данные же механизмы дают возможность ЖКТ модулировать функции мозга [8]. Вместе с тем следует подчеркнуть, что, несмотря на то, что имеющиеся связи между нейроэндокринной системой пищеварительного тракта и центральной нервной системой достаточно полно описаны в литературе, предполагаемая роль кишечной микробиоты в этой конструкции продолжает изучаться [1]. Таким образом, становится понятно, что кишечная микрофлора принимает участие в протекании почти всех нормальных физиологических процессов в организме, включая те иммунологические особенности, которые включают в себя желудочно-кишечно-мозговую ось [14, 15]. При этом не вызывает сомнения тот факт, что сама микрофлора кишечника может самостоятельно регулировать нейроэндокринный аппарат пищеварительного тракта [9].
В зависимости от времени присутствия бактерий в кишечнике (постоянного или периодического) микрофлору здоровых людей подразделяют на несколько видов:
- индигенную, резидентную или облигатную (бифидо-, лактобактерии, кишечная палочка, бактероиды, энтерококки);
- факультативную, или непостоянную (стафилококки, протей, клостридии, кампилобактер, клебсиеллы, микрококки, некоторые эшерихии);
- случайную, или транзиторную (синегнойная палочка, патогенные энтеробактерии).
По локализации в кишечнике микроорганизмы также можно разделить на две группы, отличающиеся друг от друга по количественной и качественной характеристикам:
- мукоидная (мукозная) микрофлора (М-микрофлора; преимущественно бифидо- и лактобактерии), тесно ассоциированная с эпителием слизистой оболочки кишечника;
- полостная микрофлора (П-микрофлора), представленная микроорганизмами, которые локализуются в просвете кишечника (бактероиды, вейлонеллы, энтеробактерии).
В зависимости от расщепляемых микрофлорой пищевых веществ бактерии разделяют на протеолитические (бактероиды, протей, клостридии, кишечная палочка) и сахаролитические (бифидо- и лактобактерии, энтерококки). Имеются убедительные доказательства того, что кишечная микробиота тесно связана с серией метаболических заболеваний человека: ожирением, сахарным диабетом (СД), метаболическим синдромом (МС), являющихся неинфекционной эпидемией современного общества [10, 11]. Настораживает тот факт, что изменения в составе микрофлоры кишечника могут быть источником бактеремии у тучных людей, и одним из вероятных механизмов считается увеличение кишечной проницаемости при патологических изменениях энтеральной микробиоты [12, 13].
Прослеживается тесная связь транслокации микробов в кишечнике с риском сердечно-сосудистых заболеваний (ССЗ) [13–15]. Так, нарушения микробиоты кишечника ведут к уменьшению поглощения липидов из кишечника и повышению уровня холестерина плазмы крови, что увеличивает риск ССЗ, за счет регулирования серии сигнальных молекул, таких как Farnesoid X рецептор и рецептор сопряженный с G-белком [16]. В одном из исследований показано негативное влияние триметиламин-N-оксида – атерогенного соединения, производимого кишечной флорой от холина и бетаина [17, 18] – на заболеваемость и смертность от сердечно-сосудистых событий [19]. Целый ряд данных четко продемонстрировал, что кишечная микробиота может выступать в качестве независимого фактора риска для ССЗ, что дает возможность определить в полной мере возможности терапии этой патологии.
Растущий объем опубликованных данных демонстрирует, что изменения в микрофлоре кишечника могут выступать в качестве эпигеномных факторов прогрессирования неалкогольной жировой болезни [20, 21] и МС [22, 23]. Нарушения кишечной микробиоты способствуют повреждению печени путем поломки кишечного барьера или за счет транслокации самих микробов, или продуктов их метаболизма [24]. Так, многочисленные экспериментальные исследования показали, что отсутствие изменений в составе микрофлоры кишечника формирует устойчивость к стеатозу печени, индуцированному нарушением питания и ведущему к ожирению [25].
Дисбаланс в кишечной флоре был выявлен у пациентов с синдромом хронической усталости [26]. При этом доля грамотрицательных Escherichia coli была уменьшена у данной категории больных в отличие от здоровых (49 против 92,3%). Более поздние исследования показали, что при нормализации микрофлоры кишечника у пациентов с синдромом хронической усталости отмечается или значительное улучшение, или полное разрешение симптомов на протяжении последующих 15–20 лет (58%) [27].
Особый интерес представляют работы по изучению микробиоты человека при аллергических заболеваниях. Это связано со значительным ростом аллергических заболеваний в современном обществе за последние 50 лет. В настоящее время существую две гипотезы, объясняющие данную пандемию: гипотеза гигиены и гипотеза микробиоты [28–30]. Последняя гипотеза предполагает, что нарушение кишечной микробиоты объясняет манифестацию аллергии. Было проведено достаточно большое число экспериментальных и клинических исследований с целью оценки взаимосвязи между аллергическими заболеваниями и микробиотой людей и мышей [31]. Был продемонстрирован важный фактор влияния антибиотиков в раннем периоде жизни на возникновение последующей атопии, проявляющейся аллергической астмой и пищевой аллергией при изменении состава кишечной микробиоты [31–33]. Последующая стратегия назначения пробиотиков показала определенное положительное влияние на модели животных в предотвращении развития астмы [34]. Подобные данные были получены и у человека [35]. В связи с этим авторы констатируют, что использование пробиотиков представляется перспективным в восстановлении иммунного гомеостаза путем нормализации сложных сообществ бактерий, которые обеспечивают стабильность колонизационной резистентности [28].
Нарушения состава микрофлоры, часто выявляемые в клинической практике, требуют взвешенной клинической оценки и обоснованного принятия решения о необходимости и путях коррекции дисбиоза. При выборе тактики лечения больного с дисбактериозом кишечника следует помнить, что нарушения микробиоценоза всегда носят вторичный характер. В связи с этим лечение больного обязательно должно проводиться с учетом терапии основной причины, состояния моторно-двигательной функции кишечника, процессов пищеварения и иммунной реактивности организма. Воздействие непосредственно на кишечную микрофлору включает пять последовательных этапа:
- Устранение экзогенных факторов риска (коррекция питания, употребление чистой питьевой воды и пр.).
- Компенсация нарушенных функций организма и достижение ремиссии хронических заболеваний.
- Подавление избыточной условно-патогенной микрофлоры.
- Прием препаратов/продуктов, содержащих живые бактерии с учетом возраста и состояния биоценоза.
- Закрепление полученного на предыдущих этапах первоначального эффекта.
В современных условиях с целью коррекции нарушений микрофлоры кишечника на фоне различных заболеваний и антибиотикотерапии применяются пробиотики, арсенал которых в последнее время прогрессивно пополняется [36–38]. Термин «пробиотики» был предложен D. Lilli, R. Stillwell в 1965 г. [39]. Под ним понимают живые микроорганизмы, которые после принятия внутрь восстанавливают микробный состав кишечника. К ним относят лакто- и бифидобактерии, стрептококки, непатогенные штаммы кишечной палочки и клостридий, грибы Saccharomyces boulardii. Не исключено, что само определение «пробиотики» в недалеком будущем может быть подвергнуто коррекции, т.к. предполагается, что терапевтический эффект может быть достигнут не только с помощью живых, но и погибших микроорганизмов или их составных частей (например, пробиотической ДНК). В связи с этим даже предлагается новое название пробиотиков – алиментарные фармакобиотики [40].
 В соответствии с определением, данном в Приказе МЗ РФ № 388 от 01.11.2001 «О государственной стандартизации качества лекарственных средств», пробиотики – это апатогенные для человека бактерии, обладающие антагонистической активностью в отношении патогенных и условно-патогенных бактерий, обеспечивающие восстановление нормальной микрофлоры кишечника. С точки зрения клинической фармакологии пробиотики – это препараты, БАД1-парафармацевтики, а также продукты питания, в состав которых входят микробы – представители нормальной микрофлоры кишечника или их метаболиты, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции и биохимические реакции организма хозяина через оптимизацию его микроэкологического статуса. Для создания пробиотиков используют, преимущественно, живые культуры микробов – представителей индигенной флоры, выделенные от человека и обладающие:
В соответствии с определением, данном в Приказе МЗ РФ № 388 от 01.11.2001 «О государственной стандартизации качества лекарственных средств», пробиотики – это апатогенные для человека бактерии, обладающие антагонистической активностью в отношении патогенных и условно-патогенных бактерий, обеспечивающие восстановление нормальной микрофлоры кишечника. С точки зрения клинической фармакологии пробиотики – это препараты, БАД1-парафармацевтики, а также продукты питания, в состав которых входят микробы – представители нормальной микрофлоры кишечника или их метаболиты, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции и биохимические реакции организма хозяина через оптимизацию его микроэкологического статуса. Для создания пробиотиков используют, преимущественно, живые культуры микробов – представителей индигенной флоры, выделенные от человека и обладающие:
- устойчивостью к низкой рН желудочного сока, желчным кислотам, бактериоцинам и др.
- высокой адгезивностью и антагонизмом к условно-патогенной и патогенной микрофлоре;
- способностью к оптимальному росту в кишечнике и самоэлиминации;
- низкой степенью транслокации через кишечный барьер;
- способностью к длительному сохранению жизнеспособности в ЖКТ.
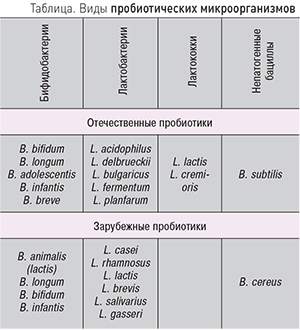
Виды микроорганизмов, используемых для разработки пробиотиков, представлены в таблице.
Несмотря на имеющийся научный консенсус, не существует четкого определения термина «пробиотик». Минимальными критериями для пробиотических продуктов является то, что пробиотик должен быть:
- определен по классу и штамму – исследования специфических пробиотических штаммов не могут применяться к любому продукту, заявленному как пробиотик;
- получен живым в адекватной дозе к концу срока реализации (с минимальной вариабельностью между партиями товара);
- эффективным и подтвержден доказанными контролируемыми исследованиями на пациентах.
Т.к. стандарты хранения пробиотика и утверждений производителя не установлены повсеместно и/или не утверждены, производство должно само поддерживать интеграцию в составе продукта и своих заявлений так, чтобы потребитель мог доверять категории продукта.
Видовой состав микроорганизмов, применяемых для изготовления бактериальных препаратов, охватывает самые различные классификационные группы и не исчерпывается только представителями защитной симбиотической микрофлоры. В состав пробиотиков включаются также живые культуры Stretococcus thermophilus, Esherichia coli, Enterococcus faecium, представители споровой флоры.
Пробиотические штаммы микроорганизмов активируют иммунитет слизистой кишечника посредством стимулирования синтеза цитокинов, секреции IgA, фагоцитоза и производства веществ (органические кислоты, перекись водорода и бактериоцины), которые оказывают ингибирующее влияние на все факторы бактериальной агрессии. Они также конкурируют за питательные вещества с патогенными бактериями и таким образом подавляют жизнедеятельность возбудителя. Пробиотики также оказывают трофическое воздействие на слизистую кишечника (путем стимулирования пролиферации нормального эпителия, который поддерживает слизистый барьер кишечника), модулируют врожденные и адаптивные иммунные механизмы, тем самым предотвращая бактериальную транслокацию [42–44].
Показания к применению пробиотиков в комплексном лечении (доказанные эффекты):
- острые и затяжные кишечные инфекции;
- антибиотикассоциированная диарея и ее профилактика;
- гастроэнтерологические заболевания (гастриты, язвенная болезнь желудка и 12-перстной кишки, ассоциированные с H. pylori, синдром раздраженного кишечника, жировая болезнь печени, ферментопатии – дисахаридазная недостаточность, функциональный запор, воспалительные заболевания кишечника – неспецифический язвенный колит и болезнь Крона);
- аллергические заболевания, в том числе пищевая, респираторная и дермато-интестинальная поливалентная аллергия, бронхиальная астма;
- хронические заболевания носоглотки и ротоглотки;
- дисметаболические нефропатии (гипероксалурия);
- гематоонкологические заболевания (лейкозы);
- стрессы;
- гипертоническая болезнь;
- урогенитальные заболевания (вагиноз, кольпит, уретрит, эндоцервицит);
- гельминтозы;
- синдром хронической усталости;
- МС;
- СД.
В настоящее время все пробиотики делятся на три группы:
- препараты;
- биологически активные добавки к пище (парафармацевтики или нутрицевтики);
- продукты функционального питания, содержащие живые пробиотические микробы.
Все пробиотики могут отличаться по количественному и видовому представительству входящих в них штаммов микробов. Современная классификация пробиотиков – лекарственных средств основана на различиях препаратов по составу и комбинациям живых микробных клеток со стимуляторами их роста и метаболитами. Основными микроорганизмами, входящими в состав практически всех препаратов, являются бифидо- и лактобактерии, но могут включаться также и другие микроорганизмы (стрептококки, энтерококки, эшерихии и др.) В зависимости от количества включенных в препарат штаммов индигенных микроорганизмов и их сочетаний различают монокомпонентные, поликомпонентные, комбинированные, бациллярные и метаболические пробиотики.
В состав монопробиотиков входит только один штамм бифидобактерий, лактобактерий и эшерихий – постоянных представителей микрофлоры кишечника. Монопробиотики, за исключением сорбированных на углях, применяются при дисбактериозах I степени с заместительной и профилактической целью на протяжении 2 нед.
Поликомпонентные пробиотики представляют собой препараты на основе симбиотических сообществ, доминирующих в микроэкологии индигенных микроорганизмов, что позволяет максимально приблизить их состав к естественному микробиоценозу кишечника для достижения комплексного эффекта. К особенностям биологического эффекта поликомпонентных пробиотиков относятся:
- суммация полезных свойств, присущих отдельным штаммам, и повышение их биологической активности;
- возможность избирательного заселения кишечника полезными микроорганизмами того вида, который наиболее адекватен микробиоценозу конкретного индивидуума, что не включает необходимость обязательного проведения микробиологических анализов.
Поликомпонентный состав в основном имеют БАДы-парафармацевтики, обладающие выраженным клинико-микробиологическим ассоциированным эффектом при разных заболеваниях у детей. Полипробиотики применяются с целью коррекции дисбактериоза кишечника I и II степени курсом 7–14 дней. Бациллярные пробиотики относятся к группе самоэлиминирующихся антагонистов. В состав препаратов входят транзиторные бациллы – В. subtilis (споробактерин, биоспорин, бактиспорин), В. cereus.
В настоящее время полагают, что оральный прием живых бактерий теоретически может быть ответственен за четыре типа побочных эффектов:
- развитие инфекционных процессов, обусловленных штаммами, входящими в состав пробиотиков;
- развитие метаболических расстройств;
- чрезмерную иммуностимуляцию лимфатического аппарата кишечника;
- формирование новых клонов бактериальных штаммов за счет передачи генов, ответственных за экспрессию факторов патогенности [41].
Справедливости ради надо отметить, что пробиотические штаммы бактерий, отобранные из числа представителей индигенной микрофлоры, чрезвычайно редко могут вызвать побочные эффекты.
Пробиотические штаммы наиболее эффективно проявляют себя в составе синбиотиков, когда в составе лекарственного средства или БАД содержится комбинация из пробиотиков и пребиотиков одновременно. Т.е. синбиотики являются комплексными препаратами, которые объединяют в одной рецептуре и пробиотики, и пребиотики. Кроме того, существуют синбиотические комплексы, которые содержат в себе не только комплекс пробиотики+пребитики, но и другие компоненты: сорбенты, витамины, минералы, аминокислоты и другие вещества, полезные для работы кишечника.
К одному из таких современных комбинированных синбиотиков относятся продукты из серии БАД Бифистим®: БАД Бифистим® и БАД Бифистим® Форте. Состав БАД Бифистим® представлен пробиотическими культурами: Lactobacillus plantarum, Bifidobacterium bifidum, Bifidobacterium longum, а также витаминным премиксом (витамины А, В1, В2, B12, Д3, С, Е, биотин, ниацин, пантотеновая кислота, фолиевая кислота) и пребиотическим комплексом из инулина, олигофруктозы и яблочного пектина. Пробиотические культуры, помимо своего положительного воздействия на микрофлору, способствуют оптимальному всасыванию витаминов, минералов и аминокислот человеческим организмом. Действие самих пробиотиков усиливают пребиотики – неперевариваемые пищевые вещества, стимулирующие рост и активность полезных бактерий. Состав БАД Бифистим® продуман таким образом, чтобы каждый компонент обладал синергическим действием по отношению к остальным. Благодаря качественному симбиозу пребиотики и витамины создают питательную среду для бифидо- и лактобактерий, что обеспечивает их рост и развитие. Состав БАД Бифистим® Форте не содержит витаминов и состоит из пробиотических лиофилизированных культур – Lactobacillus plantarum, Lactobacillus acidophilus, Lactobacillus casei, Bifidobacterium bifidum, Bifidobacterium longum – в сочетании с пребиотическим комплексом из олигофруктозы и инулина. Данная рецептура может быть использована, когда дополнительный прием витаминов нежелателен или витамины принимаются отдельно.
Рекомендации по применению синбиотиков серии БАД Бифистим®
БАД Бифистим® (таблетки жевательные массой 2,0 г; порошок в саше-пакетах массой 2,0 г) принимать взрослым по 1 жевательной таблетке или 1 порошку в пакетике (саше) 1 раз в день во время еды. Порошок можно предварительно развести в небольшом количестве жидкости, йогурте, кефире или запить питьевой водой комнатной температуры. Продолжительность приема 20–30 дней. Противопоказания: индивидуальная непереносимость компонентов. БАД Бифистим® Форте (капсулы массой 0,4 г) рекомендована к применению детям старше 14 лет и взрослым по 1 капсуле в день во время еды. Продолжительность приема также 20–30 дней. Противопоказания: индивидуальная непереносимость компонентов.
Пробиотические бактерии в обоих комплексах линии БАД Бифистим® содержатся в высокой концентрации – не менее 5×109 КОЕ в одной дозе (капсула, порошок, жевательная таблетка).
Современные пробиотики должны обладать еще одним очень важным качеством для их успешной доставки в кишечник – быть устойчивыми к действию кислой среды ЖКТ. Сохранить жизнеспособность бактерий помогают специальные современные технологические приемы. Пробиотические бактерии в составе синбиотиков серии БАД Бифистим® имеют двойное защитное покрытие Lab2ProТМ. Эта уникальная запатентованная технология (Европейский патент № ЕР 1514553) гарантирует, что пробиотические бактерии успешно преодолеют кислую среду желудка и тонкого кишечника и начнут активную деятельность в пределах толстого кишечника без потерь.
Применение синбиотиков серии БАД Бифистим® может быть рассмотрено в качестве помощи при нормализации микробиоценоза кишечника, повышения неспецифической резистентности организма, устранения функциональных нарушений ЖКТ. Сочетание бифидо- и лактобактерий предупреждает дисбиотические расстройства за счет эффективной поддержки микрофлоры кишечника, способствует усвоению витаминов, микроэлементов, биологически активных веществ, а также продуцирует вещества, необходимые для укрепления иммунной системы. Антагонистическая активность пробиотических культур защищает кишечник от патогенных микроорганизмов. Пребиотическая основа (олигоруктоза, инулин, яблочный пектин) является питательным субстратом для эндогенной микрофлоры, обеспечивающей оптимизацию обмена веществ, стимулирует моторику кишечника, способствует детоксикации организма. Отсутствие лактозы позволяет использовать серию БАД Бифистим® при лактазной недостаточности; она не содержит глюкозу и может использоваться больными СД.
В настоящее время активно обсуждаются вопросы профилактического использования пробиотиков, особенно для борьбы с последствиями антибактериальной терапии. Возросшая во всем мире угроза устойчивости к антибиотикам, вызванная чрезмерно широким их применением, сопровождающаяся увеличением длительности проводимой терапии и дозы антимикробных препаратов, должна быть дополнена эффективными методами восстановления микрофлоры кишечника. К счастью, последние достижения в создании новых пробиотиков вселяют надежду на уменьшение степени повреждения микробиоты кишечника [45]. Заглядывая вперед, мы ожидаем, что индивидуальные экологические и метаболические модели микрофлоры могут играть важную роль в выборе вариантов лечения нарушенной микрофлоры кишечника и в преодолении развития лекарственной устойчивости к антибиотикам.
Таким образом, в связи с широким спектром фармакотерапевтических эффектов, пробиотики могут применяться при нарушениях микрофлоры кишечника, связанных с дефицитом индигенной и ростом условно-патогенной флоры, обусловленных различными инфекционными и неинфекционными заболеваниями.
Подводя итог, необходимо подчеркнуть, что дисбиоз следует рассматривать в первую очередь не как отдельное заболевание, а как результат нарушения качественного и количественного состава микрофлоры. В связи с этим применение пробиотиков патогенетически обосновано для широкого круга пациентов, как имеющих какую-либо патологию, так и считающихся условно здоровыми. К ним относятся, в первую очередь, больные, принимающие антибактериальную терапию, а также некоторые другие препараты (обволакивающие, адсорбирующие, слабительные, отхаркивающие, желчегонные, противогрибковые). Поскольку дисбиотические состояния кишечника нередко сопровождают заболевания ЖКТ, кожные болезни (псориаз, экзему, нейродермит), аллергические проявления (бронхиальная астма, атопический дерматит), таким пациентам пробиотики должны назначаться в составе комплексной терапии.
Вторая большая группа пациентов – это больные с хроническими заболеваниями печени, у которых нарушения состава нормальной микрофлоры выявляются в более чем в 90% случаев. Нарушения биоценоза кишечника характерно для пациентов с ожирением, что определяет третью группу пациентов, которым необходима регулярная коррекция индигенной флоры.
Необходимо помнить, что кишечная микрофлора вовлекается в патофизиологические реакции при развитии большинства заболеваний. При этом стоит отметить, что в современных условиях дисбаланс микрофлоры характерен не только в качестве фактора, сопровождающего различную патологию, но и для людей, остающихся условно здоровыми и ведущими активный образ жизни. Именно у этой категории населения благодаря высокому рабочему ритму наиболее часто встречаются нарушения пищевого и водного режима, состояния дезадаптации (в результате выраженных физических и эмоциональных нагрузок, смены климата во время командировок и путешествий – «диарея путешественников»). В отличие от пациентов с различными заболеваниями, зачастую вынужденных соблюдать те или иные ограничения и придерживаться диеты, условно здоровые социально активные люди сталкиваются с нарушениями микрофлоры кишечника ничуть не реже, благодаря стрессовому фактору, гиповитаминозам, резкому изменению окружающего климата, употреблению алкоголя и курению. Перечисленное определяет необходимость как патогенетического, так и профилактического назначения пробиотиков в качестве средств, имеющих тесную многоуровневую связь между структурными изменениями микрофлоры кишечника и целым перечнем разнообразных заболеваний.



