В настоящее время сахарный диабет (СД) 2 типа отнесен Всемирной организацией здравоохранения к неинфекционной эпидемии вследствие чрезвычайно высокой распространенности среди всех народов, населяющих земной шар [1, 2]. Ситуацию ухудшает неблагоприятная тенденция: неуклонный рост количества человек, страдающих ожирением, предиабетическими стадиями заболевания и ведущих малоподвижный образ жизни. Недостаточная диагностика СД и его стертое начало маскируют реальные цифры, характеризующие эпидемиологическую ситуацию, как в нашей стране, так и во всем мире. Внедрение диспансеризации населения и активных методов скрининга, направленных на выявление этого заболевания, позволяют диагностировать СД 2 типа и своевременно назначать адекватную сахароснижающую терапию, что будет способствовать профилактике развития отдаленных осложнений. Однако следует заметить, что подобные программы увеличат нагрузку на медицинский персонал (медсестер и врачей-эндокринологов), что в свою очередь потребует привлечения других специалистов к решению этой сложной медицинской проблемы [3]. В первую очередь необходимо будет активное вовлечение в диагностический и лечебный процесс врачей общей практики и терапевтов, на плечи которых ложится вопрос ранней диагностики СД и выбор стартовой терапии.
Колоссальные достижения фармакологии последних лет дали в руки врачей целую линейку новых высокоэффективных и безопасных пероральных сахароснижающих препаратов (ПСП), которые идеально подходят для старта и интенсификации противодиабетической терапии в рамках общетерапевтической практики. Ситуацию во многом облегчает наличие разработанных российских алгоритмов лечения СД. В них четко регламентированы этапы назначения монотерапии, комбинации ПСП, начало инсулинотерапии, указаны приоритетные ПСП и их рациональные сочетания, основанные на принципах доказательной медицины. Широкое внедрение стандартов медицинской помощи больным СД 2 типа, доступность современных противодиабетических лекарственных препаратов и средств самоконтроля в сочетании с обучением больных в рамках «школ диабета» во многом изменили качество жизни пациентов с СД, минимизировали риски инвалидизации, а главное, увеличили продолжительность жизни пациентов.
ПАТОГЕНЕТИЧЕСКОЕ ОБОСНОВАНИЕ ИСПОЛЬЗОВАНИЯ РАЗЛИЧНЫХ КЛАССОВ ПЕРОРАЛЬНЫХ САХАРОСНИЖАЮЩИХ ПРЕПАРАТОВ
Прежде чем обсуждать вопросы, связанные с различными подходами к управлению СД, необходимо напомнить о том, что СД 2 типа представляет собой группу гетерогенных нарушений углеводного обмена, перманентно прогрессирующих и характеризующихся едиными метаболическими проявлениями: гипергликемией и глюкозурией [1, 2]. В качестве этиологических факторов гипергликемии рассматривается множество различных дефектов, таких как инсулинорезистентность периферических тканей, относительный дефицит инсулина вследствие дисфункции β-клеток поджелудочной железы, нарушение инкретинового ответа, неалкогольная жировая инфильтрация печени и повышение печеночного глюконеогенеза, повышенная реабсорбция глюкозы в почках и др. На ранних этапах заболевания могут доминировать одновременно несколько из выше представленных патогенетических процессов, которые со временем прогрессируют и дополняются новыми факторами, требующими дополнительной коррекции. Так, например, еще Клод Бернар отмечал, что у большинства пациентов СД 2 типа начинается с неалкогольной жировой болезни печени и стеатогепатита, что сопровождается гиперпродукцией глюкозы в ночные и утренние часы вследствие активизации глюконеогенеза. В то же время повышение гипергликемии натощак может быть следствием выраженной инсулинорезистентности и ожирения, а также нарушения инкретинового ответа. Таким образом, следует подчеркнуть, что в дебюте СД 2 типа чаще всего наблюдается повышение уровня гликемии в утренние часы, в состоянии натощак, поэтому коррекция тощаковой гипергликемии рассматривается как первоочередная мишень терапии, а препараты, снижающие гипергликемию натощак, называют «базальными регуляторами».
МЕХАНИЗМ ДЕЙСТВИЯ И САХАРОСНИЖАЮЩИЕ СВОЙСТВА МЕТФОРМИНА
В настоящее время все международные диабетические ассоциации на протяжении 10 лет признают в качестве первой линии терапии СД 2 типа гепатотропный препарат метформин, предлагая его для монотерапии в дебюте заболевания [1, 2]. На сегодняшний день метформин рекомендован в качестве первой линии терапии СД 2 типа вне зависимости от возраста, пола, массы тела и длительности СД. Его максимально долго сохраняют в схемах терапии болезни, в том числе при имеющихся у пациентов умеренных нарушениях функции печени и почек, а также сердечно-сосудистой патологии. Назначение метформина в дозе 2 г/сут, в соответствии с инструкцией по медицинскому применению, обеспечивает выраженный сахароснижающий эффект (снижение гликированного гемоглобина на 1–2%) без дополнительных рисков гипогликемических реакций, стабилизацию или снижение массы тела, улучшение липидных показателей, уменьшение инсулинорезистентности, а значит, и нагрузки на β-клетки. Основной эффект метформина направлен на преодоление резистентности периферических тканей к инсулину, в особенности это относится к печеночной и мышечной тканям [1]. Важной мишенью для действия метформина является АМФ-активируемая протеинкиназа (АМПК) – клеточный энергетический сенсор, активирующийся при метаболическом стрессе. Активация АМПК блокирует продукцию глюкозы в печени, повышает чувствительность к инсулину и поглощение глюкозы мышцами, а также вызывает окисление жирных кислот. АМПК может быть активирована физическими нагрузками, гормонами, цитокинами и лекарственными препаратами. Однако метформин активирует АМПК времязависимым и дозозависимым образом, что приводит к торможению продукции глюкозы в печени, увеличению поглощения ее мышцами, ингибированию ацетил-КоА-карбоксилазы, снижению синтеза жирных кислот в гепатоцитах и, возможно, увеличению утилизации глюкозы в печени через независимые от инсулина пути. К недостаткам терапии метформином следует отнести частые побочные эффекты со стороны желудочно-кишечного тракта: метеоризм, нарушение стула и т.д., к достоинствам – огромный опыт применения препарата, его всестороннюю изученность, кардиобезопасность и кардиопротективные свойства, доказанные в исследовании UKPDS. В последнее время появились сообщения о снижении риска гепатоцеллюлярной карциномы, рака молочной железы и рака эндометрия у пациентов, получающих метформин. Однако особо стоит отметить уникальность данного препарата как ингибитора глюконеогенеза. В настоящее время нет другого ПСП, обладающего схожими свойствами. Этот факт послужил основой для создания комбинированных препаратов, использующихся в качестве терапии СД второй линии. Можно выделить несколько таких ключевых направлений: метформин в комбинации с препаратами сульфонилмочевины (СМ), метформин в сочетании с ингибиторами дипептидилпептидазы 4 типа (иДПП-4) и метформин плюс ингибиторы натрий-глюкозного котранспортера 2 типа. Суммируя вышесказанное, можно сделать вывод, что метформин в данной схеме наиболее эффективен в контроле гликемии натощак, а препарат СМ или иДПП-4 – в контроле глюкозы крови после еды, т.е. как прандиальные регуляторы. Это необходимо учитывать в подборе дозировок комбинированного препарата. Так, при использовании фиксированной комбинации метформина и СМ мы ориентируемся не только на уровни гликированного гемоглобина (HbA1c) и глюкозы крови натощак, но и на показатели сахара крови после каждого приема пищи.
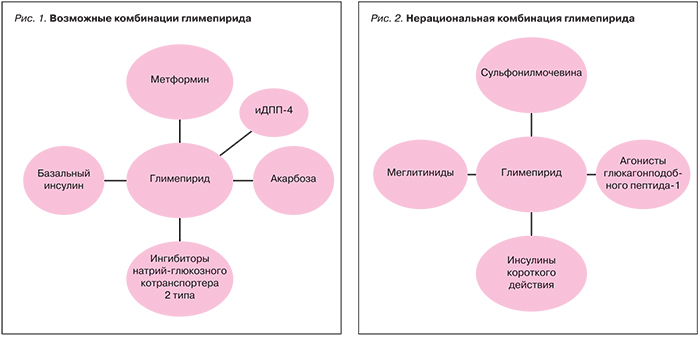
К сожалению, не все ситуации, с которыми сталкивается врач-терапевт, укладываются в выше представленный алгоритм, и приходится делать выбор между различными фиксированными комбинациями (рис. 1, 2). При плохой переносимости метформина или наличии противопоказаний к применению (сердечная недостаточность, снижение функции печени или почек) возникает необходимость в поиске альтернативных вариантов терапии. В этом случае следует вновь обратить внимание на СМ и иДПП-4, только уже в виде монотерапии [1, 2].
МЕХАНИЗМ ДЕЙСТВИЯ И САХАРОСНИЖАЮЩИЕ СВОЙСТВА СУЛЬФОНИЛМОЧЕВИНЫ
СМ как группа противодиабетических препаратов в настоящее время относится к прандиальным регуляторам, т.е. их основной точкой приложения является контроль уровня глюкозы крови после еды. Однако следует обратить внимание на тот факт, что глимепирид как представитель последней генерации класса СМ обладает уникальными свойствами: помимо стимуляции выработки инсулина (отсюда и принадлежность к группе секретагогов и прандиальных регуляторов), у него присутствует и сенситайзерный эффект – усиление чувствительности периферических тканей (гепатоцитов, адипоцитов) к инсулину. Первый эффект, свойственный всем препаратам группы СМ, реализуется через блокирование К+-каналов β-клеток островков Лангерганса, второй – через активацию субстанции IRS системы рецептора инсулина, которая, в свою очередь, запускает переносчик глюкозы GLUT 4 и улучшает поступление глюкозы в клетку [4]. Такие научные открытия позволили внести существенную лепту в понимание целевой группы пациентов при выборе данного класса ПСП. К ней относятся пациенты с выраженной гипергликемией на фоне инсулинорезистентности и ожирения. Это принципиальное изменение в понимании применения группы СМ в целом и глимепирида в частности. Ранее использование СМ рассматривалось как целесообразное преимущественно для пациентов с СД 2 типа без ожирения. Данный аспект применения препаратов СМ очень важен для дальнейшей интенсификации терапии СД, даже тогда, когда выполняется инициация инсулинотерапии. Сочетанное применение глимепирида и базального инсулина позволяет добиться компенсации диабета на фоне меньших доз инсулина, без клинически значимого повышения риска гипогликемий и набора веса, а также является реальной альтернативой интенсифицированной, базис-болюсной схеме инсулинотерапии или назначению смешанных форм инсулинов.
Подбор дозы препаратов СМ достаточно простой. Стартовая дозировка глимепирида составляет 1 мг, даже если больной до этого получал другие сахароснижающие средства. Дальнейшее увеличение дозы происходит на 1 мг/нед с учетом уровня глюкозы крови натощак и после еды (рис. 3). В случае развития у пациента гипогликемии (явление относительно редкое для последней генерации СМ) дозировку глимепирида следует снизить в 2 раза и провести тщательный анализ потенциальных причин, вызвавших снижение уровня глюкозы в крови, и только после этого проводить коррекцию терапии. Согласно инструкции по медицинскому применению, глимепирид принимается однократно утром, за 15 мин до завтрака, но возможно и дополнительное назначение перед ужином. Такая схема применения препарата не оказывает влияние ни на его фармакокинетический, ни на фармакодинамический профиль и не ухудшает безопасность терапии. Максимальная суточная доза глимепирида – 8 мг в 1 или 2 приема. Следует помнить, что применение препаратов СМ требует от пациента тщательного выполнения рекомендаций по дробному питанию, контролю количества потребляемых углеводов, выполнения самоконтроля гликемии и учета регулярной и дополнительной физической активности.
Описывая сахароснижающую эффективность глимепирида, следует обратить внимание на ряд принципиальных научных разработок. Так, в исследовании D. Schade и соавт., которое продолжалось 22 нед и включало 247 пациентов, из которых 80 человек с исходным средним уровнем HbA1c 9,1% получали глимепирид, была показана более высокая эффективность глимепирида по сравнению с плацебо: снижение уровня HbA1c составило 1,4% (p<0,001). За весь период исследования эпизодов гипогликемии не зафиксировано [5].
X.-H. Guo и соавт. оценивали эффективность глимепирида в качестве стартовой сахароснижающей терапии у пациентов с СД 2 типа. Через 16 нед снижение уровня HbA1c составило 1,7% (8,6% в начале исследования и 6,9% в конце; p<0,001). Частота эпизодов гипогликемии в группе пациентов, получавших глимепирид, была минимальной и составила 3,1%. Корреляция между частотой возникновения гипогликемии и дозой препарата отсутствовала: у пациентов, принимавших глимепирид в дозе 1,2 и 4 мг, частота гипогликемии составила 8,1 и 2,5% соответственно [6].
В 20-недельном исследовании G. Charpentier и соавт. оценивали эффективность применения глимепирида у пациентов, не достигших полной компенсации СД 2 типа на фоне лечения метформином. Итоговое снижение уровня HbA1c в группе сочетанной терапии составило 0,7% (p<0,001), что свидетельствовало о высокой эффективности данной комбинации, в то время как в группах монотерапии метформином и глимепиридом было отмечено повышение уровня HbA1c на 0,1% (p<0,001) и 0,3% (p<0,001) соответственно. Было выявлено значительное снижение уровня гликемии натощак и постпрандиальной гликемии – на 1,8 и 2,6 ммоль/л соответственно (p<0,001) [7].
Таким образом, необходимо четко понимать, что назначение и сохранение глимепирида в схемах управления СД 2 типа клинически оправдано, имеет чрезвычайно высокую эффективность в отношении контроля гликемических параметров и достижения целевой компенсации у подавляющей части пациентов на различных этапах заболевания.
СЕРДЕЧНО-СОСУДИСТАЯ БЕЗОПАСНОСТЬ ПЕРОРАЛЬНЫХ САХАРОСНИЖАЮЩИХ ПРЕПАРАТОВ
Обсуждая препараты второй линии терапии СД, необходимо провести сравнение препаратов как внутри самой группы СМ, так и с представителями иДПП-4. В настоящее время в России наиболее активно используется 3 препарата СМ: глибенкламид (1 поколение), гликлазид (2 поколение) и глимепирид (3 поколение). Создание 3-х генераций препаратов сопровождалось увеличением их безопасности: снижением риска гипогликемий при их применении, уменьшением кратности приема, повышением кардиопротективных свойств. Так, в частности, глимепирид показал себя как препарат с кардиопротективными свойствами. Проведенные когортные фармакоэпидемиологические исследования сердечно-сосудистой безопасности выявили схожий профиль у метформина и глимепирида: выживаемость пациентов с ишемической болезнью сердца (ИБС), частота развития острого инфаркта миокарда и острого нарушения мозгового кровообращения не отличались в сравниваемых группах [8, 9]. Это обусловлено рядом благоприятных плейотропных свойств, выявленных у глимепирида. Так, были хорошо изучены уникальные противоатеросклеротические свойства препарата: снижение уровня С-реактивного протеина в крови, факторов адгезии макрофагов и уменьшение размеров атеросклеротической бляшки. Также глимепирид (в отличие от глибенкламида) не блокирует эндогенные протективные свойства миокарда – ишемическое прекондиционирование [10]. В настоящее время обнаружены и иные благоприятные эффекты глимепирида на функцию сердца: потенцирование ишемического посткондиционирования миокарда [4]. В эксперименте эпизод ишемии-реперфузии миокарда сопровождался усилением кровотока в коронарных артериях – коллатералях, увеличением фракции выброса левого желудочка и уменьшением зоны инфаркта у животных, получавших глимепирид. Такие уникальные свойства обусловлены способностью препарата стимулировать высвобождение монооксида азота, обладающего вазодилятирующими свойствами [11, 12].
Таким образом, с точки зрения кардиобезопасности глимепирид является препаратом выбора из класса СМ у пациентов с СД 2 типа и ИБС.
Обсуждая лечение пациентов с кардиоваскулярной патологией, следует обратить внимание на тот факт, что, в отличие от метформина, применение глимепирида возможно при сердечной недостаточности. Перспективной является комбинация глимепирида и препаратов новой группы – ингибиторов натрий-глюкозного котранспортера 2 типа, показавших снижение риска развития сердечной недостаточности и смертности у пациентов с СД 2 типа по данным исследования EMPA-REG [13].
Оценивая различные поколения СМ, необходимо отметить, что исследование ADVANCE, в котором сравнивался гликлазид с иными препаратами СМ, не показало преимуществ. Так, несмотря на лучшую компенсацию СД у больных, получавших исследуемый препарат, не было обнаружено каких-либо дополнительных положительных кардиопротективных эффектов и снижения частоты сердечно-сосудистых событий и смертности по сравнению с контрольной группой [14].
Для сравнения групп СМ и иДПП-4 можно кратко обсудить результаты фармакоэпидемиологических исследований кардиобезопасности 3-х представителей иДПП-4: саксаглиптин, ситаглиптин, алоглиптин. В ходе исследований SAVOR, TECOS, EXAMIN не было получено данных о наличии дополнительных положительных свойств у всех 3-х изучаемых препаратов по сравнению с традиционной сахароснижающей терапией препаратами СМ и метформина [15]. Таким образом, иДПП-4 не имеют преимуществ по сравнению с СМ с позиции кардиоэффективности.
ВЫВОДЫ
Несмотря на появление новых групп сахароснижающих препаратов, применение препаратов СМ последнего поколения остается актуальным. Приоритетным является индивидуальный подход к выбору сахароснижающей терапии для оптимального гликемического контроля. Можно выделить две группы пациентов, у которых применение глимепирида является целесообразным и обоснованным: первая группа – это больные СД 2 типа, ожирением и выраженной инсулинорезистентностью, вторая – пациенты с СД 2 типа и ИБС.



