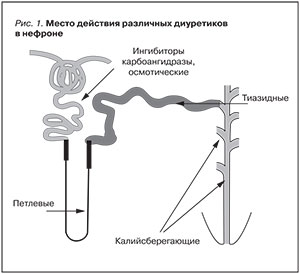
Диуретики широко применяются в клинической практике терапевта, кардиолога, нефролога. Препараты из этой группы используются для лечения артериальной гипертензии (АГ) как в монотерапии, так и в комбинации с различными антигипертензивными средствами, усиливая их эффективность. Они незаменимы в коррекции отечного синдрома у больных с острой и хронической сердечной недостаточностью (ХСН), хронической болезнью почек (ХБП), портальной гипертензией. Диуретики различаются по химической структуре и обладают особыми фармакологическими и фармакодинамическими свойствами в зависимости от точки воздействия в нефроне (рис. 1, табл. 1) [1, 2].
 Применение диуретиков началось во второй половине 1950-х гг., с момента создания хлоротиазида. В 1963 г. был синтезирован фуросемид, который многие годы занимал лидирующие позиции в лечении отечного синдрома. В конце 1980-х гг. разработан, а в 1990- е гг. внедрен в медицинскую практику торасемид – первый петлевой диуретик, положительно влияющий на прогрессирование сердечной недостаточности и процессы ремоделирования миокарда.
Применение диуретиков началось во второй половине 1950-х гг., с момента создания хлоротиазида. В 1963 г. был синтезирован фуросемид, который многие годы занимал лидирующие позиции в лечении отечного синдрома. В конце 1980-х гг. разработан, а в 1990- е гг. внедрен в медицинскую практику торасемид – первый петлевой диуретик, положительно влияющий на прогрессирование сердечной недостаточности и процессы ремоделирования миокарда.
ФАРМАКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ТОРАСЕМИДА
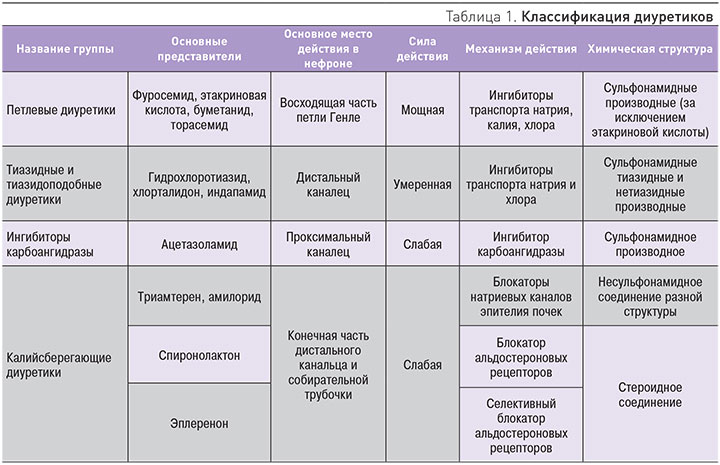
Торасемид является петлевым диуретиком. Препарат обратимо связывается с котранспортером натрия/хлора/калия, расположенным в апикальной мембране толстого сегмента восходящей петли Генле, ингибируя реабсорбцию ионов натрия и уменьшая осмотическое давление внутриклеточной жидкости и реабсорбцию воды. В отличие от других петлевых диуретиков, торасемид обладает антиальдостероновым эффектом. Препарат в меньшей степени экскретирует калий и кальций [3]. Применение торасемида в дозе 2,5–10 мг увеличивает объем выделенной жидкости, экскрецию ионов натрия и хлора линейно в зависимости от дозы, не влияя значимо на выведение калия (рис. 2) [4].
Диуретический эффект наступает примерно через час после приема препарата внутрь, достигая максимума через 2–3 ч, и сохраняется до 18 ч. Этот факт объясняет отсутствие частого мочеиспускания в первые часы после приема препарата, что улучшает переносимость терапии и не ограничивает активность пациентов [5, 6]. При длительном применении торасемид не оказывает клинически значимого негативного влияния на метаболизм глюкозы и липидов (холестерина, триглицеридов). Достоинство и отличие торасемида от других петлевых диуретиков – его способность уменьшать активность ренин-ангиотензин-альдостероновой системы (РААС). Доказана способность торасемида снижать чувствительность рецепторов ангиотензина II 1-го типа, приводя к блокаде индуцированного им вазоспазма [7]. Под влиянием торасемида снижается восприимчивость гладкомышечных клеток сосудистой стенки к эндогенным вазоконстрикторным факторам (в том числе и к норадреналину) за счет активации натрий-кальциевого насоса, обеспечивающего выведение ионов кальция из клетки в обмен на вход ионов натрия, а также подавления входа ионов кальция в клетку [8, 9].
У пациентов с умеренно выраженной ХСН препарат не только уменьшает симпатическую активность в виде снижения уровня адреналина, но также увеличивает синтез простациклина и уменьшает образование тромбоксана. Торасемид обладает антиальдостероновыми свойствами: препарат влияет на альдостероновые рецепторы не только в почечных канальцах, но и миокарде. На фоне приема торасемида уменьшается объемная фракция коллагена и выраженность фиброза. Это связано с подавлением активности карбокситерминальной протеиназы проколлагена I типа – фермента, который катализирует альдостеронзависимую трансформацию проколлагена I типа в коллаген [10–13]. Антифибротического эффекта у фуросемида и пролонгированной формы торасемида выявлено не было [14].
ФАРМАКОКИНЕТИКА ТОРАСЕМИДА
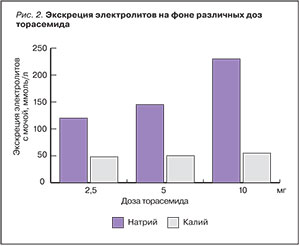
Фармакокинетические особенности торасемида обусловлены высокой липофильностью препарата. Прием пищи не оказывает значимого влияния на абсорбцию препарата (рис. 3) [15].
 Биодоступность торасемида стабильная и в среднем составляет 80–90%, в то время как у фуросемида она составляет 60–70%. Максимальная концентрация в плазме крови достигается через 1–2 ч. Торасемид имеет продолжительный период полувыведения – 4 ч, что обеспечивает большую длительность диуретического эффекта в сравнении с другими петлевыми диуретиками. Постепенное накопление активного вещества уменьшает риск развития толерантности [16]. Связь с белками плазмы крови 99%. Торасемид до 80% метаболизируется в печени с помощью изоферментов системы цитохрома Р450 с образованием трех метаболитов (М1, М3 и М5) [17]. Большинство петлевых диуретиков выводятся преимущественно почками. В случае торасемида только 24–25% препарата выводится почками в неизмененном виде, поэтому нарушение функции почек не оказывает существенного влияния на его фармакокинетические свойства. При умеренной и тяжелой ХБП период полувыведения и общий клиренс торасемида не изменяются в отличие от фуросемида [18, 19]. У пациентов с нарушениями функции печени увеличивается биодоступность торасемида, период его полувыведения. Кумуляция препарата маловероятна из-за компенсаторного роста почечного клиренса [20]. Это приводит к увеличению экскреции торасемида с мочой, однако усиления натрийуреза не возникает. У пожилых пациентов общий клиренс и период полувыведения препарата не меняются. По мнению большинства авторов, эквивалентное соотношение доз фуросемида и торасемида составляет 4–8:1 для здоровых лиц, 4:1 – для пациентов с сердечной недостаточностью и 2:1 – при хронической почечной недостаточности [21–23].
Биодоступность торасемида стабильная и в среднем составляет 80–90%, в то время как у фуросемида она составляет 60–70%. Максимальная концентрация в плазме крови достигается через 1–2 ч. Торасемид имеет продолжительный период полувыведения – 4 ч, что обеспечивает большую длительность диуретического эффекта в сравнении с другими петлевыми диуретиками. Постепенное накопление активного вещества уменьшает риск развития толерантности [16]. Связь с белками плазмы крови 99%. Торасемид до 80% метаболизируется в печени с помощью изоферментов системы цитохрома Р450 с образованием трех метаболитов (М1, М3 и М5) [17]. Большинство петлевых диуретиков выводятся преимущественно почками. В случае торасемида только 24–25% препарата выводится почками в неизмененном виде, поэтому нарушение функции почек не оказывает существенного влияния на его фармакокинетические свойства. При умеренной и тяжелой ХБП период полувыведения и общий клиренс торасемида не изменяются в отличие от фуросемида [18, 19]. У пациентов с нарушениями функции печени увеличивается биодоступность торасемида, период его полувыведения. Кумуляция препарата маловероятна из-за компенсаторного роста почечного клиренса [20]. Это приводит к увеличению экскреции торасемида с мочой, однако усиления натрийуреза не возникает. У пожилых пациентов общий клиренс и период полувыведения препарата не меняются. По мнению большинства авторов, эквивалентное соотношение доз фуросемида и торасемида составляет 4–8:1 для здоровых лиц, 4:1 – для пациентов с сердечной недостаточностью и 2:1 – при хронической почечной недостаточности [21–23].
ЭФФЕКТИВНОСТЬ ТОРАСЕМИДА ПРИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
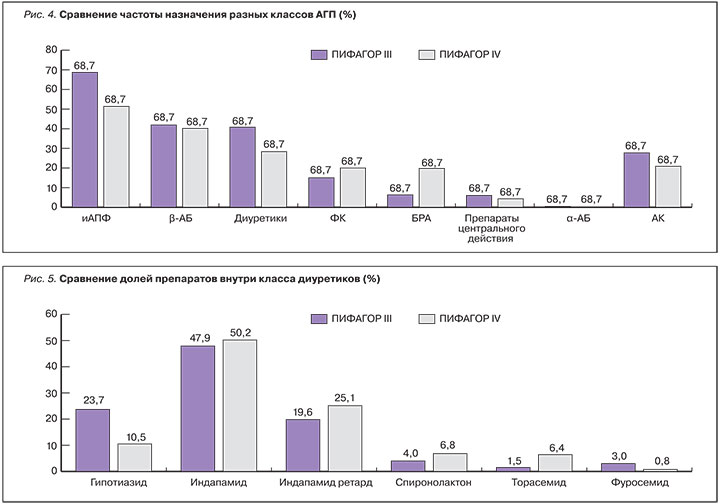
Применение диуретиков при АГ является патогенетически обоснованным, поскольку препараты воздействуют на основные механизмы повышения АД – задержку натрия и жидкости. Антигипертензивная эффективность и положительное влияние на прогноз представителей данной группы препаратов подтверждены данными рандомизированных исследований. Согласно результатам проведенного Кохрановского мета-анализа от 2015 г., диуретики в качестве стартовой терапии АГ оказались более эффективны в снижении риска развития ХСН и инсульта в сравнении с блокаторами РААС [24]. В анализируемых исследованиях участвовали тиазидные диуретики (ТД). Однако в современных международных и отечественных рекомендациях к классу диуретиков, которые рекомендованы для лечения пациентов с АГ в сочетании с ХСН, ХБП, отнесены также петлевые и калийсберегающие диуретики [25, 26]. Популяционное фармакоэпидемиологическое исследование в США за период 2006–2010 гг. показало, что диуретики по частоте назначения занимают до 1/3 всех антигипертензивных препаратов, причем доля петлевых диуретиков стабильно удерживается на уровне 12,5% [27]. В нашей стране по результатам исследования ПИФАГОР IV диуретики назначают в 28,3% случаев. Частота использования диуретиков в 2013 г. по сравнению с 2008 г. имеет тенденцию к уменьшению (рис. 4). Однако при анализе применения различных представителей диуретиков отмечен рост назначения торасемида до 6,4% по сравнению с 2008 г. (1,5%; рис. 5) [28].
Наиболее часто при АГ назначаются тиазидные препараты (гидрохлоротиазид – ГХТ и хлорталидон) и тиазидоподобный препарат индапамид. ТД являются препаратами выбора у пожилых больных с изолированной систолической АГ. Однако у пациентов с метаболическими нарушениями использование ТД в режиме монотерапии считается нецелесообразным из-за возможного развития побочных эффектов: гипокалиемии, гипергликемии. При длительном применении в больших дозах ТД повышают риск развития сахарного диабета (СД), негативно влияют на липидный и пуриновый обмены. Абсолютным противопоказанием к назначению ТД является наличие у больного подагры, относительными – метаболический синдром, нарушение толерантности к глюкозе, беременность, гиперкальциемия, гипокалиемия [26]. При лечении АГ не рекомендуется превышать дозу ГХТ 12,5–25 мг, хлорталидона – 12,5–25 мг, индапамида – 1,25–2,5 мг. При увеличении дозы выше рекомендуемой возрастает частота побочных эффектов без усиления антигипертензивного действия. Высокие дозы ТД могут приводить к гипокалиемии с увеличением риска развития желудочковых нарушений ритма. Стандартные петлевые диуретики при АГ обычно используют только у больных, резистентных к традиционной терапии. Петлевые диуретики (фуросемид, этакриновая кислота и т.д.) также могут вызывать нарушение толерантности к глюкозе, глюкозурию и развитие некетонемической комы. Поэтому при их назначении обязателен контроль уровня электролитов, глюкозы, липидов, мочевой кислоты. Однако фуросемид в стандартных дозах реже, чем ТД, вызывает у больных АГ гипокалиемию и метаболические нарушения [29].
На сегодняшний день альтернативой ТД для лечения АГ, особенно в сочетании с ХСН и ХБП является торасемид [30]. Препарат вызывает менее выраженный пиковый эффект, обладает большей, чем у фуросемида, продолжительностью действия. Антигипертензивный эффект торасемида был подтвержден результатами плацебо-контролируемых исследований, согласно которым препарат оказывает сопоставимое с другими представителями этой групп лекарственных средств действие [31, 32]. Препарат, в отличие от других диуретиков и антигипертензивных препаратов, реже вызывает развитие эпизодов гипотензии. Антигипертензивный эффект торасемида характеризуется плавным снижением АД, что имеет большое значение для коррекции АГ у пожилых пациентов с сопутствующими цереброваскулярными заболеваниями [33]. В одном из исследований [32] с участием пациентов с АГ антигипертензивная эффективность торасемидав дозах 2,5 и 5 мг оказалась практически одинаковой. На основании полученных результатов был сделан вывод, что доза торасемида 2,5 мг/сут является оптимальной для лечения АГ.
Торасемид является метаболически нейтральным препаратом. Длительный прием торасемида в дозах 5–10 мг/сут у пациентов с АГ не приводил к изменению уровня глюкозы, мочевой кислоты, общего холестерина, холестерина ЛПНП, холестерина ЛПВП и калия [34]. Данное свойство препарата определяет возможность назначения у пациентов с АГ в сочетании с СД, гиперурикемией, дислипидемиями под контролем соответствующих показателей в плазме крови. Торасемид может применяться в качестве антигипертензивного средства, особенно у пациентов с сопутствующей ХСН, заболеваниями почек [35]. Рекомендованной дозой является 2,5–5 мг/сут. При лечении АГ торасемид можно комбинировать с представителями других классов антигипертензивных препаратов: ингибиторами ангиотензинпревращающего фермента (иАПФ), блокаторами ангиотензиновых рецепторов (БРА), антагонистами кальция (АК), β-адреноблокаторами (БАБ) [33]. При этом отмечается потенцирование антигипертензивного эффекта. Комбинация торасемида с эналаприлом по сравнению с комбинацией ГХТЗ с эналаприлом в большей степени улучшала диастолическую функцию левого желудочка (ЛЖ), что, возможно, связано с антиальдостероновым действием торасемида [3]. Благодаря наличию антиальдостеронового действия, отличающего его от других диуретиков, торасемид ингибирует синтез и стимулирует деградацию в миокарде коллагена 1-го типа, увеличивает образование оксида азота эндотелием сосудов [36]. Подобные изменения могут приводить к улучшению как диастолической функции ЛЖ, так и функции эндотелия сосудов [11].
ПРИМЕНЕНИЕ ТОРАСЕМИДА ПРИ ХБП
Эффективность ТД снижается при ХБП IV стадии, т.е. при снижении скорости клубочковой фильтрации (СКФ) <30 1="" 73="" 2="" iv="" v="">5 мл/ мин. Учитывая высокую распространенность ХБП в популяции, при выборе диуретического препарата необходимо обращать внимание на СКФ [37]. При назначении торасемида больным с нефротическим синдромом препарат не только эффективно воздействовал на отечный синдром, но и показал антипротеинурическое действие [38]. В одном из исследований с участием больных с ХБП стадий IV–V и АГ препарат при внутривенном введении значительно увеличивал диурез, уменьшая периферические отеки и снижая уровень АД [39].
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ТОРАСЕМИДА ПРИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
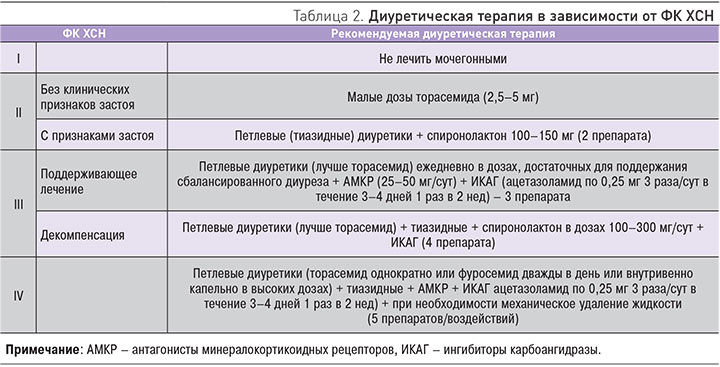
Согласно Национальным рекомендациям Общества специалистов по сердечной недостаточности, Российского кардиологического общества и Российского научного медицинского общества терапевтов (4-й пересмотр) от 2013 г., рекомендациям Европейского общества кардиологов от 2016 г., при ХСН со сниженной ФВ (ХСН-нФВ), диуретики назначаются вне зависимости от функционального классса (ФК) всем пациентам с отечным синдромом обязательно в сочетании с блокаторами РААС для улучшения симптомов, повышения толерантности к физической нагрузке и уменьшения риска госпитализации. Пациентам с сердечной недостаточностью с сохранной фракцией выброса (СН-сФВ) или сердечной недостаточностью с промежуточной фракцией выброса (СН-срФВ) и наличием застойных явлений для уменьшения симптомов рекомендуются применение диуретиков. Диуретическая терапия должна начинаться с минимальных доз с последующим титрованием дозы до эффективной с учетом клинического состояния, суточного диуреза, электролитного баланса [40, 41]. Особенности назначения мочегонных средств у больных с различным ФК ХСН представлены в табл. 2.
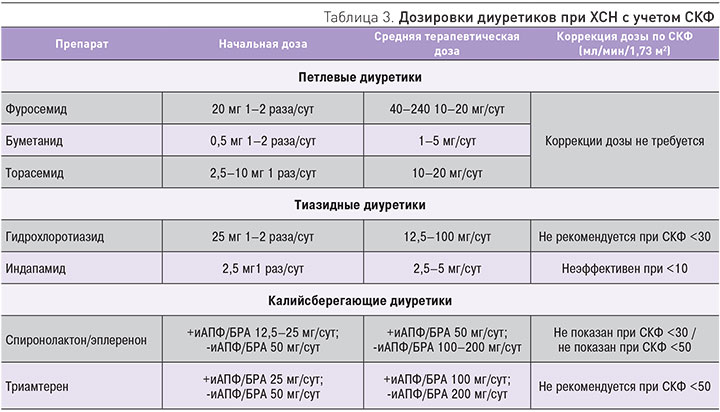
Петлевые диуретики остаются самыми эффективными мочегонными препаратами при лечении отечного синдрома при ХСН и применяются у 20–60% больных с ХСН и ХБП. Поэтому выбор препарата и коррекция дозы должны проводиться в зависимости от СКФ (табл. 3) [10]. При лечении острой сердечной недостаточности (ОСН) диуретики являются одной из основных групп препаратов. Рекомендации по назначению диуретической терапии при ОСН с указанием класса рекомендаций и уровня доказательности представлены в табл. 4 [41].
Эффективность торасемида при ХСН оценивалась во многих исследованиях, в которых препарат часто сравнивался с фуросемидом. В рандомизированном исследовании PEACH с участием больных с ХСН II–III ФК статистически значимых различий в клинической эффективности торасемида и фуросемида, а также их влиянии на смертность и частоту госпитализаций выявлено не было. Однако торасемид в большей степени улучшал качество жизни больных [42]. Результаты исследования TORIC (Torasemide In Congestive Heart Failure) показали способность торасемида не только улучшать клиническое состояние больных с ХСН II–III ФК, но и положительно влиять на долгосрочный прогноз. На фоне приема торасемида в дозе 10 мг/сут, по сравнению с фуросемидом в дозе 40 мг/сут и другими диуретиками, произошло статистически значимое снижение общей смертности – на 51,5% (р<0,05), сердечно-сосудистой – на 59,7% (р<0,05). Прием торасемида приводил к более значимому снижению ФК ХСН. При этом гипокалиемия в группе торасемида развивалась реже, чем на фоне приема фуросемида (12,9 и 17,9% соответственно, р=0,013) [43]. В другом исследовании торасемид в дозе 4–8 мг/ сут на фоне 6-месячного приема у больных с ХСН II–III ФК способствовал статистически значимому снижению уровня натрийуретического пептида в плазме крови, уменьшению конечно-диастолического размера, индекса массы миокарда и показателей диастолической функции ЛЖ. Более значимая динамика показателей отмечалась при назначении более высокой дозы препараты [44]. В российском рандомизированном многоцентровом исследовании ДУЭЛЬ-ХСН применение торасемида у пациентов с декомпенсированной ХСН II–IV ФК позволило достичь компенсации на 5 дней раньше, чем при назначении фуросемида. Торасемид способствовал более существенному повышению переносимости физической нагрузки в пробе с 6-минутной ходьбой по сравнению с фуросемидом (160 и 133 м соответственно, р<0,01) и статистически значимо улучшал показатели диастолической функции ЛЖ. Препарат реже приводил к гипокалиемии и развитию побочных эффектов по сравнению с фуросемидом (0,3 и 4,2% соответственно) [45].

В другом российском открытом многоцентровом рандомизированном исследовании ТРИОЛЯ [13] изучались эффекты торасемида (Тригрим®, «Польфарма») и фуросемида у пациентов с компенсированной ХСН II–III ФК. К окончанию наблюдения отмечалось сопоставимое снижение ФК ХСН в обеих группах. Улучшение качества жизни и повышение толерантности к физической нагрузке по данным теста 6-минутной ходьбы также наблюдалось у больных обеих групп, но более выраженной динамика показателей была в группе торасемида. Только торасемид привел к статистически значимому увеличению фракции выброса ЛЖ, снижению уровня натрийуретического гормона и уровня альдостерона (на 22,6%, р<0,001), улучшению диастолической функции ЛЖ, в то время как прием фуросемида ассоциировался с статистически значимым повышением уровня маркера синтеза коллагена (на 17,8%, р<0,001). Эффективность торасемида при ХСН была подтверждена в 2014 г. результатами рандомизированного многоцентрового исследования ПОЭТ. Торасемид в составе комбинированной терапии пациентов с ХСН II–III ФК по сравнению с фуросемидом приводил к более выраженному уменьшению отечного синдрома, улучшению качества жизни, показателей систолической функции ЛЖ, повышению толерантности к физической нагрузке [46].
Таким образом, торасемид является петлевым диуретиком, обладающим наряду с достаточной антигипертензивной активностью отличной переносимостью без развития отрицательных метаболических и электролитных эффектов. Торасемид – единственный представитель из группы петлевых диуретиков с доказанным влиянием на прогноз при ХСН. Препарат не только снижает сердечно-сосудистую и внезапную смертность, но и уменьшает частоту и продолжительность госпитализаций в связи с прогрессированием ХСН, выраженность клинических проявлений, повышает переносимость физической нагрузки, улучшает показатели диастолической функции ЛЖ и качество жизни больных. Доказанная клиническая эффективность торасемида обусловлена особыми фармакологическими свойствами, определяющими продолжительное диуретическое и антиальдостероновое действие с уменьшением процессов патологического ремоделирования миокарда ЛЖ. Поэтому применение торасемида является наиболее обоснованным выбором для проведения длительной терапии.
В нашей стране торасемид зарегистрирован под торговым названием Тригрим® («Польфарма»). Препарат удобен в применении и производится в виде таблеток с различными дозировками: 2,5, 5, 10 мг, что позволяет назначать Тригрим® в различных клинических ситуациях.



