Врачам наиболее известно участие витамина D в регуляции метаболизма кальция и поддержании структуры костной ткани. Но за последние 10 лет стали активнейшим образом исследоваться и другие роли витамина D, в частности, его воздействие на процессы воспаления и противоинфекционный иммунитет. Например, по ключевым словам vitamin D, immune, immunity, inflamma в базе данных Pubmed можно найти более 7000 ссылок, причем более 95% исследований было выполнено после 2003 г.
К настоящему времени накоплен существенный массив научно-исследовательских данных по иммуномодуляторным эффектам витамина D [1]. Особый интерес представляет потенцирование витамином D антиинфекционного (антибактериального и антивирусного) иммунитета. Наиболее хорошо изучена его роль в противотуберкулезном иммунитете [2]. У пациентов с туберкулезом прием витамина D заметно усиливает TLR2/1L-индуцированные ответы макрофагов [3]. Он может использоваться для профилактики и лечения не только туберкулеза, но и других инфекционных заболеваний [4]: хронического ринита и риносинусита, гриппа, вирусного гепатита и др. [5].
Фундаментальные исследования показали, что воздействие витамина D на иммунитет осуществляется посредством регуляции деления Т-хелперных лимфоцитов, дифференцирования В-клеток, секреции интерферона (ИФН) и других цитокинов [6] в результате воздействия на Toll-рецепторы (TLR2, TLR4), дектин-1 и рецептор маннозы и впоследствии повышения биосинтеза антимикробных пептидов кателицидина и дефенсина [7] (рис. 1).
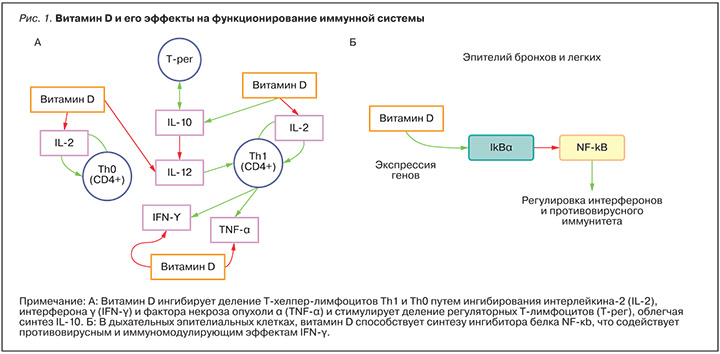
Антимикробный пептид кателицидин является неотъемлемым компонентом витамин-D-зависимого врожденного антимикробного иммунитета. Антимикробные пептиды встраиваются в цитоплазматическую мембрану бактерий и, приводя к образованию пор, нарушают целостность бактериальных клеток. Кроме того, проникая внутрь бактерий, положительно заряженные антимикробные пептиды связываются с отрицательно заряженными ДНК и РНК, что также стимулирует гибель бактериальных клеток. Биологически активная форма витамина D, 1,25-дигидроксивитамин-D3, дозозависимо повышает экспрессию кателицидина [8]. В клинике установлена корреляция (коэффициент 0,45; р=0,05) между концентрацией 25-гидроксивитамина D (25(OH)D) в плазме крови с уровнями кателицидина [9] (рис. 2).
Таким образом, обеспеченность витамином D существенно влияет на антиинфекционный иммунитет и процессы воспаления. Далее последовательно рассмотрены роли витамина D у взрослых в профилактике и терапии туберкулеза, вирусного гепатита, заболеваний с ярко выраженным компонентом хронического воспаления (аллергический ринит, атопический дерматит, ревматоидный артрит, воспалительное заболевание кишечника, сепсис) и таких респираторных заболеваний, как хронический бронхит, острые респираторные заболевания (ОРЗ) и хроническая обструктивная болезнь легких (ХОБЛ).

ВИТАМИН D И ТУБЕРКУЛЕЗ: ФУНДАМЕНТАЛЬНЫЕ И КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
У пациентов с туберкулезом (n=104, средний возраст 37 лет) было отмечено достоверное падение уровней 25(OH)D в крови, ассоциированное с повышением уровня провоспалительного С-реактивного белка (рис. 3) [2]. У пациентов с активной формой туберкулеза отмечена частая встречаемость авитаминоза D (концентрации 25(OH)D <10 нг/мл). Ретроспективное исследование включало наблюдение за 86 пациентами с туберкулезом и 80 пациентами с латентной инфекций в течение двух лет (средний возраст 41 год). При сравнении пациентов с активной и латентной формами туберкулеза авитаминоз D (<10 нг/мл в крови; относительный риск 2,02; 95% доверительный интервал 1,04–3,93) являлся независимым фактором риска заболевания [10].
Метаанализ 23 клинических исследований (n=6750) подтвердил связь между дефицитом витамина D (уровни 25(OH)D <20 нг/мл) и риском развития туберкулеза (ОР 2,57; 95% ДИ 1,74–3,80; р=0,00001). В среднем в объединенной группе пациентов с туберкулезом наблюдались значительно более низкие уровни 25(OH)D [11]. Таким образом, дефицит витамина D достоверно ассоциировался с более высоким риском туберкулеза.
Молекулярно-физиологические исследования показали, что именно дефицит витамина D является причиной восприимчивости организма к Mycobactеrium tuberculosis, а не наоборот. Так, анализы совместных культур инфицированных макрофагов и клеток эпителия дыхательных путей показали, что позитивный эффект витамина D на выживание макрофагов зависит от паракринной сигнализации через интерлейкин-1β (ИЛ-1β) с участием клеток эпителия и не является просто следствием усиления разрушения M. tuberculosis самими макрофагами [12].
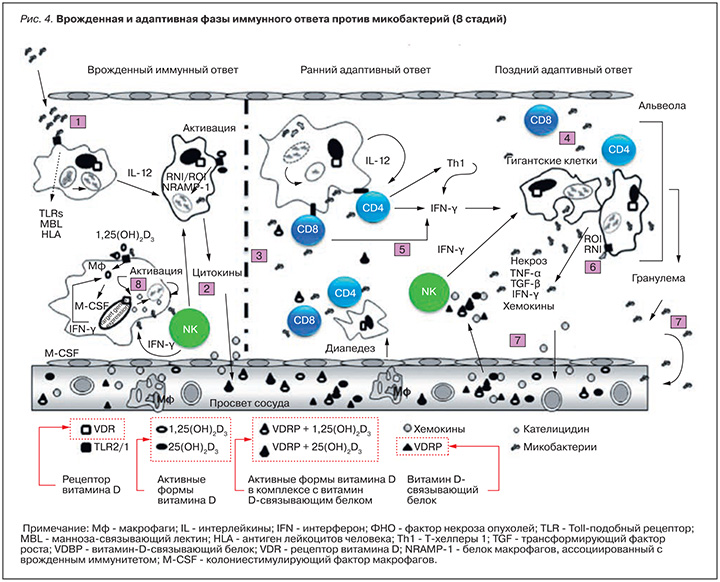
В осуществлении врожденного противотуберкулезного (антимикобактериального) иммунитета участвуют рецептор витамина D (VDR), витамин-D-связывающий белок (VDBP), TLR, синтетаза оксида азота и ИФН-γ [13]. Противотуберкулезный иммунный ответ можно подразделить на 8 основных стадий (рис. 4):
- Проникновение микобактерий в макрофаги.
- Макрофаги активируются ИФН-γ.
- Инициируется синтез оксида азота внутри фагоцитов.
- Образование гранулемы - важной структуры, предотвращающей распространение микобактерий. Гранулемы являются результатом CD-опосредованной гиперчувствительности замедленного типа в паренхиматозных тканях.
- Макрофаги, гигантские клетки, CD4, CD8 Т-клетки и NK-клетки изолируют внутриклеточные микобактерии в центре гранулемы.
- ИФН-γ активирует макрофаги, которые начинает ослаблять внутриклеточные микобактерии посредством активных форм азота (оксиды азота) и кислорода (пероксид-радикалы, озон и др.).
- Макрофаги представляют антигены Т-клеткам, которые активируются и синтезируют ряд различных цитокинов и цитокинов для уничтожения микобактерий (в частности, провоспалительный цитокин CXCL10).
- Связываясь с VDR-рецептором, активная форма витамина D, 1,25(OH)2D3, индуцирует экспрессию гена, кодирующего антимикробный пептид кателицидин. Моноциты активируются агонистами TLR2/1 за счет белковых фрагментов, полученных при разрушении микобактерий. Также активируются гены рецептора VDR и биосинтеза активной формы витамина D (фермент CYP27B1, который преобразует 25(OH)D3 в 1,25(OH)2D3), что приводит к увеличению клеточного уровня антимикробных пептидов кателицидина, дефенсина (с участием интрлейкина-1β, как описано выше) и повышенной бактерицидной активности фагоцитов [8].
При туберкулезе воспалительные реакции носят затяжной характер, характеризуются развитием фиброзных изменений легких, что повышает смертность. Витамин D, напротив, ускоряет процессы разрешения воспалительных реакций при лечении туберкулеза. В клиническом исследовании 146 пациентов, получавших антимикробную терапию туберкулеза легких, были рандомизированы к получению витамина D (по 100 000 МЕ на 7-й, 14-й, 28-й и 42-й дни) или плацебо. В дополнение к биохимическому анализу крови на дни 0 и 60 был определен профиль из 42 иммунологических факторов (ИЛ-1β, ИЛ-1RA, ИЛ-2, ИЛ-2R, ИЛ-4, ИФН-α, ИФН-γ, ФНО-α и др.). Было установлено, что прием витамина D снижал лимфопению и моноцитоз, подавлял синтез/секрецию провоспалительных цитокинов, ослаблял негативное воздействие антибактериальной терапии на антигенстимулированную избыточную секрецию ИЛ-4. В целом витамин D оказывал существенный противовоспалительный эффект за счет активации физиологического процесса завершения воспаления (так называемое разрешение воспаления) [14].
Следует отметить, что уровни провоспалительного цитокина CXCL10 в сыворотке крови всегда повышены у пациентов с туберкулезом и поэтому используются в качестве чуткого маркера эффективности противотуберкулезной терапии. Курсовой прием витамина D приводил к снижению уровней CXCL10, особенно среди пациентов с недостаточным уровнем 25(OH)D [15].
Результаты рандомизированного исследования пациентов с туберкулезом легких (n=259, средний возраст 27 лет) показали, что витамин D ускоряет выздоровление. Пациенты были рандомизированы для однократного получения 600 000 МЕ витамина D3 внутримышечно или плацебо. Через 12 недель после инъекции, по данным рентгенограммы грудной клетки, отмечена положительная динамика. Среднее число зон установленных повреждений сократилось до 1,4 (против 1,8 в контроле; р=0,004) на фоне снижения среднего размера полостей на ≥50% (р=0,035). Применение витамина D также привело к значительному увеличению секреции ИФН-γ, особенно у пациентов с исходно низкими уровнями 25(OH)D (р=0,021) [16].
ВИТАМИН D И ВИРУСНЫЙ ГЕПАТИТ
Дефицит витамина D ассоциирован с повышенным риском хронического гепатита С (ХГС) и ухудшением ответа на терапию ИФН-α (р=0,04) [17]. Метаанализ 11 клинических исследований с участием пациентов с ХГС (n=1575, 1117 случаев гепатита) показал наличие у пациентов достоверно более низких уровней гидроксивитамина D в сыворотке по сравнению с контролем. Среди пациентов с его уровнями >30 нг/мл в 1.57 раза чаще отмечался достоверно более высокий клиренс вирусных частиц по сравнению с контролем (ОР 1,57; 95% ДИ 1,12–2,2) [18].
При генотипе 1 ХГС низкие уровни витамина D в сыворотке крови ассоциировались с выраженным фиброзом печени и ухудшением ответа на стандартную терапию интерфероном и рибавирином. В группе пациентов (n=167), прошедших противовирусную терапию пегилированным интерфероном с рибавирином, более низкие уровни 25(OH)D были независимо связаны с повышенным риском некроза печени (р=0,04) и тяжелой формой фиброза (стадии F3, F4) [19].
Прием витамина D улучшает ответ на противовирусное лечение рецидивирующего гепатита C рибавирином. В группе из 42 пациентов была применена комбинированная терапия рибавирином и ИФН-α течение 48 недель. При этом 15 пациентам был назначен прием препаратов витамина D3 (800 МЕ/сут, в среднем 425 дней) для предотвращения потерь костной массы. Снижение вирусной нагрузки наблюдалось только у 1 из 10 пациентов с авитаминозом D (<10 нг/мл 25(ОН)D в сыворотке крови) и у 6 из 12 пациентов с умеренным дефицитом витамина D (>20 нг/мл; р <0,05). Прием холекальциферола в 2 раза повышал шансы на снижение вирусной нагрузки после комплексной терапии. Причем применение витамина D в дозе 800 МЕ/сут в течение ≥6 месяцев приводило к полной элиминации вирусных частиц более чем у половины пациентов.
Низкий уровень витамина D характерен для пациентов с ХГС и, помимо увеличения риска заболевания, стимулирует развитие фиброза печени. Метаанализ 12 исследований, включавших пациентов с ХГС, в которых оценивали стадию фиброза печени, показал, что низкие уровни 25(OH)D в плазме отчетливо коррелируют с прогрессирующим фиброзом печени (ОР 1,88) [21].
ДЕФИЦИТ ВИТАМИНА D, ВОСПАЛЕНИЕ И АЛЛЕРГИЯ
Хроническое воспаление не только отягчает инфекционный процесс, но и способствует развитию многочисленных осложнений. Фундаментальные и клинические исследования показали, что недостаточность витамина D у взрослых стимулирует развитие аллергического ринита и патологий, ассоциированных с хроническим системным воспалением (атопический дерматит, ревматоидный артрит, воспалительное заболевание кишечника, сепсис и др.).
Метаанализ 7 исследований (n=1347, средний возраст 20 лет) подтвердил, что уровень 25(OH)D в сыворотке был ниже у пациентов с атопическим дерматитом. Степень тяжести заболевания оценивали с использованием индекса атопического дерматита (SCORAD) и индекса оценки площади и степени экземы (EASI). По сравнению со здоровыми лицами уровни 25(OH)D у пациентов с дерматитом были ниже во всех возрастных группах (-2,03 нг/мл; 95% ДИ от -2,52 до -0,78). Индекс SCORAD и показатель EASI уменьшались после приема витамина D (-5,85; 95% ДИ от -7,66 до -4,05) [22]. Мета-анализ 9 исследований показал, что дотации витамина D уменьшают тяжесть атопического дерматита, являясь высоко безопасной терапией, снижающей выраженность симптомов заболевания (-5,8; 95% ДИ от -9,0 до -2,5; р=0,0004) [23].
Метаанализ 21 исследования подтвердил взаимосвязь между низкими уровнями витамина D и более высоким риском аллергического ринита. Уровни 25(OH)D ≥75 нмоль/л соответствовали более низкой частоте этого заболевания по сравнению с концентрациями <50 нмоль/л (ОР 0,71; 95% ДИ 0,56–0,89; p=0,04) [24].
Метаанализ 15 исследований (n=2106) показал, что уровень 25(OH)D в сыворотке крови у пациентов с ревматоидным артритом значительно ниже по сравнению с контролем (-12 нг/мл; 95% ДИ от -21 до -1; p=0,017). Встречаемость дефицита витамина D была выше среди пациентов с артритом (55 против 33%; ОР 2,46; 95% ДИ 1,14–5,33; p=0,023). Метаанализ показал значимую обратную корреляцию между уровнем витамина D и тяжестью ревматоидного артрита, оцененной по шкале активности заболевания в 28 суставах (DAS28): коэффициент корреляции = -0,27; p=0,00002) [25].
Метаанализ 24 исследований (n=3489) подтвердил, что у пациентов с ревматоидным артритом уровень витамина D был ниже, чем в контроле (-16,5 нмоль/л; 95% ДИ от -18,9 до - 14,2). Отмечена отрицательная корреляция между уровнем 25(OH)D и индексом активности заболевания, т.е. более низкие уровни 25(OH)D соответствовали более высокому значению показателя DAS28 (r = -0,13; 95% ДИ от -0,16 до -0,09) [26].
Метаанализ 14 исследований (n=1891) показал, что язвенный колит достоверно ассоциирован с дефицитом витамина D (ОР 1,64; 95% ДИ 1,30–2,08; р <0,0001). У пациентов с дефицитом витамина D риск развития язвенного колита был в 2 раза выше, чем при нормальных уровнях 25(OH)D (ОР 2,28; 95% ДИ 1,18–4,41; р=0,01) [27].
Рандомизированное исследование показало эффективность дотаций витамина D (20 000 МЕ/нед, 5 лет) в терапии инфекций мочевыводящих путей (цистит, пиелонефрит; n=227). После приема витамина D частота инфекций снизилась до 18%, а в контрольной группе – только до 34% (p < 0,02) [28].
Метаанализ 10 исследований показал, что дефицит витамина D ассоциирован с повышенным риском сепсиса (ОР 1,78; 95% ДИ 1,55–2,03; р <0,01). Стандартизованная средняя разница в уровне 25(OH)D у пациентов с сепсисом и контрольной группы составила -4 нг/мл (95% ДИ от -8 до -0,05; р=0,05) [29].
ВИТАМИН D И РЕСПИРАТОРНЫЕ ЗАБОЛЕВАНИЯ
Возникающее на фоне недостаточности витамина D хроническое воспаление нарушает врожденный иммунитет и снижает резистентность организма к хроническому бронхиту и ОРЗ, повышает риск развития ХОБЛ.
Так, в крупномасштабном клинико-эпидемиологическом исследовании у взрослых старше 20 лет (n=8300) относительный риск хронического бронхита у лиц с уровнями 25(OH)D в сыворотке <15 нг/ мл составил 1,85 (95% ДИ 1,06-3,24) по сравнению с группой, в которой уровни 25(OH)D превышали 30 нг/мл. Было показано, что увеличение уровня 25(OH)D на каждый 1 нг/мл соответствует падению риска заболевания на 2,6% (р=0,016) [30].
Метаанализ 25 рандомизированных исследований (n=10933), проведенный с использованием данных индивидуальных пациентов, показал, что дотации витамина D способствовали снижению риска инфицирования ОРЗ в среднем на 12% (ОР 0,88; 95% ДИ 0,81–0,96; р <0,001). При проведении анализа подгрупп пациентов было установлено, что среди лиц, имевших более одного эпизода ОРЗ в год, риск повторного ОРЗ при приеме витамина D снижался на 20% (ОР 0,80; 95% 0,69–0,93; р=0,004) [31].
Метаанализ 21 исследования (n=11993) показал, что дефицит витамина D ассоциируется с повышенным риском ХОБЛ. У пациентов с ХОБЛ уровни витамина D в сыворотке были существенно ниже, чем у лиц контрольной группы (-11 нг/мл; 95% ДИ от -15 до -6; р <0,001), особенно при тяжелой форме ХОБЛ (-13,5 нг/мл; 95% ДИ от -22 до -3,5 нг/мл; р=0,001). Дефицит витамина D ассоциировался с повышением риска ХОБЛ почти в 2 раза (ОР 1,77; 95% ДИ 1,18–2,64; р=0,006), а тяжелого течения ХОБЛ – в 3 раза (ОР 2,83; 95% ДИ 2,00–4,00; р <0,001) [32].
Метаанализ 5 исследований показал, что уровень 25(OH)D в сыворотке крови у здоровых был достоверно выше, чем у пациентов с ХОБЛ (+9 нг/мл; 95% ДИ от +4,5 до +14; р <0,001) [33].
ДОЗИРОВАНИЕ ВИТАМИНА D
Приведенные выше результаты доказательных исследований показывают, что обеспеченность взрослых витамином D (уровни 25(OH)D >30 нг/ мл) принципиально важна для повышения антиинфекционного иммунитета. Рекомендуемое суточное потребление витамина D для абсолютно здоровых взрослых составляет 400–600 МЕ/сут [34]. Однако использование таких доз у больных малоэффективно и не позволяет достичь нижней границы нормы даже при длительном использовании (месяцы, годы) [1].
Клинические исследования показывают, что для терапии, например, пациентов с метаболическими нарушениями, эффективны дозы не менее 2000 МЕ/сут. Более того, даже такая «высокая» доза достаточно медленно поднимает уровни 25(OH)D в крови. Так, прием витамина D в дозе 2000 МЕ/ сут приводил к достоверному повышению уровня 25(OH)D в сыворотке всего на 6 нг/мл за 3 месяцев терапии (р <0,001) [35].
Сравнение эффектов ежедневного приема витамина D по 600, 1200 и 2000 МЕ/сут в течение 8–10 месяцев в группе женщин (n=91) показало существенно более высокую эффективность дозировки 2000 МЕ/сут. К концу исследования частота выраженного дефицита витамина D (25(OH)D <20 нг/мл) составила 20% в группе принимавших 2000 МЕ/сут, 58% в группе принимавших 1200 МЕ/сут и 61% в группе принимавших витамин D в дозе 600 МЕ/сут (р=0,03). При этом не было отмечено неблагоприятных последствий приема витамина D в указанных дозах [36].
В целях поддержки иммунитета у лиц из различных групп риска (туберкулез, вираж Манту, контакт с больным туберкулезом, пациенты с гепатитом, колитом, циститом, пиелонефритом, ХОБЛ, часто и длительно болеющие ОРЗ и др.) витамин D следует назначать в дозах 2000–4000 МЕ/сут не менее 3–6 месяцев. В качестве дополнительного источника витамина D может рассматриваться Д-Сан (1 капля – 200 МЕ). В отличие от ряда препаратов витамина D на основе масляных растворов «Д-Сан D3» отличают хорошие органолептические свойства (приятный вкус малины).
Современная концепция коррекции дефицита витамина D также включает регулярную диагностику его дефицита путем определения концентраций 25(OH)D в сыворотке крови до достижения уровней ≥30 нг/ мл [1]. Поэтому, у многих пациентов применение витамина D может оказаться достаточно длительным.
ЗАКЛЮЧЕНИЕ
Основными причинами смертности и снижения качества жизни россиян являются сердечно-сосудистые, цереброваскулярные и опухолевые заболевания [37]. В то же время наибольшее число обращений в поликлинику по-прежнему связано с ОРЗ, активирующими развитие патологического воспаления. На фоне гиповитаминоза D воспалительные реакции приобретают хронический характер, что существенно повышает риск сосудистой патологии. Поэтому компенсация недостаточности витамина D важна не только для профилактики и терапии инфекционных заболеваний, но и для снижения риска развития у взрослых так называемых болезней цивилизации.
Приведенные в настоящей статье результаты клинических исследований свидетельствуют о том, что возникающее на фоне недостаточности витамина D хроническое воспаление, наряду с нарушениями врожденного иммунитета, существенно снижает резистентность организма к туберкулезу, вирусному гепатиту, ОРЗ, хроническому бронхиту, повышает риск ХОБЛ. Данные доказательной медицины указывают на важность использования препаратов витамина D и добавок для поддержки иммунитета и противоинфекционной защиты.



