Неуклонный рост пациентов с хронической болезнью почек (ХБП), нуждающихся в лечении программным гемодиализом, является отражением двух процессов: пандемии социально значимых заболеваний, таких как артериальная гипертензия (АГ), сахарный диабет, и неуклонного старения населения. ХБП приводит к нарушению гомеостаза. Это сопровождается нарушением всех функций систем организма и отражается в изменении внутриклеточных процессов. Поэтому изучение процессов нарушения структурно-функциональных свойств клеточных мембран у лиц с ХБП 5-й диализной (5д) стадии в последние годы приобретает все большую актуальность, так как в последующем будет способствовать коррекции лечения. Имеющиеся в литературе работы свидетельствуют о том, что на дестабилизацию мембран эритроцитов могут повлиять такие системные и органные факторы, как ишемия тканей, микробное или иммунное воспаление. Степень неспецифических мембранодестабилизирующих процессов раскрывает характер повреждений в системах и органах [1–4]. Прижизненное изучение свойств мембран клеток может позволить прямо и косвенно оценить регуляцию всех биологических процессов в клетках организма [3, 5]. Поверхностный электрический заряд мембраны является одной из основных физических характеристик эритроцитов, величину которого оценивают по их электрофоретической подвижности. Электрофоретическая подвижность эритроцитов (ЭФПЭ) – способность эритроцитов двигаться в электрическом поле с той или иной скоростью в зависимости от величины их поверхностного электрического заряда мембраны. Эритроциты должны обладать стабильной величиной поверхностного заряда для выполнения присущих им функций и поддержания гомеостаза организма. Определяющее влияние на величину ЭФПЭ оказывает физико-химическое состояние клеточной мембраны (наряду с составом окружающей клетку среды).
В литературе встречаются публикации, свидетельствующие о снижении электрического заряда эритроцита при сепсисе, заболеваниях кишечника, острых респираторных заболеваниях, пневмонии, ревматических заболеваниях, а также в условиях стресса [2, 3, 6–8].
Терминальные состояния, такие как ХБП 5д-стадии, вызывают изменения плотности поверхностного электрического заряда форменных элементов крови, что сопровождается нарушением стабильности клеточной взвеси и функциональной активности клеток.
Таким образом, ЭФПЭ у пациентов, находящихся на программном диализе, остается практически неизученной. Необходимо появление новых данных, в том числе и о влиянии медикаментозной терапии на заряд мембран эритроцитов, для дальнейшего назначения адекватной терапии.
Цель исследования – изучить особенности ЭФПЭ у пациентов, находящихся на программном гемодиализе, и проанализировать влияние антигипертензивной терапии на этот параметр.
МАТЕРИАЛ И МЕТОДЫ
 В исследование были включены 120 пациентов с ХБП 5д-стадии (55% женщин, 45% мужчин), получавших процедуру программного гемодиализа в Ижевске (Городская клиническая больница № 6). Средний возраст пациентов составил 49,7±9,4 года. Процедуры выполнялись на аппаратах Fresenius 4008S (Германия) и B. Braun-Dialog+ (Германия) по 4–4,5 ч 3 раза в неделю с применением полисульфоновых диализаторов. Во время гемодиализа использовался только бикарбонатный диализирующий раствор. Индекс адекватности Kt/V по мочевине был выше 1,2 и составил 1,43±0,09. Для выявления особенностей нарушений клеточных мембран была взята группа сравнения, в которую были включены 60 практически здоровых лиц (доноры крови), сопоставимые по возрасту и полу.
В исследование были включены 120 пациентов с ХБП 5д-стадии (55% женщин, 45% мужчин), получавших процедуру программного гемодиализа в Ижевске (Городская клиническая больница № 6). Средний возраст пациентов составил 49,7±9,4 года. Процедуры выполнялись на аппаратах Fresenius 4008S (Германия) и B. Braun-Dialog+ (Германия) по 4–4,5 ч 3 раза в неделю с применением полисульфоновых диализаторов. Во время гемодиализа использовался только бикарбонатный диализирующий раствор. Индекс адекватности Kt/V по мочевине был выше 1,2 и составил 1,43±0,09. Для выявления особенностей нарушений клеточных мембран была взята группа сравнения, в которую были включены 60 практически здоровых лиц (доноры крови), сопоставимые по возрасту и полу.
Все пациенты были разделены на 3 группы в зависимости от уровня артериального давления (АД): нормальное, пониженное и повышенное АД. Пациенты с АГ были разделены в соответствии со степенью этого заболевания на 3 группы. Монотерапия антигипертензивными препаратами включала применение блокатора медленных кальциевых каналов (БКК), бета-адреноблокатора (ББ) и ингибитора ангиотензинпревращающего фермента (ИАПФ). В качестве комбинированной терапии использовались следующие схемы: комбинация БКК и ББ, БКК и ИАПФ, БКК и агонист I1-имидазолиновых рецепторов (АИР – моксонидин), ББ и ИАПФ, БКК с ББ и АИР. Сравниваемые группы были сопоставимы по полу и возрасту.
Для оценки мембранных нарушений проводили определение ЭФПЭ с помощью комплекта «Цито-Эксперт» (ОАО «Аксион холдинг», Ижевск, 2010). Он обеспечивает возможность регистрации и оценки параметров движения живых клеток под действием знакопеременного электрического поля с заданными характеристиками в световом микроскопе «Биолам». Рассчитывали процент подвижных эритроцитов, у которых регистрировали среднюю амплитуду колебания (САКЭ), асимметрию колебания.
 Пациентам проведено суточное мониторирование АД (аппарат МЭКГ-ДП-НС-01, 2012) в течение 23,2+0,6 ч. Оценивалась взаимосвязь биохимических анализов с суточным мониторированием АД (СМАД), которое проводилось в соответствии со стандартами диагностики больных, находящихся на программном гемодиализе, и включали следующие показатели: уровни креатинина (780,45±199,9 мкмоль/л), мочевины (29,4±6,9 ммоль/л), калия (5,33±0,47 ммоль/л), натрия (137,7±2,1 ммоль/л), кальция (2,52±0,5 ммоль/л), фосфора (2,1±0,4 ммоль/л), щелочной фосфатазы (311,7+155,2 Е/л), общего холестерина (5,1±1,2 ммоль/л), паратгормона (899,3± 728,7 пг/ мл).
Пациентам проведено суточное мониторирование АД (аппарат МЭКГ-ДП-НС-01, 2012) в течение 23,2+0,6 ч. Оценивалась взаимосвязь биохимических анализов с суточным мониторированием АД (СМАД), которое проводилось в соответствии со стандартами диагностики больных, находящихся на программном гемодиализе, и включали следующие показатели: уровни креатинина (780,45±199,9 мкмоль/л), мочевины (29,4±6,9 ммоль/л), калия (5,33±0,47 ммоль/л), натрия (137,7±2,1 ммоль/л), кальция (2,52±0,5 ммоль/л), фосфора (2,1±0,4 ммоль/л), щелочной фосфатазы (311,7+155,2 Е/л), общего холестерина (5,1±1,2 ммоль/л), паратгормона (899,3± 728,7 пг/ мл).
Статистическая обработка результатов исследования осуществлялась по общепринятым методикам вариационной статистики с использованием прикладных программ BioStat (Primer of Biostatistics, Практика, Москва, 2009, версия 4.03) и Microsoft Excel 2010 (США). Данные представлены в виде M±σ, где М – средняя величина, σ – стандартное отклонение. Различия между средними значениями считали статистически значимыми при p <0,05. Анализ зависимостей проводился с использованием коэффициента ранговой корреляции Спирмена (rs).
РЕЗУЛЬТАТЫ
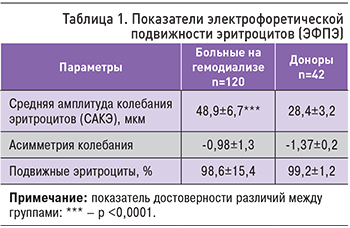
При сопоставлении результатов исследования основной группы и группы сравнения наблюдалось значительное увеличение САКЭ: 49,7±6,3 и 28,4±3,2 мкм соответственно (табл. 1; р <0,01), что можно связать с грубыми патофизиологическими нарушениями у пациентов с ХБП, которые затрагивают клеточные мембраны, что связанно с изменением системы гемостаза и механическим повреждением эритроцитов при прохождении диализного фильтра. Существенных различий показателей асимметрии (-0,98±1,3, -1,37±0,2; р >0,05) и эксцесса (5,1±6,9, 9,62±1,7; р >0,05) у больных на программном гемодиализе и группы сравнения не отмечалось. Процент подвижных эритроцитов не отличался у пациентов на гемодиализе и доноров (табл. 1, р >0,05).
Не получено различий САКЭ по полу: у мужчин 50,6±6,9 мкм, у женщин – 49±7,6 мкм (р >0,05). Выявлены отличия в этом показателе у пациентов с различным диализным стажем: от 1 до 6 лет – 44,8±8,2 мкм, 6–10 лет – 56,3±5,5 мкм, более 11 лет – 50,6±2,3 мкм (р1–2<0,01, р2–3<0,01). В первые годы диализной терапии наблюдается высокая летальность пациентов: в это время происходят грубые нарушения и перестройка биологических процессов, что может быть объяснением более значимого снижения показателей САКЭ у лиц с длительностью диализной терапии от 1 года до 6 лет (р <0,01).
 Выявлено, что такой этиологической фактор ХБП, как поликистозная болезнь почек, более значимо уменьшал САКЭ (48,6±4,5 мкм; р <0,01). Это, возможно, связано с генетически обусловленными нарушениями строения клеточных мембран, а также наличием хронического воспалительного процесса и тяжелой АГ. Значение САКЭ у больных хроническим гломерулонефритом составило 49,5±6,3 мкм, диабетической нефропатией – 50,7±7,2 мкм, вторичным хроническим пиелонефритом – 54,7±4,1 мкм (р <0,01).
Выявлено, что такой этиологической фактор ХБП, как поликистозная болезнь почек, более значимо уменьшал САКЭ (48,6±4,5 мкм; р <0,01). Это, возможно, связано с генетически обусловленными нарушениями строения клеточных мембран, а также наличием хронического воспалительного процесса и тяжелой АГ. Значение САКЭ у больных хроническим гломерулонефритом составило 49,5±6,3 мкм, диабетической нефропатией – 50,7±7,2 мкм, вторичным хроническим пиелонефритом – 54,7±4,1 мкм (р <0,01).
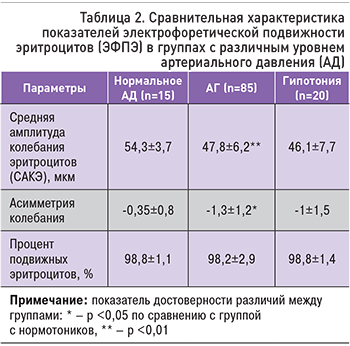
У пациентов с АГ и нормальным АД выявлены различия показателей САКЭ: 47,8±6,2 и 54,3±3,7 мкм соответственно (p <0,01). У пациентов с АГ отмечались более низкие (отрицательные) значения асимметрии колебания эритроцитов, чем у пациентов с нормальным АД (-1,3±1,2 и -0,35±0,8 соответственно; p <0,01). У больных АГ с повышенным и пониженным АД не получено статистических различий по проценту подвижных эритроцитов (табл. 2).
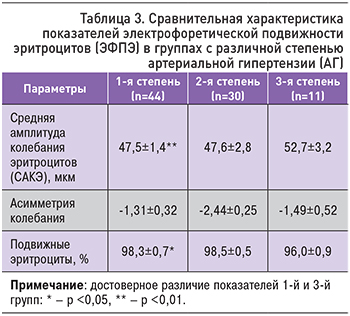
У лиц с АГ 1-й степени САКЭ составила 47,5±1,4 мкм, с АГ 2-й степени – 47,6±2,8 мкм, с АГ 3-й степени – 52,7±3,2 (p <0,01; табл. 3). Различий показателя асимметрии колебания эритроцитов получено не было. У пациентов с АГ 1-й степени процент подвижных эритроцитов был достоверно выше, чем у лиц с АГ 3-й степени (98,3±0,7 и 96,0±0,9% соответственно p <0,05).
Снижение САКЭ при АГ может быть объяснено нарушением структуры и функции мембран клеток, которая заключается в большей скорости облегченного переноса ионов через клеточную мембрану при наличии АГ [9]. При изучении АГ у пациентов, находящихся на программном гемодиализе, Boero и соавт. (2008) измерили активность натрий-калиевой аденозинтрифосфатазы (Na+/K+-АТФазы) эритроцитов и отметили более низкую активность помпы у больных АГ в отличие от пациентов с нормальным АД. В последующих работах приводятся данные об ингибировании Na+/K+-АТФазы, за счет чего происходит возрастание уровня внутриклеточного натрия параллельно с увеличением цитозольного кальция, что приводит к повышению базального тонуса сосудов и усилению реакции сосудов на сосудосуживающие вещества [10, 11].
При проведении СМАД установлены высокие корреляции САКЭ со степенью ночного снижения АД (САД rs=0,73; p <0,001; ДАД rs=0,63; p <0,001) и с частотой сердечных сокращений (rs=-0,64; p <0,001). Степень ночного снижения АД является показателем, не только определяющим вид суточного ритма АД, но и значительно влияющим на прогрессирование гипертрофии левого желудочка, риск возникновения кардиоваскулярных осложнений и в конечном итоге на выживаемость пациентов с АГ. Таким образом, нарушение свойств клеточных мембран может определять прогноз заболевания, что, в свою очередь, определяет стратегию антигипертензивной и органопротективной терапии. В связи с этим нами было проведено сравнение показателей мембранных нарушений при различной антигипертензивной терапии.
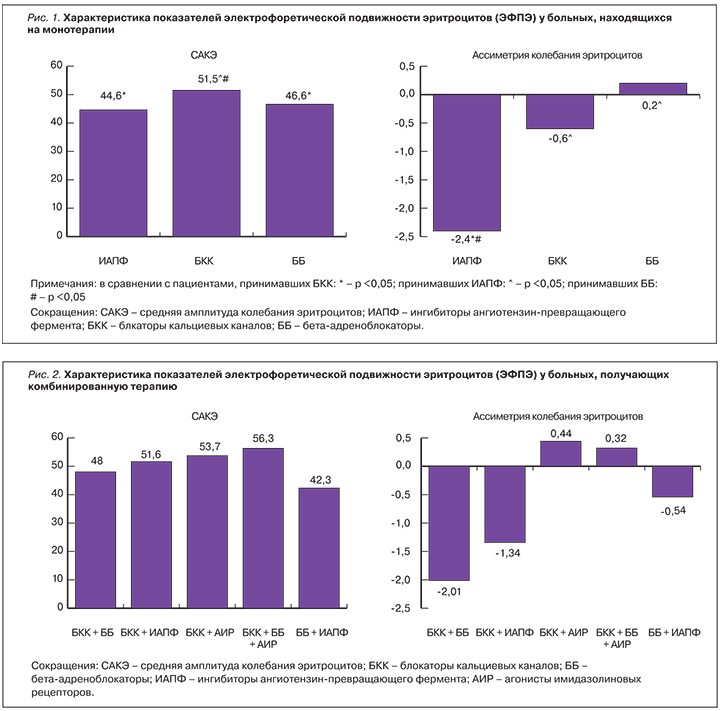
У пациентов, получающих терапию БКК, уровень САКЭ составил 51,5±5,4 мкм; ИАПФ – 44,6±5,8 мкм; ББ – 46,6±1,1 мкм (p1–3 <0,05; p1–2 >0,05, p2–3 <0,05). Уровень асимметрии колебания эритроцитов у пациентов, принимавших ИАПФ, составил -2,4±0,3, БКК – -0,6±1,4; ББ – 0,2±0,3 (p1-3 <0,05; p1-2 <0,05, p2-3 >0,05; рис. 1). В ряде работ показано, что БКК могут защищать клетку от повреждения плазматических мембран (ишемического, физического или химического), приводящего к апоптотической смерти клетки, или некрозу в условиях продолжительного повышения внутриклеточной концентрации Са2+ [12–14]. Данное заключение подтверждает полученные нами данные о положительном влиянии монотерапии БКК на электрический заряд мембраны эритроцита (p <0,05). Также при отсутствии БКК в комбинированной антигипертензивной терапии наблюдались наиболее низкие показатели САКЭ (комбинация ББ и ИАПФ; 42,3±6,3 мкм, p <0,05).
Тройная комбинация (БКК, ББ, АИР) более эффективно стабилизировала заряд клеточных мембран, что подтверждает более высокий уровень САКЭ у пациентов (56,3±6,9 мкм; p <0,01). Полученные результаты могут говорить о необходимости применения у пациентов с АГ, получающих лечение программным ГД, тройных комбинаций в низкодозовых режимах. Выявлены высокие показатели САКЭ и у пациентов, принимавших БКК с АИР, БКК с ИАПФ, БКК с ББ (рис. 2). Таким образом, из двойных комбинаций наиболее эффективна в плане стабилизации заряда клеточных мембран комбинация БКК и АИР. В ряде работ показана роль нарушения вегетативного гомеостаза в патогенезе АГ при ХБП, в связи с этим применение селективных АИР является необходимым [15, 16]. Наши данные показывают, что препараты АИР могут положительно влиять на свойства мембран клеток.
ЗАКЛЮЧЕНИЕ
Показатели ЭФПЭ у больных, находящихся на программном гемодиализе, имеют свои особенности, связанные со значительным увеличением САКЭ (48,9±6,7 мкм), по сравнению с группой здоровых (28,4±3,2 мкм). На уровень САКЭ влияет длительность диализной терапии (более низкие показатели при гемодиализе от 1 года до 6 лет), этиологический фактор (более низкий показатель САКЭ при поликистозе почек), наличие и степень АГ. Значение САКЭ прямо связано со степенью ночного снижения АД (САД r=0,73, ДАД r =0,63). Установлены высокие показатели ЭФПЭ при монотерапии БКК и приеме тройной комбинации антигипертензивными препаратами (ББ, БКК, АИР).


