Высокая распространенность заболеваемости бронхиальной астмы (БА) в последние три–четыре десятилетия стала серьезной проблемой здравоохранения из-за частой инвалидизации и смертности пациентов [1, 2].
В гиперреактивности бронхиальных структур, которая наблюдается при БА, провоцирующую роль могут играть вирусные инфекции (риновирусы, респираторно-синцитиальные вирусы, вирусы гриппа, парагриппа, аденовирусы), бактериальные, микоплазменные инфекции и развитие сенсибилизации к ним [3, 4]. БА относится к гетерогенным заболеваниям с многофакторной обусловленностью и взаимодействием многочисленных соматических и психических составляющих [1, 2].
Несмотря на значительные успехи современной медицины в диагностике и лечении этого заболевания стабилизация клинико-функциональных показателей на фоне базисной терапии БА достигается только у 50–60% больных, что вызывает необходимость изучения факторов, снижающих эффект лечения. Важное место среди них занимают инфекции (вирусы, внутриклеточные микроорганизмы), способствующие возникновению бронхообструктивных состояний, обострений БА, формированию осложнений [3–12].
Одним из значимых факторов, влияющих на патофизиологический процесс формирования БА, является нарушение структуры и функции соединительной ткани, что, вероятно, имеет прямое отношение и к изменению клинических симптомов этой патологии.
В литературе последних лет стало уделяться много внимания проблеме дисплазии соединительной ткани (ДСТ) [13–14]. Обобщение многочисленных научных исследований ДСТ было представлено в Национальных российских рекомендациях [15–16]. В исследованиях влияния ДСТ на строение и функцию бронхолегочной системы отмечается нарушение формирования эластического каркаса легких. Это обусловливает изменение архитектоники легочной ткани в виде деструкции межальвеолярных перегородок и недоразвития эластических и мышечных волокон в мелких бронхах и бронхиолах, ведущих к повышенной растяжимости и сниженной эластичности легочной ткани с образованием эмфизематозных булл, поликистоза на фоне бронхиальной обструкции. Врожденный дефект хрящевого и соединительнотканного каркаса трахеи и бронхов приводит к нарушению их подвижности (дискинезии), возникновению бронхоэктазов, пневмосклероза [15–20]. У пациентов с БА и проявлениями ДСТ быстро формируется легочная гипертензия, пневмофиброз, легочные буллы, бронхоэктазы, что определяет тяжелое течение астмы.
Общепризнано, что системные и ингаляционные глюкокортикостероиды (ГКС) – наиболее эффективные противовоспалительные препараты в терапии БА. При этом ингаляционные ГКС (ИГКС) более безопасны в сравнении с пероральными. Использование в клинической практике ИГКС существенно повлияло на качество терапии БА [1, 2, 7, 21]. Несмотря на высокую эффективность их применения в лечении детей с БА, нельзя не считаться с побочными явлениями этого вида терапии, к которым, в частности, относится развитие микробного и вирусного поражения бронхолегочной системы. При наличии у больных с БА структурных повреждений легких назначение ИГКС должно быть оправданным [22].
Цель исследования – изучить связь длительности стероидной терапии БА у детей с частотой возникновения внебольничных пневмоний (ВП).
МАТЕРИАЛ И МЕТОДЫ
 Обследовано 39 детей 3–18 лет с атопическим вариантом клинического течения БА и проявлениями ДСТ. 66,7% участников исследования (26 детей) имели легкое персистирующее течение БА, 33,3% (13 больных) – среднетяжелое. Пациентам были проведены необходимые клинические, лабораторные, инструментальные исследования.
Обследовано 39 детей 3–18 лет с атопическим вариантом клинического течения БА и проявлениями ДСТ. 66,7% участников исследования (26 детей) имели легкое персистирующее течение БА, 33,3% (13 больных) – среднетяжелое. Пациентам были проведены необходимые клинические, лабораторные, инструментальные исследования.
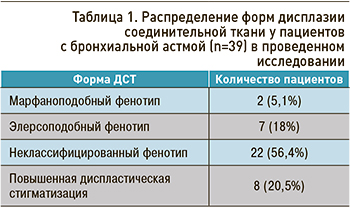
ДСТ, согласно принятым Рекомендациям [3], была выявлена у 31 ребенка (79,5%). Распределение различных форм ДСТ у участников исследования приведено в таблице 1.
Все пациенты получали базисную терапию (ИГКС в низких, средних, средне-высоких дозах) и были разделены на 4 группы в зависимости от длительности применения ИГКС (табл. 2).
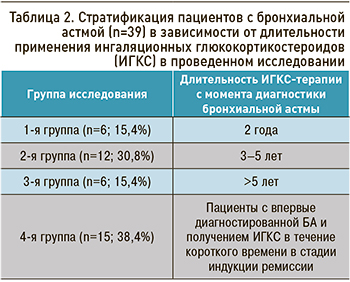 Низкие дозы ИГКС составляли основу базисной терапии у 12 пациентов (30,8%), средние – у 18 (46,1%), средневысокие – у 9 (23,1%). В 1-й группе все пациенты получали средние дозы ИГКС. Средневысокие дозы ИГКС были назначены всем больным 3-й группы, 20% – из 4 группы; низкие дозы ИКС использовались у 80% детей из 4-й группы. Во 2-й группе 75% больных получали средние дозы ИГКС и 25% – средневысокие.
Низкие дозы ИГКС составляли основу базисной терапии у 12 пациентов (30,8%), средние – у 18 (46,1%), средневысокие – у 9 (23,1%). В 1-й группе все пациенты получали средние дозы ИГКС. Средневысокие дозы ИГКС были назначены всем больным 3-й группы, 20% – из 4 группы; низкие дозы ИКС использовались у 80% детей из 4-й группы. Во 2-й группе 75% больных получали средние дозы ИГКС и 25% – средневысокие.
Статистическая обработка результатов проводилась с вычислением достоверности разности относительных величин (t), для поиска корреляций использовалось определение коэффициента корреляции (rxy). Выявление различий в изучаемых распределениях (частота ВП у детей с БА при длительном приеме ИГКС и частота ВП у больных, не получавших ранее ИКС при впервые диагностированной астме) проводили с применением вычисления показателя соответствия (c2).
РЕЗУЛЬТАТЫ
При обследовании 39 детей выявленные изменения позволили подтвердить диагноз БА у этих пациентов и проанализировать результаты назначенной базисной терапии ИГКС. У 22 пациентов с БА (56,4%) была выявлена ВП. Следует отметить, что ВП имели место у всех детей с марфаноподобным (МПФ) и элерсоподобным фенотипами (ЭПФ) ДСТ, у 45,5% пациентов с неклассифицированным фенотипом (НКФ) и у 37,5% больных с повышенной диспластической стигматизацией (пДС). Тяжесть симптомов БА у детей с ВП была более выражена в сравнении с детьми, не имевшими проявлений пневмонии, и характеризовалась большой длительностью респираторных проявлений (в том числе бронхообструкции). Так, у 17 детей без признаков пневмонии (43,6%) бронхообструкция продолжалась 5,5±2,3 дня, тогда как у пациентов с БА и ВП, симптомами интоксикации, физикальными изменениями в легких, характерными для пневмонии, – 11,5±2 дней.
При изучении этиологии ВП (с использованием иммуноферментного анализа крови и определением антител к инфекционным агентам) микоплазменная инфекция была выявлена у 20 детей (90,9%), хламидийная – у 6 (27,3%), вирус Эпштейна–Барр – у 5 (22,7%), пнемококк – у 3 (13,6%), сочетание нескольких возбудителей (микоплазменная инфекция, цитомегаловирус, хламидийная инфекция, вирус Эпштейна–Барр) – у 12 (54,5%) больных.
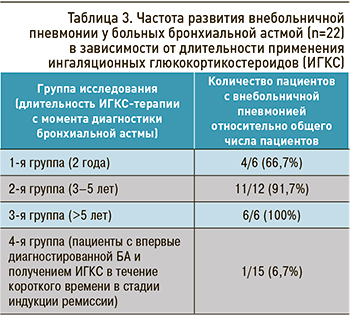 Распределение частоты ВП, в зависимости от длительности применения ИГКС у пациентов с БА, отражено в таблице 3. При исследовании корреляции между продолжительностью ИГКС-терапии и частотой возникновения ВП установлена сильная положительная корреляционная связь (rxy=0,98; р <0,001). Введение в курс базисного лечения БА направленной антибактериальной терапии (макролидов) позволило значительно улучшить состояние пациентов: устранить интоксикацию, уменьшить проявления респираторного синдрома.
Распределение частоты ВП, в зависимости от длительности применения ИГКС у пациентов с БА, отражено в таблице 3. При исследовании корреляции между продолжительностью ИГКС-терапии и частотой возникновения ВП установлена сильная положительная корреляционная связь (rxy=0,98; р <0,001). Введение в курс базисного лечения БА направленной антибактериальной терапии (макролидов) позволило значительно улучшить состояние пациентов: устранить интоксикацию, уменьшить проявления респираторного синдрома.
Данные анализа, проведенного у обследуемых пациентов, позволили констатировать статистически значимое (р <0,001) преобладание частоты ВП у детей с БА, получавших ИГКС более 2 лет, в сравнении с больными, имевшими впервые диагностированную БА и находившимися в начале курса стероидной терапии.
У 19 больных с БА (48,7%) и ВП, имеющих проявления МПФ (100%), ЭПФ (100%) и НКФ, у 6 детей (27,3%) со среднетяжелым (59,1%) и легким персистирущим течением (27,1%) БА появились впервые установленные признаки формирования легочной гипертензии. У 12 (63,1%) пациентов из 2-й и 3-й групп с БА и МПФ и ЭПФ и у 3 детей (13,6%) из группы с НКФ (2-й исследуемой группы), имеющих признаки легочной гипертензии во время обострений БА, спровоцированными ВП, отмечались клинические и рентгенологические симптомы формирования интерстициального пневмофиброза. У 3 детей (25%) с признаками формирования легочной гипертензии и пневмофиброза (2 ребенка с МПФ, 1 – с ЭПФ) на обзорной рентгенограмме органов грудной клетки были выявлены легочные буллы, на КТГ – легочные буллы и бронхоэктазы, не наблюдавшиеся на предшествующих снимках (в начале наблюдения – 3 и более лет назад).
ЗАКЛЮЧЕНИЕ
- В исследовании выявлена сильная положительная корреляционная связь у детей с БА и ДСТ между получением средних и средневысоких доз ИКС сроком более 2 лет и возникновением ВП.
- Этиология ВП представлена микоплазменной, цитомегаловирусной инфекцией, а также сочетанием возбудителей, что требует расширения терапевтической помощи детям с БА и назначением направленной антибактериальной терапии.
- Установлено более тяжелое течение БА у детей с ДСТ и ВП: большая длительность бронхообструктивного эпизода на фоне интоксикации, формирование осложнений.
- Формирование осложнений (легочной гипертензии, пневмофиброза, легочных булл, бронхоэктазов) отмечалось у всех детей с БА, ВП и марфаноподобным и элерсоподобным фенотипом ДСТ; у 27,3% пациентов с неклассифицированным фенотипом наблюдалось возникновение легочной гипертензии.
- Для совершенствования диагностики, лечения и предупреждения развития осложнений БА у детей с ДСТ, длительно (более 2 лет) получающих средние и средневысокие дозы ИГКС, необходимо мониторирование состояния, тщательное обследование пациентов для исключения осложнений. При выявлении ВП показано назначение антибактериальной терапии.



