В патогенезе большинства сердечно-сосудистых заболеваний (ССЗ) лежит атеротромбоз. Тромбообразование – основная причина острых и хронических заболеваний сердечно-сосудистой системы в зависимости от локализации атеромы и размеров тромба. В основе формирования тромба на поверхности поврежденной атеросклеротической бляшки лежит активация тромбоцитов и каскада коагуляции, которые происходят параллельно [1]. Атеротромбоз – не только генерализованное, но и постоянно прогрессирующее заболевание, следовательно, назначение препаратов, ингибирующих функцию тромбоцитов и каскад коагуляции, считается обоснованными как для профилактики, так и лечения всех проявлений атеротромбоза (рис. 1).
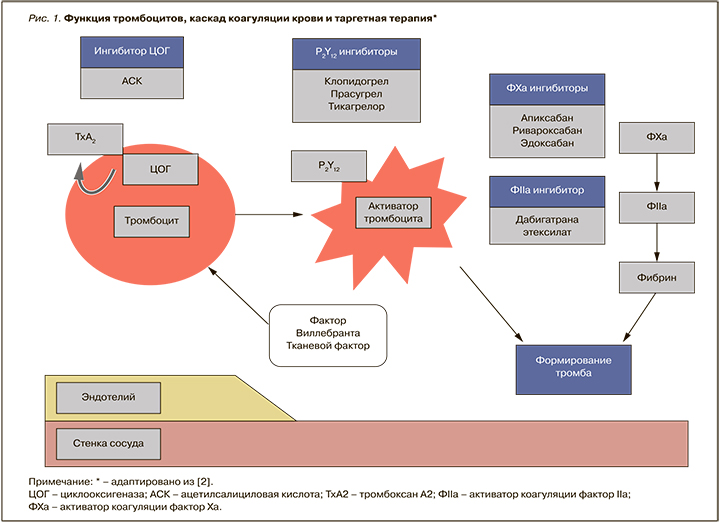
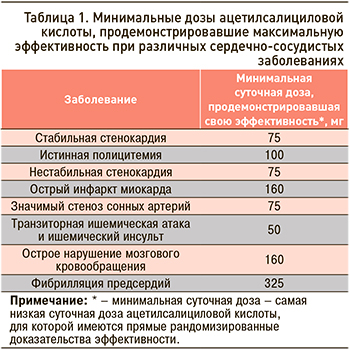 Ацетилсалициловая кислота (АСК) рассматривается как одно из эффективных антитромботических лекарственных средств: механизм ее действия сводится к необратимому ингибированию в основном циклооксигеназы (ЦОГ) тромбоцитов, вследствие чего уменьшается синтез тромбоксана А2 – индуктора агрегации тромбоцитов и вазоконстриктора [1]. Блокада синтеза тромбоксана А2 возможна малыми дозами АСК и сохраняется протяжении жизни тромбоцитов в течение 7–10 дней. АСК ингибирует обе изоформы ЦОГ (ЦОГ-1 и ЦОГ-2), однако ее активность в отношении ЦОГ-1 в 50–100 раз выше из-за более высокой чувствительности этого изомера к препарату. Эффективность АСК в профилактике сердечно-сосудистых событий показана для широкого диапазона доз, однако оптимальный антитромботический эффект отмечается при использовании 50–100 мг/сут. В таблице 1 приведены минимально эффективные дозы АСК при различных ССЗ [3].
Ацетилсалициловая кислота (АСК) рассматривается как одно из эффективных антитромботических лекарственных средств: механизм ее действия сводится к необратимому ингибированию в основном циклооксигеназы (ЦОГ) тромбоцитов, вследствие чего уменьшается синтез тромбоксана А2 – индуктора агрегации тромбоцитов и вазоконстриктора [1]. Блокада синтеза тромбоксана А2 возможна малыми дозами АСК и сохраняется протяжении жизни тромбоцитов в течение 7–10 дней. АСК ингибирует обе изоформы ЦОГ (ЦОГ-1 и ЦОГ-2), однако ее активность в отношении ЦОГ-1 в 50–100 раз выше из-за более высокой чувствительности этого изомера к препарату. Эффективность АСК в профилактике сердечно-сосудистых событий показана для широкого диапазона доз, однако оптимальный антитромботический эффект отмечается при использовании 50–100 мг/сут. В таблице 1 приведены минимально эффективные дозы АСК при различных ССЗ [3].
В свете обновленных клинических рекомендаций по вторичной профилактике сердечно-сосудистых событий используемый диапазон доз АСК составляет 75–100 мг. На российском фармацевтическом рынке на долю препаратов АСК в дозе 100 мг приходится 34,2%, в дозе 75 мг – 21,1% [4]. В настоящее время не существует доказательств, что в рекомендуемом диапазоне низких доз та или иная дозировка АСК имеет преимущество по эффективности и безопасности [5]. Нет и данных о взаимосвязи между эффективностью АСК и хронотерапией, в связи с чем этот антиагрегант рекомендуется 1 раз/сут либо утром, либо вечером.
ИСТОРИЯ ОТКРЫТИЯ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ
Папирус Эберса, содержащий 110 страниц, считается наиболее полным медицинским папирусом из когда-либо найденных. Он датируется XVI в. до н.э. и включает около 700 наименований лекарств. Наиболее важными видами растений, упоминаемыми в этом древнем сборнике, являются tjeret или salix, известные сегодня как растения рода ива [6]. Папирус Эберса описывает кору этого «вездесущего» дерева, которое росло в большинстве частей доисторического мира, как тонизирующее снадобье общего назначения или как противовоспалительное/обезболивающее средство при неспецифических болях. По сути, его можно считать своего рода древним предшественником АСК.
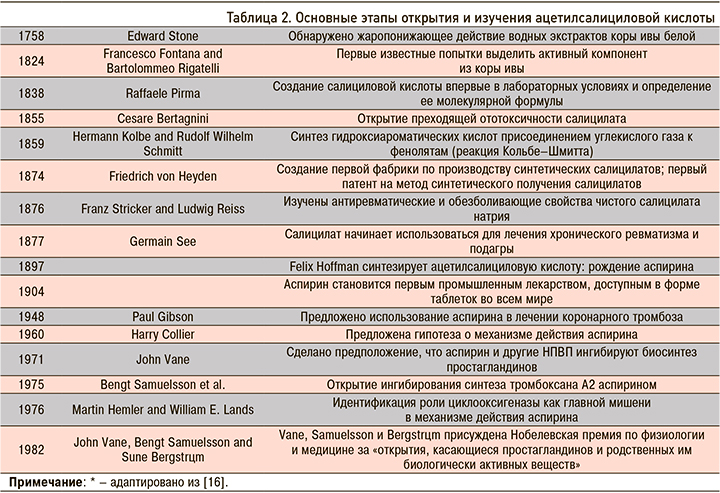
Основные этапы открытия самой АСК представлены в таблице 2. Несмотря на то что это лекарственное средство было предложено для лечения коронарного тромбоза еще в 1948 г., первое рандомизированное контролируемое исследование (РКИ) по оценке его эффективности при инфаркте миокарда (ИМ) было проведено лишь спустя 26 лет [44]. В 1980 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило применение АСК после инсульта, в 1985 г. – после ИМ, в 1996 г. – для профилактики ИМ.
Исходя из основного механизма действия АСК, первые крупномасштабные РКИ, посвященные оценки ее положительного влияния на сердечно-сосудистую систему, проводились в контексте вторичной профилактики кардиоваскулярных событий. В настоящее время с позиции доказательной медицины получены убедительные данные в пользу целесообразности приема низких доз АСК для вторичной профилактики; они рекомендованы всеми основными руководствами, обновленными за последние несколько лет [7–15].
АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА И ВТОРИЧНАЯ ПРОФИЛАКТИКА ИНСУЛЬТА
Ишемический инсульт, на долю которого приходится до 80% всех видов острого нарушения мозгового кровообращения, считается одной из ведущих причин смертности. При этом среди выживших больных у 2/3 сохраняются остаточные признаки нарушения мозгового кровообращения, и только 8% из них возвращаются к своей профессиональной деятельности [17, 18].
Лечение пациентов с транзиторными ишемическими атаками (ТИА) и ишемическим инсультом включает два основных направления: базисную и дифференцированную терапию. Прием антиагрегантных препаратов относится к дифференцированной терапии и рекомендуется с целью вторичной профилактики сосудистых осложнений. В исследовании CCSG (Canadian Cooperative Study Group) было установлено, что у мужчин с инсультом, которые в течение 26 мес получали АСК, имело место снижение относительного риска (ОР) инсульта или смерти на 31% (р <0,05) [19]. Позже данные метаанализа РКИ по профилактике смертности, ИМ и инсульта у пациентов высокого риска опровергли влияние гендерной принадлежности на эффективность АСК [20]. Сегодня АСК присутствует во всех клинических рекомендациях по лечению и вторичной профилактике ишемического инсульта [12, 17, 18].
Среди ключевых тезисов, отражающих место АСК в лечении ишемического инсульта и ТИА у взрослых в острейшем периоде, можно выделить следующие [18]:
- • рекомендуется прием АСК в дозе 325 мг в течение от 24 до 48 ч острейшего периода ишемического инсульта;
- • не следует отдавать преимущество назначению клопидогрела в острейшем периоде ишемического инсульта;
- • не рекомендуется заменять внутривенный тромболизис назначением АСК;
- • не рекомендуется назначение АСК или других антиагрегантов в качестве сопутствующей терапии в течение 24 ч после проведения внутривенного тромболизиса.
После острого нарушения мозгового кровообращения риск развития повторных инсультов повышен почти в 10 раз и составляет около 25–30%. Угроза повторного инсульта наиболее высока в первые несколько недель от его развития, ТИА – в течение первых трех дней. В связи с этим вторичная профилактика должна быть начата как можно раньше: сразу после диагностики ТИА и не позднее 48 ч после развития ишемического инсульта. Индивидуализированная вторичная профилактика инсульта уменьшает риск развития повторного нарушения мозгового кровообращения на 20–30% [18].
В профилактике раннего (в первые 14 дней) повторного ишемического инсульта АСК более эффективна у пациентов с легким (OР 0,5; 95% доверительный интервал (ДИ) 0,34–0,75) или умеренным (ОР 0,65; 95% ДИ 0,44–0,98) неврологическим дефицитом, чем при тяжелых неврологических расстройствах (OР 1,10; 95% ДИ 0,77–1,58) [21]. В соответствии с результатами 12 исследований по вторичной профилактике инсульта АСК снижает 12-недельный ОР любого инсульта на 49% (95% ДИ 0,40–0,60), инвалидизирующего или смертельного ишемического инсульта – на 34% (95% ДИ 0,25–0,46), острого ИМ – на 30% (95% ДИ 0,17–0,52) [22].
При сравнении с клопидогрелом у больных ишемическим инсультом эффективность АСК в профилактике больших сердечно-сосудистых событий была выше [23]. В течение одного года наблюдения в группе АСК было зарегистрировано на 15,7% меньше кардиоваскулярных событий. При этом субанализ основных компонентов сердечно-сосудистых событий показал, что прием клопидогрела ассоциирован с более высоким риском повторного инсульта (OР 1,43; 95% ДИ 1,06–1,92; p=0,02) и острого ИМ (OР 3,72; 95% ДИ 1,04–13,3; p=0,04) при отсутствии достоверных различий по риску смерти. По данным более ранней публикации [24], уровень смертности был значительно выше в группе клопидогрела (5,62%) по сравнению с АСК (4,69%; ОР 1,30; 95% ДИ 1,07–1,58; р=0,008). Эти данные нашли свое отражение в текущих рекомендациях по вторичной профилактике инсульта.
Согласно клиническим рекомендациям по вторичной профилактике ТИА и ишемического инсульта, при подтвержденной ТИА необходимо немедленно назначить АСК или клопидогрел в нагрузочной дозе 300 мг с последующим переходом на 75 мг длительно. При некардиоэмболическом инсульте (атеротромботическом, лакунарном и инсульте с неясной причиной) рекомендуются АСК или клопидогрел, при кардиоэмболическом инсульте – непрямые антикоагулянты. Если при кардиоэмболическом инсульте невозможен или противопоказан прием непрямых антикоагулянтов, следует использовать антитромбоцитарные средства [18].
Клопидогрел и дипиридамол не имеют явных преимуществ перед АСК. Выявлено небольшое превосходство клопидогрела над АСК у больных с сахарным диабетом, клиническими проявлениями атеросклероза в разных сосудистых бассейнах. Назначение дипиридамола целесообразно при непереносимости АСК или клопидогрела или резистентности к этим препаратам. Комбинация клопидогрела с АСК не рекомендуется в рутинной практике, так как ее применение сопровождается существенным увеличением геморрагических осложнений [18]. По результатам популяционных исследований, частота встречаемости инсульта, требующего приема в составе терапии АСК, составляет около 68%. С учетом этих особенностей важно своевременное включение в терапию АСК в рекомендуемых дозировках [18].
АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА И ВТОРИЧНАЯ ПРОФИЛАКТИКА ОСТРЫХ КОРОНАРНЫХ СИНДРОМОВ
Если принять во внимание механизм действия АСК и патогенез развития острого коронарного синдрома (ОКС), то неудивительно, что этот препарат стал краеугольным камнем в экстренной терапии больных с ишемией миокарда. Исследование ISIS-2 (Second International Study of Infarct Survival) отчетливо продемонстрировало эффективность АСК после острого ИМ [25]. Согласно полученным результатам, назначение АСК в течение 24 ч в виде монотерапии или в комбинации с фибринолитиком способствует снижению абсолютного риска нефатального повторного ИМ на 2,4% (снижение ОР на 23%) и 5,2% (снижение ОР на 42%) соответственно. Эти данные легли в основу клинических рекомендаций по тактике ведения больных с ОКС, которые поддерживаются и текущими гайдлайнами. В соответствии с обновленными рекомендациями по ведению пациентов с острым инфарктом миокарда с подъемом сегмента ST (ИМпST), для снижения риска смерти, сосудистой смерти, рецидива/повторного ИМ всем пациентам при отсутствии противопоказаний рекомендуется прием АСК до начала реперфузионного вмешательства или вместо него, если последнее не проводится по каким-либо причинам [9, 14]. Если пациент в предшествующую неделю регулярно не принимал АСК, то ему рекомендована нагрузочная доза 150–325 мг, в последующем – постоянная поддерживающая доза 75–100 мг 1 раз/сут длительно.
Назначение АСК с целью вторичной профилактики сердечно-сосудистых событий оправдано и у пациентов с ИМ без стойкого подъема сегмента ST (ИМбпST) [15]. При нестабильной стенокардии/ИМбпST результаты различных исследований продемонстрировали ее эффективность в снижении на 50% ОР смерти или рецидива ИМ [26–29]. С этих пор окончательно установлена роль АСК во вторичной профилактике окклюзионных сосудистых заболеваний. При ИМбпST терапия этим препаратом аналогична тактике ведения больных с ИМпST [11, 15].
Если вскоре после ОКС возникает необходимость несердечного хирургического вмешательства, то следует отменить ингибитор P2Y12-рецептора и продолжить по мере возможности терапию АСК с целью уменьшения риска тромбоза стента для коронарных артерий. Таким образом, при ОКС длительный прием АСК рекомендуется всем пациентам, не имеющим противопоказаний. Вне зависимости от стратегии лечения АСК остается первым и обязательным компонентом длительной антитромбоцитарной терапии при синусовом ритме.
ОСОБЕННОСТИ ПРИЕМА АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ ПРИ ОСТРОМ КОРОНАРНОМ СИНДРОМЕ В СОСТАВЕ ТРОЙНОЙ АНТИТРОМБОТИЧЕСКОЙ ТЕРАПИИ У ПАЦИЕНТОВ, НУЖДАЮЩИХСЯ В ДЛИТЕЛЬНОМ ПРИЕМЕ ПЕРОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ
У пациентов с ИМпST, подвергнутых коронарному стентированию для уменьшения риска геморрагических осложнений, тройную антитромботическую терапию рекомендуют ограничить несколькими днями (1–7 дней), при выписке из стационара АСК обычно отменяется. Данные о возможности ранней отмены АСК получены в серии РКИ, в которых было показано снижение риска кровотечений при использовании двойной антитромбоцитарной терапии по сравнению с тройной. Но вместе с тем информация о безопасности раннего перехода на двойную антитромботическую терапию у всех пациентов с ОКС, а также имеющих более высокий риск коронарных и кардиоэмболических осложнений, довольно ограниченна [14].
У пациентов с ИМбпST, подвергнутых стентированию коронарных артерий, рекомендуется сочетание перорального антикоагулянта с АСК и клопидогрелом длительностью от 1 до 3 мес с последующей отменой или АСК или клопидогрела. Двойная антитромботическая терапия продолжается до 12 мес с дальнейшей отменой антитромбоцитарного препарата.
Продолжительность тройной антитромботической терапии определяется риском кровотечений и коронарных осложнений. Тройная антитромботическая терапия до 3 мес возможна при низкой вероятности кровотечений и высоком риске коронарных осложнений. У пациентов с низким риском кровотечений и сохраняющимся высоким риском коронарных осложнений возможно продление двойной антитромботической терапии более чем на 12 мес. В случаях же, когда риск коронарных осложнений ниже, чем опасность кровотечений, для снижения угрозы последних, напротив, рекомендуется ранний переход (обычно при выписке из стационара) на двойную антитромботическую терапию антикоагулянт + клопидогрел. Данные о безопасности раннего перехода на двойную антитромботическую терапию у пациентов с ОКСбпST ограниченны [15]. У больных с ОКСбпST, которым не выполнялось стентирование коронарной артерии, рекомендуется двойная антитромботическая терапия (антикоагулянт + АСК или клопидогрел), а вот тройная антитромботическая терапия дольше первой недели от начала лечения из-за высокой вероятности кровотечений не рекомендуется [15].
АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА ПРИ СТАБИЛЬНОЙ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Стабильная ишемическая болезнь сердца (ИБС) имеет сравнительно доброкачественное течение на протяжении многих лет. Несмотря на это, лечение АСК в низких дозах приносит существенную пользу при этом заболевании, что было показано в метаанализе ATT (Antithrombotic Trialists) [30]. В него были включены 16 исследований по вторичной профилактике сердечно-сосудистых событий (17 000 человек, 43 000 человеко-лет, 3306 серьезных сосудистых событий), в которых сравнивались эффекты долгосрочного приема АСК с контрольной группой. Добавление к лечению АСК привело к абсолютному снижению серьезных кардиоваскулярных событий (6,7% в группе АСК против 8,2% в контрольной группе в год; p <0,0001), инсульта (2,08 против 2,54% соответственно; р=0,002) и коронарных событий (4,3 против 5,3% соответственно; р <0,001). Снижение совокупности всех серьезных сосудистых событий не зависело от пола. В настоящее время эти результаты находят свое отражение в обновленных рекомендациях по лечению стабильной ИБС [13].
При отсутствии противопоказаний АСК должна быть назначена всем больным со стабильной ИБС, поскольку остается самым распространенным и доступным ингибитором агрегации тромбоцитов [13]. Применение других препаратов этой группы (клопидогрела, прасугрела и тикагрелора) следует рассматривать только при непереносимости АСК, поскольку нет данных, продемонстрировавших их преимущества перед аспирином.
В соответствии с клиническими рекомендациями Российского кардиологического общества [13] при стабильной ИБС всем больным показано длительная терапия АСК в дозе 75–100 мг/сут. Кроме того, терапия АСК в этом диапазоне доз показана всем пациентам в следующих ситуациях:
- • при поражении коронарных артерий по данным визуализирующих методов независимо от клиники;
- • во время чрескожных коронарных вмешательств (ЧКВ) или после проведения коронароангиографии, если возможность ЧКВ очевидна для профилактики раннего тромбоза стентов коронарных артерий;
- • после планового ЧКВ в составе двойной антитромбоцитарной терапии при синусовом ритме.
При стабильной ИБС и фибрилляции предсердий (ФП) для выбора оптимальной антитромбоцитарной терапии необходимо учитывать риск кровотечений, возможность проведения планового ЧКВ и вероятность тромбоза стента для коронарных артерий. У этой категории пациентов место АСК определяется индивидуально в зависимости от клинической ситуации [13]. Так, у больных со стабильной ИБС и ФП при наличии в анамнезе ИМ рекомендуется прием АСК в дозе 75–100 мг/ сут вместе с оральным антикоагулянтом (ОАК) в отсутствие повышенного риска жизнеугрожающих кровотечений.
После планового ЧКВ у больных с ФП оптимальный режим антитромботической терапии и место в нем АСК определяется риском кровотечений (рис. 2) [13]. Риск кровотечения напрямую зависит от агрессивности антитромботической терапии (двойная или тройная терапия). По данным Pasea L. et al. [31], тройная антитромбоцитарная терапия повышает риск любого кровотечения в среднем в 3,4 раза по сравнению с отсутствием такого лечения. С 1998 г. частота кровотечений увеличилась вдвое: ими страдает каждый четвертый пациент с ССЗ, и, по мнению авторов, требуются немалые усилия для борьбы с этой ятрогенной эпидемией.

АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА ПРИ ЗАБОЛЕВАНИЯХ ПЕРИФЕРИЧЕСКИХ АРТЕРИЙ
Пациенты, имеющие монофокальный атеросклероз, подвержены риску фатальных и нефатальных сердечно-сосудистых событий. Помимо риска цереброваскулярных осложнений, пациенты с коронарной болезнью сердца (КБС) также подвержены риску ИМ и смерти [32]. В систематизированном обзоре 17 исследований (11 391 пациент с бессимптомным стенозом сонной артерии >50%), 63% смертей были связаны с ССЗ (средняя смертность от 2,9% в год) [33]. Многие исследования показали повышенный риск общей смертности, сердечно-сосудистой смертности и заболеваемости (ИМ, инсульт) у пациентов с симптомными или бессимптомными заболеваниями артерий нижних конечностей (ЗАНК), даже после коррекции факторов риска [34]. Эти данные указывают на необходимость адекватного ведения пациентов с атеросклерозом сосудов различной локализации. Антиагрегантные препараты в основном используются с целью вторичной профилактики сердечно-сосудистых событий.
Согласно обновленным рекомендациям ЕОК/ЕОСХ по диагностике и лечению заболеваний периферических артерий 2017 г., длительный постоянный прием АСК в дозе 75–100 мг/сут является частью оптимальной медикаментозной терапии при стенозе сонных артерий более 50% независимо от симптомов или после оперативного лечения стеноза [13]. Клопидогрел служит альтернативным препаратом для пациентов с непереносимостью АСК. После стентирования сонной артерии АСК рекомендуется в составе двойной антитромбоцитарной терапии (АСК 75–100 мг/сут + клопидогрел 75 мг/сут) как минимум в течение 1 мес с последующим переходом на монотерапию АСК или клопидогрелом.
В соответствии с теми же рекомендациями ЕОК/ЕОСХ [13] при бессимптомном течении заболеваний артерий нижних конечностей (ЗАНК) антитромбоцитарная терапия не показана. Монотерапия АСК в дозе 75–100 мг/сут или клопидогрелом 75 мг/сут в течение длительного времени рекомендуется при наличии симптомов поражения артерии нижних конечностей или после хирургической реваскуляризации. После чрескожной реваскуляризации артерий нижних конечностей АСК 75–100 мг/сут назначается в составе двойной антитромбоцитарной терапии вместе с клопидогрелом 75 мг/сут в течение как минимум 1 мес независимо от типа стента, с последующим переходом на монотерапию АСК или клопидогрелом. При ЗАНК, требующих проведения длительной терапии ОАК, АСК в дозе 75–100 мг/ сут показана вместе с ОАК после ЧКВ при низком риске кровотечений. Во всех остальных случаях рекомендуется монотерапия ОАК.
КАКОВЫ ПОСЛЕДСТВИЯ ПРЕКРАЩЕНИЯ ПРИЕМА АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ?
Показано, что 10–20% пациентов с недавно перенесенным ИМ прекращают прием АСК в течение первых 3 лет наблюдения [35–38]. Лечение прерывают около 30%, а плохая приверженность к АСК отмечается у 50% пациентов [39]. Вместе с тем прекращение приема АСК при вторичной профилактике связано с более высоким риском сердечно-сосудистых событий, особенно вскоре после ее отмены [40–43] из-за хирургического вмешательства [42–44] или кровотечения [43], поскольку эти состояния сами по себе стимулируют агрегацию тромбоцитов и увеличивают риск кардиоваскулярных событий. Последствия прекращения приема АСК при отсутствии серьезных кровотечений или необходимости хирургического вмешательства мало изучены и неизвестны, хотя его влияние на последующее течение заболевания может быть значительным.
В шведском общенациональном популяционном когортном исследовании впервые изучалось влияние коротких пропусков или длительного прекращения приема низких доз АСК на риск сердечно-сосудистых событий [45]. В исследование были включены 601 527 пациентов, принимавших низкие дозы АСК в период с 2005 по 2009 г. С целью первичной профилактики ее принимали 46%, вторичной – 54%; средний возраст пациентов составил 72,6±11,4 года. Больные с онкологическими заболеваниями и приверженностью к лечению <80% в исследование не включались. Средняя продолжительность наблюдения составила 3,0 года, за это время произошло 62 690 сердечно-сосудистых событий. Самую низкую частоту таких событий имели пациенты, регулярно принимавшие АСК, тогда как отказ от ее приема ассоциировался с увеличением ОР кардиоваскулярных событий на 30% (95% ДИ 1,34–1,41), что соответствует увеличению абсолютного риска событий на 13,5 на 1000 человеко-лет. Другими словами, в среднем 1 из 74 пациентов, прекративших лечение АСК, имел дополнительное сердечно-сосудистое событие через 1 год. Риск возрастал вскоре после прекращения приема препарата и не уменьшался со временем.
 Прекращение приема АСК при вторичной профилактике ассоциировалось с увеличением ОР сердечно-сосудистых событий на 46% (ДИ 1,41–1,51), абсолютный риск при этом составил 28 событий на 1000 человеко-лет (в течение года дополнительное кардиоваскулярное событие отмечалось у 1 из 36 пациентов, прекративших терапию АСК). По данным исследования, максимально уязвимым периодом является ранний этап прекращения приема препарата, на который приходится наибольшее количество кардиоваскулярных событий (рис. 3). После отмены АСК более высокий риск таких событий имеют пожилые пациенты. По мнению авторов, данное исследование позволяет ответить на два очень важных вопроса.
Прекращение приема АСК при вторичной профилактике ассоциировалось с увеличением ОР сердечно-сосудистых событий на 46% (ДИ 1,41–1,51), абсолютный риск при этом составил 28 событий на 1000 человеко-лет (в течение года дополнительное кардиоваскулярное событие отмечалось у 1 из 36 пациентов, прекративших терапию АСК). По данным исследования, максимально уязвимым периодом является ранний этап прекращения приема препарата, на который приходится наибольшее количество кардиоваскулярных событий (рис. 3). После отмены АСК более высокий риск таких событий имеют пожилые пациенты. По мнению авторов, данное исследование позволяет ответить на два очень важных вопроса.
• Вопрос №1: что нового мы узнали о последствиях отмены АСК?
Ответ: прекращение лечения низкими дозами АСК может быть опасным!
• Вопрос №2: какие практические рекомендации можно сделать по результатам этого исследования?
Ответ: во-первых, во всем мире миллионы больных ежедневно принимают АСК и в любой момент могут прекратить терапию, поэтому приверженность к лечению низкими дозами этого препарата при отсутствии абсолютных противопоказаний должна оставаться важной целью лечения. Во-вторых, данное исследование может помочь врачам и пациентам принять осознанное решение о прекращении приема АСК.
ВЫБОР НИЗКОДОЗОВОЙ ФОРМЫ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ: ПРИОРИТЕТЫ НА ФАРМРЫНКЕ И В КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ
На российском фармрынке низкодозовая АСК в основном представлена в 6 различных лекарственных формах, которые по своим характеристикам значительно отличаются друг от друга. Как отмечают Рафальский В.В. с соавт. [4], в подавляющем большинстве стран низкодозовая АСК чаще производится в кишечнорастворимых таблетках. В Северной Америке в такой форме выпускается 96,8% препаратов низкодозовой АСК, в Европе и Австралии этот показатель достигает более 70%. При этом на долю низкодозовой АСК, содержащей нерастворимые антациды (гидроксид магния), приходится не более 1,6% [4]. По данным этих авторов, на российском фармацевтическом рынке ситуация абсолютно иная. Так, на долю зарегистрированных препаратов АСК в комбинации с нерастворимым антацидом в дозе 15–30 мг приходится до 15,4%. Интересный факт: в России, на Украине и в Армении в официальных инструкциях низкие дозы магния гидроксида заявлены в качестве активного действующего вещества, тогда в зарубежных государствах, включая Данию, этот антацидный компонент заявлен как фармакологически неактивное вещество.
Известно, что небольшие дозы антацидов не влияют на кислотность желудочного содержимого, а нерастворимые антациды не являются источником ионов магния. В связи с этим для гастропротекции рекомендуются ингибиторы протонной помпы, в том числе пациентам, принимающим АСК в комбинации с гидроксидом магния. Из этого следует, что АСК в комбинации с нерастворимым антацидом не имеет никаких преимуществ перед таблетками, не покрытыми оболочкой, или же перед таблетками в оболочке, не изменяющей фармакокинетику АСК.
Появление столь большого разнообразия форм АСК связано с тем, что риск возникновения НПВП-гастропатии связывали не только с дозой, но и с формой препарата и способом его введения. Однако достаточно высокий риск развития НПВП-гастропатий сохраняется независимо от формы и способа введения препарата [46]. И это логично, поскольку механизмы развития, как и факторы риска НПВП-гастропатий, очень многообразны. Угнетение активности ЦОГ-1 вызывает нарушение синтеза простагландинов в слизистой оболочке желудка и функции тромбоцитов, способствующих высокой частоте желудочно-кишечных кровотечений [46]. Эти механизмы, еще раз подчеркнем, универсальны вне независимости от формы низкодозовой АСК.
В то же время при приеме АСК в кишечнорастворимой оболочке мы можем исключить дополнительную предпосылку повышения риска развития гастропатий – прямое раздражающее действие лекарственного средства на слизистые оболочки желудка и двенадцатиперстной кишки. В такой лекарственной форме выпускается препарат Тромбо АСС – АСК, покрытая пленочной оболочкой, которая растворяется только в кишечнике, обеспечивая максимальную защиту слизистой желудка и двенадцатиперстной кишки от раздражающего действия кислоты. Добавим, что фармакоэкономическая оценка применения Тромбо АСС для вторичной профилактики показала, что схема лечения с использованием этого препарата характеризуется меньшими затратами по сравнению с Кардиомагнилом и Аспирином Кардио. Полученные результаты также свидетельствуют, что терапия препаратом Тромбо АСС приводит к экономии бюджетных средств до 33 млн руб. в расчете на всех больных, страдающих сердечно-сосудистыми заболеваниями в г. Москве, по сравнению с применением сравниваемых альтернатив [47].
Для вторичной профилактики сердечно-сосудистых событий выбор низкодозовой АСК важно делать с учетом опубликованных клинических исследований по использованию конкретной формы препарата. Разные лекарственные формы АСК, различающиеся по фармакокинетике и воздействию на слизистую желудочно-кишечного тракта, могут по-разному влиять на основные кардиоваскулярные события, так как эффекты препарата сильно зависят от его дозы. В основных исследованиях, продемонстрировавших клиническую пользу от приема АСК, использовалась ее кишечнорастворимая форма, тогда как не существует опубликованных клинических испытаний, в которых оценивались доказательства эффективности по предупреждению сердечно-сосудистых событий препаратами АСК, содержащими нерастворимые антациды [4].
Таким образом, Тромбо АСС – это низкодозовая кишечнорастворимая форма АСК, которая продемонстрировала свою эффективность в основных клинических исследованиях. Назначение Тромбо АСС не только минимизирует неблагоприятное влияние АСК на слизистую желудка и двенадцатиперстной кишки, но и способствует экономии бюджетных средств при вторичной профилактике сердечно-сосудистых событий.



