ВВЕДЕНИЕ
Несмотря на значительные успехи в лечении артериальной гипертонии (АГ) и ишемической болезни сердца (ИБС), смертность от этих нозологий остается высокой [1]. Так, в Европе ежегодно умирает более 4 млн человек от сердечно-сосудистых заболеваний (ССЗ), при этом на долю ИБС приходится 45% смертей [2].
По международным данным, в период с 1993 до 2013 г. распространенность ИБС возросла на 65% [3]. В соответствии с результатами многоцентрового исследования ЭССЕ-РФ (эпидемиология сердечно-сосудистых заболеваний в различных регионах Российской Федерации), встречаемость АГ в России составляет 44% [3].
В национальном регистре PINNACLE, в котором оценивалось качество лечения больных с ИБС, необходимую терапию из 4 классов лекарственных средств (ингибитор АПФ/блокатор рецепторов ангиотензина II, бета-блокатор, статин, антиагрегант) получало только 45% человек. Было доказано, что высокая приверженность к терапии обеспечивает улучшение прогноза [4].
Вопрос о прогностической значимости реваскуляризации миокарда у пациентов со стабильной ИБС исследуется уже достаточно давно. Большинство проведенных исследований (COURAGE, BARI 2D, ORBITA, ISCHEMIA) показало, что плановая реваскуляризация не снижает риск инфаркта миокарда (ИМ) и смерти. Полученные данные свидетельствуют о том, что механическое расширение сосуда не может решить проблему распространенного атеросклероза с периодическим усилением воспаления и разрывами капсулы [5–9].
Таким образом, перечисленные факты требуют проведения индивидуального и комплексного подхода к лечению пациентов с АГ в сочетании с ИБС.
Артериальная ригидность с основными факторами риска АГ и ИБС вносит серьезный вклад в развитие и прогрессирование этих заболеваний [10]. Ее принято оценивать с помощью скорости распространения пульсовой волны (СРПВ) и индекса аугментации (ИА) [11]. Многочисленные исследования, посвященные прогностическому значению СРПВ, показали, что этот показатель можно использовать как независимый фактор риска ССЗ и сердечно-сосудистых катастроф [12]. В связи с этим определение СРПВ было включено в рекомендации Европейского общества по гипертонии и Европейского кардиологического общества, выпущенные в 2018 г. СРПВ более 10 м/с принято считать субклиническим признаком поражения сосудов [13].
Один из важных модифицируемых факторов развития ССЗ – нехронологический (сосудистый) возраст человека. Исследование функционального состояния артериальной стенки является наиболее объективным параметром при оценке хронологического (биологического) возраста. Этот факт диктует необходимость изучения механизмов сосудистого старения для совершенствования терапевтических подходов к лечению пациентов и внедрения методики исследования в широкую клиническую практику [14].
Исследования, проводившиеся с определением лодыжечно-плечевого индекса (ЛПИ), продемонстрировали эффективность использования этого показателя для диагностики гемодинамически значимых заболеваний артерий нижних конечностей. Было установлено, что значение ЛПИ менее 0,9 служит независимым предиктором таких осложнений, как нестабильная стенокардия и нефатальный инфаркт. Специфичность метода определения ЛПИ в выявлении заболеваний периферических артерий достигает 95% [15].
Эндотелиальная дисфункция (ЭД) выступает главным механизмом в развитии атеросклероза при ИБС и в то же время может приводить к разрыву атеросклеротической бляшки через механизм увеличения напряжения сдвига и вазоконстрикции [12]. К основным проявлениям ЭД относятся снижение синтеза и усиление деградации оксида азота (NO), повышенная выработка эндотелием эндотелина-1 (ЭТ-1) и других вазоконстрикторных веществ. В ответ на это эндотелий начинает продуцировать вазоконстрикторы, агреганты и коагулянты. В связи с этим становится возможным запуск атеросклеротических процессов, развитие АГ, ИБС с осложнениями в виде инсульта, инфаркта миокарда [16].
Для современной кардиологии большое значение имеет ранняя диагностика процессов ремоделирования сердца артериальной стенки на стадии нарушения функции при АГ в сочетании с ИБС, когда патологические процессы обратимы и не приводят к развитию выраженных структурных изменений. Особенно важно выявлять ЭД, поскольку ее определение не включено в перечень обязательных методов исследования. При этом ЭД служит важнейшим субклиническим маркером ССЗ.
Согласно отечественным и международным рекомендациям по ведению пациентов с АГ в сочетании с ИБС, необходимо придерживаться строго контроля уровня артериального давления (АД). В европейских рекомендациях по лечению АГ (2018) у пациентов с АГ и ИБС моложе 65 лет необходимо достижение целевого уровня систолического АД (САД) в диапазоне 120–129 мм рт.ст. с учетом его хорошей переносимости, при этом снижение этого показателя менее 120 мм рт.ст. не рекомендовано. В свою очередь, больным старше 65 лет рекомендован целевой уровень СА.Д в диапазоне 130–139 мм рт.ст. Для всех больных с АГ целевой уровень диастолического АД (ДАД), независимо от наличия сопутствующей ИБС и возраста пациентов, должен составлять 70–79 мм рт.ст. [2, 17, 18].
В метаанализе 2016 г. было показано, что снижение САД на 10 мм рт.ст. уменьшает риск сердечно-сосудистых событий на 20%, ИБС – на 17%, мозгового инсульта – на 27%, сердечной недостаточности – на 28%, общей смертности – на 13% [5].
Любопытны результаты недавно завершившегося российского многоцентрового обсервационного исследования ТРИКОЛОР (Применение Тройной фиксиРованной комбинации в лечении артериальной гИпертензии – возможность эффеКтивного кОнтроЛя артериального давления при использовании кОмбинированной антигипертензивной теРапии), основной целью которого была оценка антигипертензивной эффективности тройной фиксированной комбинации амлодипин + индапамид + периндоприла аргинин, ее влияния на суточный профиль АД, переносимость и приверженность к терапии в условиях реальной клинической практики. Через 3 мес наблюдения у участников исследования отмечалось статистически значимое снижение среднего уровня САД и ДАД на 33,5 и 14,3 мм рт.ст. соответственно (р <0,001). Доля пациентов, достигших уровня АД <140/90 мм рт.ст. в течение указанного срока, достигла 93,4%. Также у пациентов, получавших фиксированную комбинацию амлодипин + индапамид + периндоприла аргинин, наблюдалось увеличение приверженности к лечению с 18,8 до 49,0% [19].
Целью нашего исследования стало cравнение влияния бисопролола и небиволола в сочетании с фиксированной комбинацией (амлодипин + периндоприл + индапамид) на клиническое течение АГ 2-й и 3-й степеней и ИБС II и III функциональных классов, функциональное состояние артериальной ригидности, эндотелия, ЛПИ, сосудистый возраст у соответствующих пациентов.
МАТЕРИАЛЫ И МЕТОДЫ
Выполнено открытое рандомизированное клиническое параллельное исследование 67 пациентов с неконтролируемой АГ с уровнем САД ≥160 мм рт.ст. и/или ДАД ≥90 мм рт.ст. (по данным измерения офисного АД или суточного мониторирования АД) в сочетании со стабильной стенокардией напряжения (ССН), принимавших на момент начала исследования два антигипертензивных препарата. В зависимости от проводимой терапии участники были разделены на две группы:
- I группа – 34 человека, получавших бета-блокатор бисопролол (Конкор®, «Мерк КГаА», Германия) по 5–10 мг/сут;
- II группа – 33 человека, принимавших бета-блокатор небиволол (Небилет®, «Берлин-Хеми», Германия) в дозе 5–10 мг/сут.
В качестве антигипертензивной терапии пациентам обеих групп была назначена тройная фиксированная комбинация амлодипин + индапамид + периндоприл (Трипликсам®, «Лаборатория Сервье», Франция). Дозировка подбиралась в соответствии с клинической ситуацией, стадией АГ и инструкцией по применению лекарственного средства. Пациенты обеих групп принимали антитромбоцитарные препараты и статин.
Средняя длительность АГ у участников исследования составила 13,7±7,2 лет, ИБС – 5,7±2,2 лет. Всем пациентам до включения в исследование и до назначения терапии проводили клинический осмотр, лабораторные и инструментальные исследования (электрокардиографию, эхокардиографию, объемную сфигмографию, компьютерную фотоплетизмографию).
Критериями включения служили лица обоего пола в возрасте от 40 до 79 лет, доказанная ИБС и неконтролируемая АГ с уровнем САД ≥ 160 мм рт. ст. и/или ДАД ≥90 мм рт.ст., подтвержденная на двух визитах.
В ходе исследования изучались результаты применения антигипертензивных препаратов у больных АГ в сочетании с ИБС с точки зрения влияния на структурно-функциональные свойства артерий и ЭД.
Диагноз АГ устанавливался по анамнестическим данным и результатам офисного измерения АД при трехкратном приеме врача. Определение степени АГ проводили согласно актуальным рекомендациям Российского кардиологического общества (РКО).
Диагноз ИБС устанавливался на основании следующих данных: стеноз более 50% коронарных артерий по данным коронароангиографии (КАГ); перенесенный в анамнезе документированный инфаркт миокарда; положительный результат неинвазивной нагрузочной пробы (тредмил-тест) на выявление коронарной ишемии; документированная госпитализация по поводу нестабильной стенокардии; реваскуляризационные вмешательства на двух и более коронарных артериях (более 3 мес назад).
Терапия пациентов с неконтролируемой АГ и ИБС выполнялась по клиническому протоколу диагностики и лечения заболеваний, характеризующихся повышенным кровяным давлением в соответствии с действующими рекомендациями РКО и европейскими рекомендациями.
Исследуемые показатели у этой категории лиц определялись дважды: при включении в исследование и спустя 12 нед проводимой терапии.
Включенные в исследование пациенты неадекватно лечились антигипертензивными препаратами любых других групп или не достигали целевых цифр АД. В связи с этим им в качестве антигипертензивной терапии назначили тройную фиксированную комбинацию амлодипина, индапамида и периндоприла в дозе 5/1,25/5 мг. В дальнейшем оценивалась эффективность терапии, при необходимости дозу увеличивали до максимальной.
К критериям исключения относились тяжелые ССЗ (острый инфаркт миокарда и инсульт в течение 6 мес, нестабильная стенокардия, сердечная недостаточность III–IV функциональных классов (по NYHA), фракция выброса <40%, сложные нарушения ритма и проводимости сердца, симптоматическая АГ, тяжелые клапанные пороки, выраженный атеросклероз сосудов нижних конечностей); тяжелая сопутствующая патология; непереносимость или противопоказания к амлодипину, периндоприлу, индапамиду, бисопрололу и небивололу; беременность и кормление грудью.
Все пациенты проходили общеклиническое обследование. Все исследования выполнялись дважды – исходно и через 12 нед терапии.
Пациентам всех групп проводилась объемная сфигмография с помощью прибора BPLab («Петр Телегин», Россия) с технологией Vasotens для оценки ремоделирования сосудистой стенки до и после начала терапии. Осуществлялось измерение следующих офисных параметров артериальной ригидности:
- САД (мм рт.ст.);
- ДАД (мм рт.ст.);
- среднее САД (срСАД, мм рт.ст.);
- пульсовое давление (ПАД, мм рт.ст.);
- скорость распространения пульсовой волны (СРПВ) в аорте (м/с);
- индекс аугментации (Aix, %);
- максимальная скорость нарастания АД в плечевой артерии (dP/dt, мм рт.ст.);
- ЛПИ;
- центральное САД в аорте (мм рт.ст.);
- центральное ДАД в аорте (мм рт.ст.);
- среднее ДАД в аорте (мм рт.ст.);
- ПАД в аорте (мм рт.ст.);
- частота сердечных сокращений (ЧСС, уд./мин);
- сосудистый возраст (годы).
Для оценки функции эндотелия делалась проба с реактивной гиперемией с использованием компьютерной фотоплетизмографии (ФПГ) при помощи аппарата «Элдар» ЗАО «Инженерно-медицинский центр» («Новые приборы», Россия) с программным обеспечением Eldar-Endo.
Величина показателя функции эндотелия (ПФЭ) может варьироваться в пределах от -10 до +50%. При ПФЭ более 20% считается, что функция эндотелия сохранена. Если данный показатель составляет менее 20%, но более 10%, то функция эндотелия снижена, отрицательные значения ПФЭ свидетельствуют о выраженной ЭД.
Измерение офисных значений АД, ЧСС, оценку нежелательных явлений проводили на ежемесячном амбулаторном визите.
Лечение в рамках исследования осуществляли без отмывочного периода с сохранением полного объема ранее назначенной терапии.
Статистическая обработка результатов осуществлялась с помощью пакета прикладных программ Microsoft Excel и Statistica 10.0. Рассчитывались средние арифметические и среднеквадратичные отклонения исследуемых величин и ошибки репрезентативности. Нормальное распределение полученных данных представлялось в виде M±m, где М – средняя арифметическая исследуемых величин, m – ошибка репрезентативности. Разницу показателей в группах оценивали по t-критерию Стьюдента. Критическим считался уровень значимости различия р <0,05.
РЕЗУЛЬТАТЫ
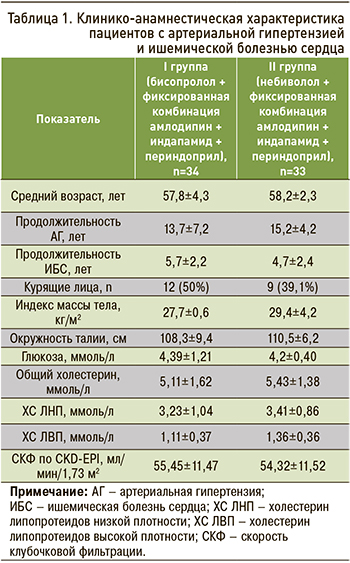
Клиническая характеристика пациентов, включенных в исследование, представлена в таблице 1. Исследуемые группы были сопоставимы по полу, возрасту, антропометрическим характеристикам, биохимическим показателям крови.
В таблице 2 представлена динамика уровней САД и ДАД у обследуемых лиц. При анализе офисных показателей средних и максимальных значений САД и ДАД после проведенной 12-недельной терапии снижение АД наблюдалось в обеих группах. В I группе динамика САД составила -6,6±5,3 мм рт.ст., во II группе аналогичный показатель был равен -8,2±4,2 мм рт.ст. (p=0,038). Динамика ДАД в группах составила -6±0,9 и -7 ±2,5 мм рт.ст. соответственно (p=0,007).
Офисная ЧСС в I и II группах снизилась на 14,3±5,1 и 15,9±8,1 уд./мин соответственно (р ≥0,05).
Оба типа терапии уменьшали центральное САД в аорте и центральное ДАД в аорте (p ≤0,01). СРПВ в аорте и в плечевой артерии достоверно снижалась во II группе, получавшей небиволол: с 11,3±3,10 до 9,4±1,81 мм рт.ст. (p ≤0,01). В I группе (бисопролол) данный показатель уменьшился с 11,87±1,10 до 10,9±2,02 мм рт.ст. (p ≥0,01; табл. 3).

В исследуемых группах не было выявлено достоверных различий в снижении Aix. В группе небиволола наблюдалась тенденция к снижению этого параметра: с -19,4±3,8 до -35,2 ±2,5% (p ≤0,01). Также во II достоверно снижался сосудистый возраст – с 60,2±7,7 до 52,4±9,3 лет (p ≤0,01).
Величина ЛПИ в обеих группах достоверно не изменилась.
Динамика ПФЭ при первом исследовании имела отрицательные значения или близкие к нулю в обеих исследуемых группах (табл. 4). На фоне проводимого лечения ПФЭ возрос во II группе с -3,8 ±1,6 до 6,0±0,3 % (p=0,001).
ОБСУЖДЕНИЕ
В ходе исследования нами были получены данные, указывающие на достижение целевого уровня АД в обеих группах терапии. При этом 100% целевого уровня АД достигнуто не было. Полученные результаты согласуются с итогами крупных исследований PAINT и PIANIST, где у пациентов высокого риска на фоне тройной фиксированной комбинации амлодипин + индапамид + периндоприл целевые уровни были достигнуты в 76 и 72,1% соответственно [20, 21].
По результатам исследования на фоне приема указанной тройной фиксированной комбинации и небиволола снизилась СРПВ и уменьшился индекс аугментации (Aix), а также достоверно улучшилось состояние эндотелия за счет увеличения ПФЭ. При этом не было отмечено корреляционной связи между степенью повышения АД и параметрами артериальной ригидности. В группе пациентов, получавших в сочетании с фиксированной комбинацией бисопролол, также наблюдалась тенденция к повышению ПФЭ, однако, несмотря на терапию, этот показатель оставался в отрицательных значениях, что свидетельствует о выраженной ЭД.
На фоне терапии во II группе исследования (небиволол) наблюдалось приближение сосудистого возраста к биологическому.
В ряду других бета-блокаторов небиволол обладает способностью вызывать специфическую эндотелиальную вазодилатацию (за счет стимулирующего эффекта на eNOS), а также снижать экспрессию генов, вызывающих воспалительный процесс, оксидативный стресс и пролиферацию гладкомышечных клеток [22, 23]. Бета-блокаторы без вазодилатирующих свойств в меньшей степени влияют на центральное АД [24]. В некоторых наблюдениях было показано, что пациенты, применяющие небиволол, имеют повышенную реактивность плечевой артерии по сравнению с бисопрололом, несмотря на практически сходное влияние на уровень АД. По всей видимости, небиволол, благодаря β1-селективности и уникальному механизму стимуляции пути l-аргинин/NO, обладает более выраженными положительными эффектами в отношении структурно-функциональных свойств артериальной стенки, которые отмечались как в нашем исследовании, так и в литературе [25–27].
Таким образом, добавление к тройной фиксированной комбинации амлодипин + индапамид + периндоприл бета-блокатора небиволола позволяет улучшить показатели артериальной ригидности, что в дальнейшем может благоприятно повлиять на течение заболевания и снизить риск осложнений.
ЗАКЛЮЧЕНИЕ
1. Использование бисопролола или небиволола в сочетании с фиксированной комбинацией амлодипин + индапамид + периндоприл у больных с АГ и ИБС обеспечивает длительное снижение офисного САД, ДАД и ЧСС.
2. Сочетание фиксированной комбинации амлодипин + индапамид + периндоприл с небивололом улучшало структурно-функциональные свойства артерий по сравнению с группой бисопролола, уменьшая СРПВ по артериям эластического типа с 11,3±3,10 до 9,4±1,81 м/с (р <0,05), а также приводило к снижению сосудистого возраста у пациентов с АГ и ИБС.
3. Улучшение функции эндотелия (увеличение ПФЭ) было достигнуто только в группе пациентов, получавших фиксированную комбинацию амлодипин + индапамид + периндоприл в сочетании с небивололом.


