ВВЕДЕНИЕ
Подагра – наиболее распространенный воспалительный артрит, характеризующийся болезненными и острыми приступами. Это обусловлено множеством факторов, повышающих концентрацию мочевой кислоты (МК) в сыворотке крови, что, в свою очередь, приводит к гиперурикемии (уровень МК >6,8 мг/дл или 420 мкмоль/л). Продолжительное повышение уровня МК в крови может вызывать отложение кристаллов моноурата натрия (МУН) в суставах и мягких тканях и в дальнейшем развитие острого и хронического воспаления [1]. Распространенность гиперурикемии и подагры значительно возросла за последние несколько десятилетий, что связано со старением населения, изменением в образе жизни и питании, а также увеличением числа сопутствующих заболеваний, ассоциированных с подагрой [2]. Отсутствие лечения или неправильная тактика ведения пациента могут обернуться хроническими проявлениями заболевания, включая стойкое воспаление, увеличение количества приступов подагры, развитие тофусов и структурное повреждение суставов [3].
Целью длительного лечения подагры является снижение уровня МК <6 мг/дл (360 мкмоль/л), что способствует растворению существующих кристаллов МУН и ингибированию образования новых. Адекватная терапия способствует устранению приступов подагрического артрита, разрешению тофусов и более эффективной борьбе с сопутствующими заболеваниями, многие из которых связаны с гиперурикемией [1, 4].
Лечение подагры проводится на протяжении всей жизни пациента, основу его составляет медикаментозная уратснижающая терапия (УСТ). В нашей стране зарегистрированы два уратснижающих лекарственных препарата, относящихся к группе ингибиторов ксантиноксидазы: аллопуринол и фебуксостат. Согласно национальным рекомендациям по лечению пациентов с подагрой (Ассоциация ревматологов России, 2018), аллопуринол служит препаратом первой линии [5]. Рекомендуемая начальная доза этого средства составляет 50–100 мг/сут с ее титрованием по мере необходимости каждые 2–4 нед для достижения целевого уровня МК. При непереносимости аллопуринола или наличии у пациента хронической болезни почек используется фебуксостат в дозе 80–120 мг/сут. Эффективность этого препарата выше, чем у аллопуринола; кроме того, при его приеме, как правило, не требуется титрования дозировки, и он безопасен при умеренном снижении скорости клубочковой фильтрации. Профиль безопасности фебуксостата в отношении сердечно-сосудистых заболеваний требует дальнейшей детализации, хотя в клинических исследованиях получены доказательства равной безопасности аллопуринола и фебуксостата [6].
Несмотря на наличие эффективных уратснижающих препаратов, подагра зачастую плохо поддается коррекции [7, 8]. Среди причин этого как недостаточное следование врачом существующим рекомендациям при назначении препаратов, так и низкая приверженность пациентов назначенному лечению [9]. В ретроспективном исследовании Riedel A.A. et al. среди 9482 пациентов с подагрой, которым были назначены уратснижающие препараты, лишь 18% продолжали принимать аллопуринол через 2 года от начала терапии [10]. Другое исследование показало, что из 4166 больных, которым была назначена УСТ, более 50% не придерживались лечения; особенно это касалось лиц более молодого возраста (<50 лет), пациентов с меньшим количеством сопутствующих заболеваний и тех, кто не посещал врача (терапевта или ревматолога) [11]. Такие результаты указывают на важность активного информирования пациентов об их заболевании. Было установлено, что обучение больных улучшает приверженность к терапии, уменьшает количество приступов подагры и увеличивает количество пациентов, достигших целевого уровня МК [12].
Цель нашего исследования – оценить приверженность к УСТ пациентов с подагрой, обследованных в ГБУ «Санкт-Петербургский научно-исследовательский институт скорой помощи им. И.И. Джанелидзе».
МАТЕРИАЛ И МЕТОДЫ
Исследование проводилось в период с января по май 2021 г. Был выполнен прямой опрос 53 пациентов обоего пола старше 18 лет, страдающих подагрой: 21 из них госпитализировался в Санкт-Петербургский научно-исследовательский институт скорой помощи им. И.И. Джанелидзе с различными диагнозами, 32 больных из базы данных стационара были приглашены по телефону для осмотра и заполнения анкеты.
Возраст больных находился в диапазоне 32–85 лет, средний показатель 55,0±8,8 лет. Среди участников исследования преобладали мужчины – 49 (92,4%). Длительность заболевания варьировала от 1 года до 23 лет, в среднем она составляла 9,1±5,2 лет.
Критериями включения в исследование служили наличие подагры, согласие на осмотр и заполнение опросника. Диагноз подагры всем пациентам был подтвержден в соответствии с классификационными критериями Американского колледжа ревматологии (ACR) / Европейской антиревматической лиги (EULAR) от 2015 г. [13].
В ходе исследования использовался оригинальный опросник для пациентов с подагрой. Задавались вопросы о возрасте, длительности заболевания, количестве подагрических приступов за последние 12 мес, частоте и последнем эпизоде осмотра ревматологом, соблюдении гипоурикемической диеты, о том, применяет ли пациент урастнижающие препараты, какие именно и в какой дозировке, а если не принимает, то по какой причине.
Все пациенты осматривались на наличие тофусов. 37 больным выполнено определение уровня МК. У оставшихся 16 человек на момент осмотра был активный приступ подагры, в связи с чем у них содержание МК в крови не анализировалось.
Статистический анализ осуществлялся с помощью программы MS Excel 2010. Использовались параметрические и непараметрические методы статистики. Различия считались значимыми при р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из 53 обследованных пациентов только у 11,3% не было приступов подагры за последние 12 мес; у остальных 88,7% приступы сохранялись (табл. 1). Большинство пациентов (45,3%) имело 1–3 приступа за последние 12 мес, примерно треть – от 4 до 9 обострений за год. Доля больных, у которых приступы случались чаще (≥10 раз), составила седьмую часть опрошенных.
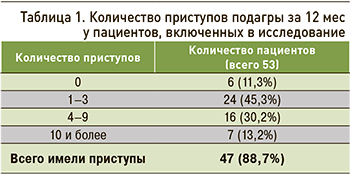
При осмотре тофусы были выявлены у 35,8% человек (рис. 1). По литературным данным, тофусы формируются приблизительно у 30% больных подагрой, как правило, при длительности заболевания более 5–6 лет в отсутствие адекватной УСТ [3].
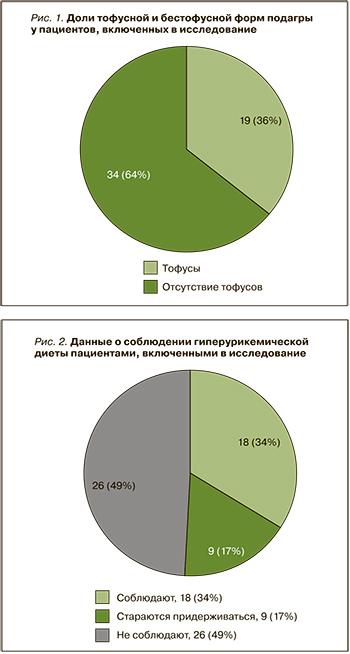
Все опрошенные знали о необходимости соблюдения гипоурикемической диеты и имели представление о продуктах, которые нужно ограничивать в рационе (рис. 2). При этом почти половина больных диету не соблюдала вовсе, 51,0% диету соблюдали или старались придерживаться ее с периодическими отступлениями. Количественные данные о соблюдении диеты больными с подагрой в литературе мы не встретили.
УСТ получали 51,0% исследуемых пациентов. 92,6% из них на момент опроса принимали аллопуринол, при этом большинство – в фиксированной дозе 100 мг/сут (длительность приема от 2 мес до 13 лет; табл. 2). Нужно отметить, что ни у кого из этих пациентов лечащим врачом никогда не предпринималось попыток коррекции дозы препарата. 11,3% опрошенных получали более высокие дозы аллопуринола (от 200 до 400 мг/сут), еще 9,4% применяли это лекарственное средство лишь эпизодически (время от времени).

Всего 3,8% пациентов получали фебуксостат в дозе 80 мг/сут. 49,0% человек УСТ не получали. Из них 13,2% пациентов принимали аллопуринол ранее, но самостоятельно его себе отменили. Причиной отмены были отсутствие подагрических приступов, сохраняющиеся приступы на фоне приема аллопуринола, неготовность больного к пожизненной УСТ. У 5,7% пациентов имелась непереносимость аллопуринола, при этом фебуксостат в качестве альтернативного препарата им не назначался. 30,2% опрошенных никогда не принимали УСП.
В целом низкая приверженность пациентов к УСТ при подагре является всеобщей терапевтической проблемой: по результатам различных исследований, показатели приверженности варьируются в достаточно широких пределах – от 10 до 46% [14]. В исследовании с использованием большой базы данных первичной медицинской помощи в Великобритании было установлено, что только около 40% больных подагрой придерживаются или частично придерживаются терапии [15]. В свою очередь, ретроспективное исследование в Израиле продемонстрировало, что лишь 17% пациентов продолжали принимать аллопуринол через один год от начала терапии этим препаратом [16], а в Италии этот показатель и вовсе составлял только 3,2% [17]. В популяционном когортном исследовании в Швеции с участием 7709 больных подагрой было выявлено, что в течение года после установления диагноза подагры лишь 32% из них получали УСТ, а из тех, кто начал лечение, 75% прекратили терапию в течение первых двух лет [18].
Важно отметить, что исследования, основанные на опросе пациентов, позволяют получить более высокие показатели приверженности к терапии, по сравнению с теми, которые основаны на других показателях, например, электронных записях рецептов [13]. Так, процент приверженности к УСТ в исследованиях Silva L. et al. [19] и Martini N. et al. [20], основанных на самоотчете пациентов, составил 53 и 79% соответственно. Приверженность к терапии среди больных в нашей выборке составил 51,0%, что является достаточно низким показателем и в целом соответствует результатам аналогичных исследований.
Около трети человек (30,2%) нашей выборки никогда ранее не осматривались ревматологом; подагра была диагностирована и рекомендации по лечению давались врачами других специальностей – терапевтами, хирургами, врачами общей практики (рис. 3).
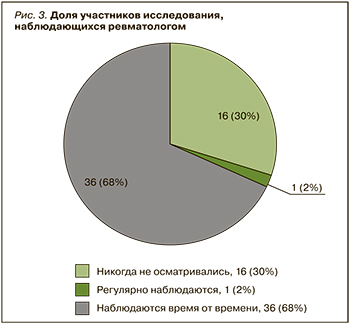
Только один больной (1,9%) из опрошенных наблюдался ревматологом регулярно. 67,9% пациентов консультировались ревматологами время от времени. При этом осмотрены ревматологом в течение последних 12 мес были лишь 5 пациентов (13,9% от группы периодически наблюдающихся).
В мире в целом наблюдается низкая приверженность врачей первичной медицинской помощи клиническим рекомендациям по лечению подагры [21]. Например, в исследовании Halpern R. et al. из 18 243 больных подагрой только 55% были назначены уратснижающие препараты [22]. Отсутствие информации о принципах и необходимости лечения, а также точных инструкций по приему лекарства и его побочных явлениях негативно влияет на соблюдение пациентами рекомендаций. Назначение УСТ неспециалистом, по сравнению с ревматологами, также относится к предикторам плохой приверженности лечению [23].
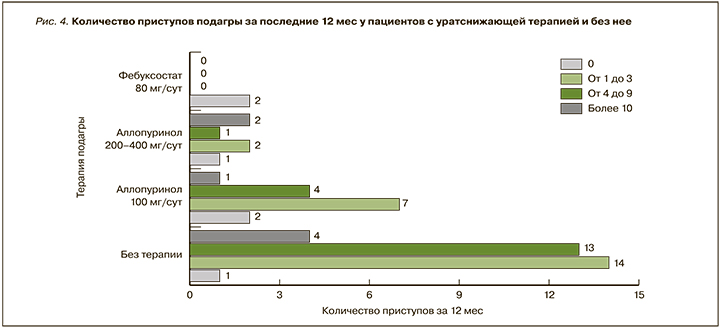
При сравнении групп больных, получавших различную УСТ, а также такую терапию не получавших, по количеству приступов подагры за последние 12 мес наибольшее количество обострений ожидаемо наблюдалось в группе пациентов без терапии (рис. 4). В группе пациентов, получавших аллопуринол 100 мг/сут, только у двух опрошенных подагрических приступов не было. У большинства больных, получавших более высокие дозы аллопуринола (200–400 мг/сут), также сохранялись приступы подагры, что может говорить о неудовлетворительном подборе дозы этого препарата. У пациентов, получавших фебуксостат, приступов подагры в течение последнего года не было, что согласуется с данными международных исследований [24].
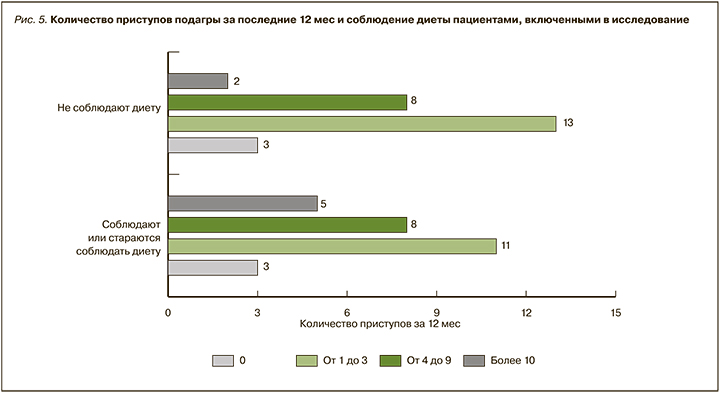
При сравнении групп больных, соблюдавших и не соблюдавших гипоурикемическую диету, значительных различий по количеству приступов подагры за последние 12 мес мы не обнаружили (p >0,05; рис. 5).
69,8% опрошенных был определен уровень МК. Лишь 3 из них (8,1%) имели целевой показатель МК <6,0 мг/дл. Один из этих пациентов получал аллопуринол в дозе 300 мг/сут и соблюдал гипоурикемическую диету, двое других соблюдали диету, но аллопуринол самостоятельно себе ранее отменили. У остальных больных уровень МК находился в диапазоне 6,0–12,9 мг/дл, в среднем 8,3±1,5 мг/дл. При этом в группе пациентов, получавших терапию (n=16 человек), средний показатель МК составлял 6,9±1,6 мг/дл, а в группе без терапии (n=21) – 8,3±1,5 мг/дл (рис. 6). Статистически достоверных различий межу уровнем МК в этих групп тем не менее не наблюдалось (р=0,52). Это, вероятно, может также косвенно свидетельствовать о неудовлетворительном подборе дозы уратснижающих препаратов исследованным пациентов.

У 30,2% опрошенных на момент осмотра был активный приступ подагры, поэтому уровень МК у них не анализировался.
Несмотря на имеющиеся рекомендации по лечению гиперурикемии [5, 25], терапия нередко плохо контролируется, а цели лечения часто не достигаются. Wall G.C. et al. продемонстрировали в своем исследовании, что в учреждениях первичной медицинской помощи, где лечится большинство больных подагрой, уровень МК сыворотки ежегодно контролируется только у одной четверти человек [21]. В других исследованиях показано, что менее 50% пациентов достигают целевого уровня МК за 12 мес терапии [26, 27]. По нашим данным, количество больных, достигших целевого уровня МК, также крайне мало, что было указано выше.
Обращает на себя внимание, что лишь приблизительно у пятой части больных, получающих аллопуринол (22,2%), проводилось титрование дозы препарата выше 100 мг/сут. При этом только у одного из них был достигнут целевой уровень МК. Это может быть связано как с недостаточной приверженностью врачей рекомендациям по лечению подагры, так и обусловлено поведением пациентов, не считающих обязательным выполнять врачебные рекомендации. В связи с этим перспективным представляется более широкое применение фебуксостата, титрование дозы которого в большинстве случаев не требуется. По результатам ряда крупных исследований было убедительно показано, что эффективность фебуксостата в дозе 80 мг/ сут существенно превышает эффективность аллопуринола в дозе 100–300 мг/ сут. Так, в исследовании FACT (760 пациентов), целевой уровень МК менее 6 мг/дл был достигнут у 53% больных, принимавших 80 мг фебуксостата, у 62%, получавших 120 мг фебуксостата, и у 21%, использовавших 300 мг аллопуринола (p <0,001 при сопоставлении любой дозы фебуксостата с аллопуринолом) [28]. В исследовании APEX (1067 пациентов) к концу исследования целевой уровень МК был достигнут у большинства пациентов на фоне приема фебуксостата (у 76–94% в зависимости от дозы), и только у 41 и 1% при применении аллопуринола и плацебо соответственно (p <0,05 для всех групп фебуксостата в сравнении с группами аллопуринола и плацебо) [29]. По результатам исследования CONFIRMS (2269 пациентов), при приеме 80 мг/ сут фебуксостата нормоурикемия была достигнута в 67% наблюдений, и только в 45% при использовании 300 мг аллопуринола [30]. При этом в большинстве исследований не получено статистически достоверных различий между группами по развитию неблагоприятных реакций, в том числе сердечно-сосудистых катастроф. Кроме того, в исследовании FAST было показано, что лечение в условиях реальной клинической практики аллопуринолом и фебуксостатом демонстрирует схожую кардиоваскулярную безопасность [6].
Низкая приверженность к УСТ обусловлена многими факторами, ведущий из которых – недостаточная осведомленность пациентов о своем заболевании. Согласно обновленным рекомендациям EULAR 2016 г., каждый пациент с подагрой должен быть полностью информирован о патофизиологии заболевания, наличии эффективных методов лечения, коморбидных патологиях, принципах терапии острого приступа артрита и элиминации кристаллов уратов путем пожизненного снижения сывороточного уровня МК ниже целевого уровня [25]. Обучение больных подагрой приводит к повышению комплаентности и более частому достижения успехов в лечении. Так, Rees F. et al. изучили эффективность обучения пациентов средним медицинским персоналом, которое включало также индивидуальные рекомендации по образу жизни и терапии, и обнаружили, что 92% больных достигли целевого уровня МК в течение 12-месячного периода. Авторы также обнаружили уменьшение количества острых приступов подагры при использовании такого вмешательства [12].
ЗАКЛЮЧЕНИЕ
1. Приверженность к терапии среди пациентов с подагрой в нашем исследовании оказалась низкой, что в целом соответствует результатам других аналогичных исследований в мире.
2. У большинства обследованных (91,9%) уровень МК не достигал целевых значений.
3. Одним из важнейших путей, способствующих повышению приверженности к терапии больных подагрой, является повышение их информированности о своем заболевании и принципах его лечения.



