ВВЕДЕНИЕ
Лечение заболеваний, ассоциированных с атеросклерозом, сегодня немыслимо без статинотерапии, позволяющей снизить уровень холестерина липопротеидов низкой плотности (ХС ЛНП) на 20–50% от исходного, что сопровождается снижением риска инфаркта миокарда (ИМ) и инсульта на 25–35%. Несмотря на эту защиту, остаточный риск сердечно-сосудистых событий может сохраняться на уровне 65–75% [1].
В известной степени остаточный риск обусловлен не только высоким уровнем ХС ЛНП, но и иными атерогенными вариантами дислипидемии. Так, для пациентов с абдоминальным ожирением, нарушениями углеводного обмена, злоупотребляющих алкоголем, характерна аномальная «липидная триада» в виде умеренного повышения ЛНП с преобладанием фракции мелких плотных частиц, повышения триглицеридов (ТГ) ≥150 мг/дл в сочетании с низким уровнем холестерина липопротеидов высокой плотности (ХС ЛВП) (<40 мг/дл у мужчин, <50 мг/дл у женщин), которая также несет в себе угрозу прогрессирования и развития осложнений атеросклероза [2–4]. Эти и другие причины дислипидемии с гипертриглицеридемией (ГТГ) перечислены в таблице 1.

ТРИГЛИЦЕРИДЫ, ХОЛЕСТЕРИН ЛИПОПРОТЕИДОВ ВЫСОКОЙ ПЛОТНОСТИ И РИСК АТЕРОСКЛЕРОЗА
Большая часть циркулирующих ТГ находится в составе липопротеидов очень низкой плотности (ЛПОНП) и ремнантов. Следовательно, концентрация ТГ в плазме отражает концентрацию циркулирующих ApoB-содержащих липопротеинов, богатых триглицеридами. Результаты исследований, в том числе с менделевской рандомизацией, позволяют предположить причинную связь между риском ишемической болезни сердца (ИБС) и уровнем ТГ в плазме; однако эти данные следует интерпретировать с осторожностью, так как риск ИБС, ассоциированный с ТГ, также ассоциирован с уровнями ХС ЛВП, ХС ЛНП или липопротеина(а) (Лп(а)). Кроме того, связь уровня ТГ с риском ИБС обнуляется после поправки на холестерин, не связанный с липопротеидами высокой плотности (ХС не-ЛВП), т.е. после учета влияния концентрации всех АпоВ-содержащих липопротеинов [5–9].
В совокупности эти исследования свидетельствуют о том, что влияние липопротеинов, богатых ТГ, на риск ИБС определяется общей концентрацией ApoB-содержащих частиц в плазме крови в большей степени, чем содержанием собственно ТГ.
Обратная связь между уровнем ХС ЛВП в плазме и риском развития сердечно-сосудистых заболеваний (ССЗ) является одной из наиболее устойчивых и воспроизводимых ассоциаций в эпидемиологических наблюдениях. В то же время исследования с менделевской рандомизацией не подтверждают причинного характера этой связи, вероятно, потому, что большинство генетических вариантов, связанных с повышением уровня ХС ЛВП, также связано с противоположными изменениями концентрации ТГ и/или ХС ЛНП. Кроме того, рандомизированные исследования не представили доказательств того, что повышение уровня ХС ЛВП в плазме в результате целенаправленной терапии снижает риск сердечно-сосудистых событий [10–13].
Лабораторную оценку уровня ТГ в плазме следует проводить для выявления лиц с более высоким модифицируемым риском ИБС, чем может показать оценка ХС ЛНП. Такая ситуация характерна для пациентов с повышенным уровнем ТГ, сахарным диабетом (СД), ожирением или очень низким достигнутым уровнем ХС ЛНП, у которых рассчитанный или измеренный напрямую уровень ХС ЛНП может недооценивать как общую концентрацию холестерина, переносимого ЛНП, так и (что более важно) общую концентрацию липопротеинов, содержащих АпоВ, тем самым преуменьшая атерогенность дислипидемии и риск ССЗ. Несоответствие между измеренными уровнями ХС ЛНП и АпоВ наблюдается примерно у 20% пациентов [14, 15]. Например, злокачественная атерогенная природа диабетической дислипидемии может быть более эффективно выявлена не с помощью измерения ХС ЛНП, которые могут оставаться в пределах нормы, а по уровню ХС не-ЛВП. Диабетическая дислипидемия представляет собой совокупность липидных и липопротеиновых аномалий, включая повышение как натощак, так и после приема пищи ТГ, ApoB и малых плотных частиц ЛНП, а также низкий уровень ХС ЛВП и ApoA1. Поскольку богатые триглицеридами липопротеины, включая хиломикроны, ЛПОНП и ремнанты, так же, как и ЛНП, содержат молекулу ApoB, то уровень ХС не-ЛВП лучше, чем ХС ЛНП, отражает общую концентрацию частиц, содержащих АроВ, и является вторичной целью терапии [16, 17].
ЛЕЧЕНИЕ ДИСЛИПИДЕМИИ С ГИПЕРТРИГЛИЦЕРИДЕМИЕЙ
Для коррекции атерогенной дислипидемии с ГТГ рекомендуется как модификация образа жизни, так и фармакотерапия. ХС ЛНП в обоих случаях служит первоочередной мишенью для снижения сердечно-сосудистого риска. Однако и нормализация уровня ТГ также имеет смысл и может рассматриваться в качестве одной из целей лечения. Особенно это относится к больным СД и метаболическим синдромом.
Модификация образа жизни
Модификация образа жизни обладает многогранным влиянием на атерогенную дислипидемию. Снижение веса, регулярные физические упражнения, ограничение употребления алкоголя обладают позитивным эффектом в отношении уровня ТГ, особенно у людей с ГТГ. Снижение веса в большинстве случаев является наиболее эффективной мерой благодаря выраженному влиянию на уровни ТГ и ХС ЛВП в плазме крови вкупе с умеренным снижением уровней общего ХС и ХС ЛНП. Умеренные и интенсивные аэробные упражнения также связаны с улучшением липидного профиля плазмы за счет снижения уровня ТГ и повышения концентраций ХС ЛВП [18, 19]. Пагубное влияние высокоуглеводной диеты на ТГ проявляется в основном в случае привычного потребления значительного количества рафинированных продуктов, богатых такими углеводами, как крахмал, простые сахара (глюкоза, фруктоза, сахароза), и гораздо менее выражено, если диета основана на продуктах, богатых клетчаткой, и с низким гликемическим индексом [20, 21].
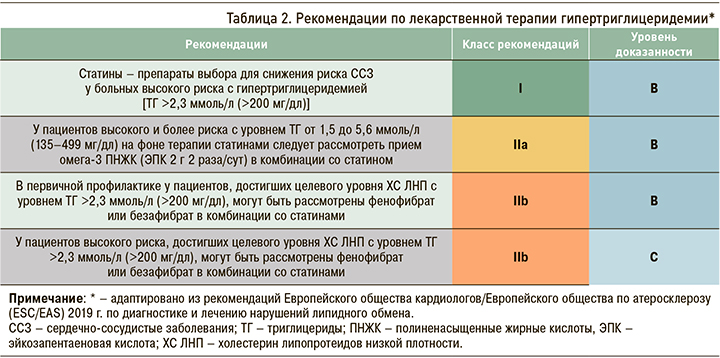
Хотя риск ССЗ при ТГ натощак >1,7 ммоль/л (>150 мг/дл) увеличивается, использование препаратов для снижения концентрации ТГ может рассматриваться только у пациентов с высоким риском, когда уровень ТГ держится выше 2,3 ммоль/л (>200 мг/дл), несмотря на адекватное изменение образа жизни [6] (табл. 2).
Фармакотерапия гипертриглицеридемии
Статины
Фармакотерапия ГТГ у здоровых и больных для снижения высокого сердечно-сосудистого риска, согласно актуальным клиническим рекомендациям по диагностике и лечению нарушений липидного обмена, проводится в первую очередь с помощью статинов (см. табл. 2).
Следует отметить обоснованность представленной тактики липид-модифицирующей терапии у больных с ГТГ.
Применение статинов сопровождается снижением плазменных концентраций ЛНП и других атерогенных липопротеинов, содержащих АпоВ, включая частицы, богатые ТГ. Степень снижения ХС ЛНП варьирует в зависимости от дозы и конкретного препарата. Снижение ТГ обычно составляет 10–20% от исходных значений. Более «сильные» статины (розувастатин, аторвастатин и питавастатин) демонстрируют устойчивое снижение уровней ТГ, особенно в высоких дозах и у пациентов с ГТГ, у которых абсолютный сердечно-сосудистый риск и, следовательно, его снижение больше [3]. Механизм снижения уровня ТГ до конца не выяснен, но, по-видимому, он не полностью «завязан» на рецепторы ЛНП. Полагают, что имеет место усиление поглощения ЛПОНП гепатоцитами, а также снижение скорости продукции ЛПОНП. Описанные эффекты, по-видимому, зависят от концентрации ЛПОНП до лечения [22]. По данным метаанализа, повышение уровней ХС ЛВП на фоне приема статинов колеблется в пределах 1–10% в зависимости от дозы. Однако точно оценить степень влияния этого эффекта статинов на сердечно-сосудистый риск не удается на фоне мощного эффекта от снижения АпоВ-содержащих липопротеинов [23]. Статины незначительно влияют на концентрацию Лп(а) в плазме крови; ранее сообщалось об отсутствии эффекта или повышении уровней Лп(а) после их применения. Механизмы этого влияния требуют дальнейшего изучения [24, 25].
Самое важное в эффекте статинов – это крайне позитивное влияние данной группы препаратов на сердечно-сосудистую заболеваемость и смертность. Было проведено большое количество метаанализов для оценки эффектов статинов в популяциях и подгруппах. Так, в метаанализе CTT (Cholesterol Treatment Trialists Collaboration) были проанализированы результаты 26 рандомизированных клинических исследований (РКИ) с участием более 170 000 пациентов, в которых сравнивались эффекты статинов с контролем либо эффекты более и менее интенсивных режимов их дозирования. Оказалось, что ассоциированное со статинами снижение ХС ЛНП в среднем на каждый 1 ммоль/л сопровождалось уменьшением частоты основных сосудистых событий на ≈22%, серьезных коронарных событий на 23%, смерти от ИБС на 20%, инсульта на 17% и общей смертности на 10% за 5 лет. Описанная пропорция эффектов наблюдалась во всех исследованных подгруппах, в том числе у больных с СД и различными видами дислипидемии. Однако при более высоком абсолютном риске у больных СД и абсолютная польза будет больше, что приведет к меньшему количеству больных, которых необходимо пролечить (NNT). Таким образом, статины – первая линия терапии для снижения уровня ХС ЛНП и уменьшения бремени ССЗ [26, 27].
Немаловажно, что клиническая польза от лечения статинами в значительной степени является эффектом данного класса лекарств, обусловленным абсолютным снижением уровня ХС ЛНП; следовательно, тип применяемых статинов должен отражать цели лечения конкретного пациента.
Розувастатин продемонстрировал значительное превосходство над другими рутинно назначаемыми статинами [28]. В исследовании STELLAR целевые значения ХС ЛНП были достигнуты у 82–89% пациентов, получавших розувастатин в дозе 10–40 мг, против 69–85% пациентов, леченных аторвастатином в дозе 10–80 мг; розувастатин снизил уровень белка апоB на 37–45% по сравнению с 29–43%, достигнутыми на аторвастатине, 22–35% – на симвастатине и 15–23% – на правастатине [29].
Кроме того, на фоне приема розувастатина уровень ХС не-ЛВП снижался на 42–51%, тогда как в группе аторвастатина аналогичный показатель составлял 34–48%, симвастатина – 26–42%, правастатина – 19–27% [30].
Определение уровня ХС не-ЛВП, как упоминалось ранее, рекомендовано для оценки риска у лиц с высоким уровнем ТГ, СД, ожирением или очень низкими показателями ЛНП (уровень достоверности доказательств I / уровень убедительности рекомендаций C). Считается, что целевое значение для ХС не-ЛВП должно быть на 0,8 ммоль/л (30 мг/ дл) выше, чем соответствующий целевой уровень ХС ЛНП (табл. 3). Однако целевые значения для ХС не-ЛВП и ApoB не были широко изучены в РКИ. Учитывая этот факт, сегодня рекомендуется проводить коррекцию липидоснижающей терапии в соответствии с указанными целевыми значениями после достижения целевых уровней ХС ЛНП у пациентов с очень высоким сердечно-сосудистым риском [2].

Аналогичная ситуация сложилась в отношении конкретных целевых значений ХС ЛВП или ТГ, которые на данный момент в клинических исследованиях не установлены, хотя повышение уровня ХС ЛВП ассоциировано с регрессией атеросклероза, а низкий уровень ХС ЛВП коррелирует с высокой частотой неблагоприятных событий и смертности у пациентов с ИБС даже при низком уровне ХС ЛНП (см. табл. 3). Поэтому специалисты должны опираться на клинический опыт при решении вопроса о дальнейшей интенсификации лечения у конкретного пациента с высоким или очень высоким риском ССЗ [2].
Комбинированная терапия
В случае если монотерапия статинами не позволяет достичь условных целевых уровней липидов, подлежащих коррекции, можно прибегнуть к комбинированной терапии [2]. В качестве дополнительного фармакологического вмешательства при сохраняющейся ГТГ рассматриваются статины, фибраты, препараты никотиновой кислоты и омега-3-полиненасыщенные жирные кислоты (n-3 ПНЖК).
Метаанализ 10 клинических испытаний фибратов, ниацина и n-3 ПНЖК, продемонстрировал 12% снижение риска сердечно-сосудистых исходов на фоне их приема [31]. В недавнем исследовании REDUCE-IT у пациентов высокого сердечно-сосудистого риска, принимающих статины и имеющих уровень ТГ натощак 1,52–1,63 ммоль/л, прием высокоочищенной и стабильной эйкозапентаеновой кислоты (ЭПК) в высоких дозах (4 г/ сут) сопровождался снижением риска ишемических событий, включая смерть от ССЗ, примерно на четверть за период наблюдения с медианой 4,9 года [32]. Однако в исследовании VITAL прием n-3 ПНЖК в более низкой дозе (1 г/сут) не был эффективен в первичной профилактике сердечно-сосудистых событий у мужчин и женщин среднего возраста в течение 5 лет наблюдения [33]. С учетом приведенных данных в клинических рекомендациях Европейского общества кардиологов (ESC) 2019 г. появился пункт о возможности назначения ЭПК в дозе 2 г 2 раза/сут пациентам высокого и более риска с уровнем ТГ от 1,5 до 5,6 ммоль/л (135–499 мг/дл) на фоне терапии статинами (IIa/B) [2].
Комбинация статинов с производными фиброевой кислоты
Обоснование
Что касается комбинации статинов с производными фиброевой кислоты, то она может быть рассмотрена у лиц со смешанной дислипидемией, достигших целевого уровня ХС ЛНП на фоне терапии статинами, но с уровнем ТГ, превышающим 2,3 ммоль/л [2]. Это положение касается как случаев первичной ССЗ (IIb/B), так и вторичной (IIb/С) профилактики (см. табл. 2).
Еще одна причина назначить больному фибраты – это постоянная ГТГ с уровнем ТГ >500 мг/ дл (>5,6 ммоль/л), сопровождающаяся высоким риском панкреатита. Для профилактики этого тяжелого осложнения рекомендована диета с очень низким содержанием жиров в сочетании с фибратами или n-3 ПНЖК [34, 35].
Совместный прием статинов с фибратами возможен, поскольку эти классы гиполипидемических средств имеют разные механизмы действия на метаболизм липидов. При этом они не являются антагонистами либо конкурентами, но дополняют фармакодинамические эффекты друг друга в отношении липидов и имеют потенциал совместного применения [30].
Как известно, статины снижают синтез холестерина в печени, конкурентно ингибируя фермент 3-гидрокси-3-метилглутарил-кофермент A (ГМГ-КоА) редуктазу и лимитируя биосинтез холестерина. Снижение внутриклеточного холестерина способствует увеличению экспрессии рецепторов ЛНП на поверхности гепатоцитов, что, в свою очередь, приводит к увеличению поглощения ЛНП гепатоцитами.
Фибраты эффективно снижают в крови уровень ТГ натощак, а также содержание постпрандиальных ТГ и богатых триглицеридами ремнантов. Механизм действия фенофиброевой кислоты (активный метаболит фенофибрата) связан с воздействием на ядерные рецепторы PPARα (альфа-рецепторы, активируемые пролифератором пероксисом) гепатоцитов и регуляцией транскрипции генов в направлении активации липопротеинлипазы и подавления синтеза аполипопротеина CIII. В результате происходит усиление липолиза атерогенных липопротеидов с высоким содержанием ТГ – ЛПОНП, повышение плазменного клиренса ЛНП, снижается пул высоко атерогенных малых плотных частиц ЛНП (за счет изменения состава и укрупнения) и аполипопротеина В (ApoB). Активация PPARα также вызывает усиление синтеза аполипопротеинов AI и AII, увеличение содержания фракции ЛВП, обратный транспорт холестерина и повышение синтеза желчных кислот в печени [36].
Влияние фибратов на липидный профиль
Степень влияния на липидный профиль варьирует среди представителей класса фибратов. В ходе клинических исследований, а также по результатам метаанализа 40 исследований с участием в общей сложности 18 500 больных было отмечено, что при монотерапии фенофибратом можно ожидать снижения уровня общего ХС на 20–25%, а ТГ на 40–55% при повышении уровня ХС ЛВП на 10–30%. У пациентов с гиперхолестеринемией, у которых уровень ХС ЛНП снижался на 20–35%, использование, в частности, фенофибрата приводило к снижению соотношений «общий ХС/ ХС ЛВП», «ХС ЛНП /ХС ЛВП» и «АпоВ/АпоАI», являющихся маркерами атерогенного риска. Выраженность эффекта фибратов в значительной степени зависит от исходных уровней липидов [37, 38]. Так, при длительной терапии больных СД 2-го типа без повышения ТГ влияние фибратов на концентрации ЛВП и ТГ было заметно меньше (≈5 и ≈20% соответственно) [39, 40].
Переносимость фибратов
Фибраты, как правило, хорошо переносятся. Возможны легкие побочные эффекты в виде расстройств желудочно-кишечного тракта у <5% пациентов, кожных высыпаний у 2% [41]. К наиболее известным побочным эффектам фибратов относятся миопатия, повышение уровня ферментов печени и желчнокаменная болезнь (ЖКБ).
Повышение литогенности желчи и увеличение заболеваемости ЖКБ оказалось существенным побочным эффектом клофибрата, в связи с чем его перестали применять. Повышение риска ЖКБ при терапии гемфиброзилом, безафибратом, ципрофибратом и фенофибратом не доказано, но исключать такую возможность нельзя.
Дополнительная осторожность необходима при комбинированной терапии фибратов со статинами. Установлено, что гемфиброзил при совместном применении увеличивает концентрацию всех статинов, за исключением флувастатина. Риск миопатии/рабдомиолиза при комбинации гемфиброзила со статинами примерно в 20 раз выше, чем при использовании фенофибрата. Помимо этого, гемфиброзил повышает концентрацию таких препаратов, как пиоглитазон, росиглитазон, производные сульфонилмочевины [41, 42].
Исключение составляет фенофибрат: в исследованиях FIELD и SAFARI его комбинация с симвастатином вызывала не больше побочных эффектов, чем монотерапия симвастатином при плацебо-контроле, что связано с различным микросомальным метаболизмом фенофибрата и статинов [39, 43].
Ни в одном исследовании лечение фибратами не сопровождалось повышением частоты клинически значимых почечных осложнений. Сообщалось, что прием этой группы лекарственных средств может сопровождаться повышением уровня креатинина в сыворотке, а также гомоцистеина как при кратковременном, так и длительном применении; однако этот эффект является обратимым после прекращения приема препарата. Данные метаанализов показывают, что снижение расчетной скорости клубочковой фильтрации (СКФ) не отражает каких-либо неблагоприятных воздействий на функцию почек [44]. Индуцированное фибратами повышение уровня гомоцистеина считается нейтральным в отношении риска ССЗ, однако может снизить скорость роста концентраций ХС ЛВП и ApoA1 и тем самым уменьшить преимущества фибратов в отношении сердечно-сосудистых исходов [45].
Клинические преимущества фибратов
Клинические преимущества, достигаемые при коррекции повышенного уровня ТГ и сниженного уровня ХС ЛВП, остаются предметом споров. В целом снижение сердечно-сосудистого риска оказалось пропорциональным степени снижения ХС не-ЛВП.
Клинические эффекты фибратов изучены в 6 основных РКИ: Helsinki Heart Study (HHS), Veterans Affairs High Density Lipoprotein Intervention Trial (VA-HIT), Bezafibrate Infarction Prevention (BIP), Low Extremis Arterial Disease Reduction (LEADER), Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) и ACCORD (Action to Control Cardiovascular Risk in Diabetes). В большинстве из них изучали монотерапию фибратами, и лишь в исследовании ACCORD анализировалось влияние добавления фибратов к терапии статинами [10, 39, 40, 46–49].
В HHS было зафиксировано значительное снижении риска сердечно-сосудистых событий на фоне приема гемфиброзила. В исследовании LEADER, где участвовали мужчины с заболеванием артерий нижних конечностей, не удалось показать, что безафибрат может привести к клинически значимому снижению риска сердечно-сосудистых событий. Сообщалось о снижении частоты нефатальных инфарктов миокарда, и этот эффект был наиболее очевиден у людей с повышенным уровнем ТГ и/ или низким уровнем ХС ЛВП.
Аналогичный вывод был сделан в рандомизированных исследованиях FIELD и ACCORD, где в общих выборках больных СД 2-го типа на фоне оптимальной статинотерапии не удалось доказать положительное влияние лечения фенофибратом на показатели сердечно-сосудистой заболеваемости и смертности [39, 40]. Однако в ACCORD добавление фенофибрата принесло явную пользу в виде существенного снижения (31%; р <0,05) риска сердечно-сосудистых событий в когорте больных с ТГ ≈2,3 ммоль/л и ХС ЛВП <0,4 ммоль/л, число которых составило 17% от всех участников [39]. Последующее наблюдение за выборкой ACCORD-Lipid продемонстрировало сохранение положительного эффекта фенофибрата в отдаленном периоде у лиц с исходной ГТГ и низким ХС ЛВП [50]. Аналогичным образом при ретроспективном анализе исследования FIELD подтверждено, что фенофибрат достоверно уменьшал частоту ССЗ на 27% у лиц с повышенным уровнем ТГ (≈2,3 ммоль/л) и сниженным уровнем ХС ЛВП (NNT = 23) [17].
Результаты большинства метаанализов также свидетельствуют о снижении риска серьезных сердечно-сосудистых событий, кроме заболеваемости ИБС и общей смертности, у пациентов с высоким уровнем ТГ и низким уровнем ХС ЛВП, леченных фибратами [31, 51–53].
Подтверждением адекватности избирательного подхода к назначению фибратов служат результаты ретроспективного анализа данных 8545 пациентов в рамках Израильского национального регистра ACSIS (Acute Coronary Syndrome Israeli Survey), в котором снижение относительного риска тяжелых кардиоваскулярных осложнений на 46% (p=0,03) при комбинации статина с фенофибратом было отмечено в когорте больных СД с характерной исходной дислипидемией [54]. В отсутствие дислипидемии дополнительных преимуществ от комбинированной терапии, по сравнению с монотерапией статинами, выявлено не было.
Таким образом, доступные данные показывают, что пациенты с СД и атерогенной дислипидемией могут получить клиническую пользу от терапии, снижающей уровень ТГ, в дополнение к лечению статинами.
Изучение потенциала фибратов в отношении снижения сердечно-сосудистого риска продолжается. Недавно сообщалось, что новый селективный модулятор PPAR-a пемафибрат обладает эффектом снижения уровня липопротеинов, богатых триглицеридами 317. В настоящее время идет исследование PROMINENT («Пемафибрат для уменьшения сердечно-сосудистых исходов за счет снижения уровня триглицеридов у пациентов с диабетом»), в котором участвуют примерно 10 000 больных СД высокого риска с высоким уровнем ТГ и низким уровнем ХС ЛВП [55].
При назначении фибратов следует учитывать их потенцирующий эффект в случае совместного применения с антикоагулянтами, а также гипогликемическими и урикозурическими средствами [56].
В перечисленных выше крупных рандомизированных исследованиях комбинированной гиполипидемической терапии главными и вторичными критериями эффективности (конечными точками) были, как правило, частота кардиоваскулярных осложнений, общая и сердечно-сосудистая смертность в различных сочетаниях. Однако, помимо регистрации главных и вторичных конечных точек, длительное наблюдение за больными СД позволило выявить достоверное замедление прогрессирования таких тяжелых осложнений этого заболевания, как диабетическая микро- и макроангиопатия, ретинопатия, нейропатия, нефропатия, а также уменьшение потребности в хирургических вмешательствах. Специалисты полагают, что описанный профилактический эффект фибратов в значительной степени можно объяснить его противовоспалительными и антиоксидантными свойствами [57]. Более выраженный, чем у статинов, противовоспалительный эффект, в частности фенофибрата, продемонстрирован в небольшом рандомизированном клиническом исследовании больных ревматоидным артритом [58].
В ряде ретроспективных исследований фибраты продемонстрировали ренопротективный эффект, замедляя прогрессирование микроальбуминурии при заболеваниях почек. Более того, у больных СД с исходным умеренным снижением функции почек (СКФ 30–59 мл/мин/1,73 м2) применение фибратов достоверно ассоциировалось со снижением суммарного относительного риска сердечно-сосудистых осложнений на 30% (p=0,004) [59]. Однако специальных проспективных исследований эффективности и безопасности фибратов при хронических болезнях почек не проводилось, поэтому их применение в этом случае должно сопровождаться регулярным лабораторным мониторингом почечной функции.
Комбинация статинов с фенофибратом
Исходя из представленных данных, можно предположить, что комбинация розувастатина и фенофибрата является наиболее выгодной с точки зрения гиполипидемической эффективности, безопасности и клинических преимуществ.
С целью текущей оценки основных аспектов комбинированной терапии розувастатином и фенофибратом по сравнению с монотерапией статинами – профиля безопасности, эффективности и потенциала влияния на сердечно-сосудистый риск у пациентов с атерогенной дислипидемией – выполнен обзор доступных результатов рандомизированных контролируемых испытаний, клинических испытаний, ретроспективных и проспективных исследований, систематических обзоров и метаанализов.
Применение в течение года фиксированных комбинаций различных суточных доз розувастатина (5, 10 или 20 мг) и фенофибрата (135 мг) у пациентов со смешанной дислипидемией значительно улучшило липидный профиль плазмы за счет коррекции содержания ТГ, ХС ЛВП, ХС не-ЛВП, апоB и высокочувствительного С-реактивного белка (вчСРБ) по сравнению с монотерапией симвастатином (р ≤0,04 для всех сравнений) [60]. Субанализ двух РКИ с участием больных ИБС в возрасте 65 лет и старше с плохо контролируемой смешанной дислипидемией показал, что комбинация розувастатина с фенофибратом снизила уровень ХС ЛНП на 31,8–47,2%, тогда как при монотерапии фенофибратом аналогичный показатель равнялся 10,6% (р <0,001). При сравнении комбинации розувастатин + фенофибрат с монотерапией розувастатином повышение ХС ЛВП составило 21,9–27,0 и 20,7–32,8% (р <0,001), а снижение ТГ – 48,3–53,5 и 5,9–9,9% соответственно (р <0,001). На фоне комбинированной терапии не наблюдалось новых или не ожидаемых проблем с безопасностью, не было отмечено серьезных нежелательных реакций [61, 62]. Это в значительной степени объясняется отсутствием клинически значимых фармакокинетических взаимодействий фенофиброевой кислоты с розувастатином [63].
В клинических руководствах по коррекции дислипидемии в версиях AHA/ACC/AAC и ESC/EAS 2019 г. рекомендовано комбинировать статины именно с фенофибратом в связи с существенно меньшим риском тяжелой миопатии [2].
Проведена апостериорная оценка комбинации статин + фенофибрат в долгосрочной и краткосрочной терапии пациентов высокого сердечно-сосудистого риска со смешанной дислипидемией. Выяснилось, что краткосрочное (6–12 мес) лечение фенофибратом и статинами в низких или умеренных дозах, по сравнению с монотерапией любым из использованных статинов (розувастатин, симвастатин или аторвастатин), приводило к достижению индивидуальных целей ХС не-ЛВП (53 против 38%; p<0,02), АпоВ, ХС ЛВП, ТГ и ХС ЛНП (51,3 против 72,9%; p <0,001) у сравнимого или большего количества больных [64]. При более длительной (2 года) терапии фенофибратом и статином в умеренных дозах (розувастатин 20 мг/аторвастатин 40 мг/симвастатин 40 мг) отмечено значительное улучшение липидного обмена (ХС ЛВП +17,4%, ТГ -46,4%, ХС ЛНП -40,4%) в сочетании с хорошей переносимостью и отсутствием новых или непредвиденных неблагоприятных реакций [65].
Влияние на биомаркеры
Еще одно преимущество комбинированной терапии розувастатином и фенофибратом – позитивная реакция вчСРБ у пациентов со смешанной дислипидемией и высоким уровнем вчСРБ, который свидетельствует о повышении риска сердечно-сосудистых событий. Апостериорный анализ показал, что у пациентов с сохраняющимся вчСРБ ≥2 мг/л после 12 нед монотерапии розувастатином в дозах 10, 20 или 40 мг произошло его снижение на ≈36% после добавления фенофибрата 135 мг на срок до 52 нед; этот эффект не сопровождался серьезными нежелательными реакциями. Таким образом, комбинированная терапия розувастатином и фибратом является потенциальным вариантом лечения для пациентов не только с липидными факторами риска [66, 67].
Приемлемый профиль безопасности фенофибрата и розувастатина, в том числе в составе фиксированных комбинаций, был установлен не только в исследованиях FIELD, ACCORD и SAFARI, но и во многих других РКИ, наблюдательных и ретроспективных исследованиях, как упоминалось ранее [68, 69].
Розувастатин положительно влияет на маркеры окислительного стресса, а фенофибрат уменьшает окислительный стресс. В рандомизированном открытом исследовании со слепыми конечными точками пациенты со смешанной, не контролируемой с помощью стандартной дозы статинов дислипидемией были случайным образом отобраны для перехода на более высокую дозу розувастатина или на добавление фиксированной комбинации никотиновой кислоты с ларопипрантом пролонгированного высвобождения либо на добавление микронизированного фенофибрата в суточной дозе 200 мг в общей сложности в течение 3 мес. Результаты продемонстрировали снижение изучаемых маркеров окислительного стресса при всех изучаемых лечебных подходах [34].
Сегодня на пике научной дискуссии – потенциальное влияние пониженного уровня 25(OH) витамина D на риск развития ССЗ, метаболического синдрома, СД, онкопатологии, аутоиммунных и инфекционных заболеваний и общей смертности. Результаты многих крупных перекрестных исследований обнаружили связь дефицита 25-гидроксикальциферола с увеличением частоты инфаркта миокарда [70].
В РКИ 60 пациентов с дислипидемией были случайным образом распределены на группы ежедневного 3-месячного приема розувастатина 40 мг, розувастатина 10 мг + фенофибрата 200 мг или розувастатина 10 мг + n-3 ПНЖК 2 г/сут. Во всех изучаемых группах было отмечено значительное сопоставимое увеличение содержания 25-гидроксикальциферола в плазме крови [71].
Первоначально предполагалось, что причина повышения уровня 25-гидроксикальциферола у пациентов, получающих комбинированную терапию статинами, может быть связана с конкуренцией за цитохром P450 3A4, который расщепляет 25-гидроксикальциферол [72]. Другим возможным механизмом может быть ингибирование ГМГ-КоA редуктазы статинами, что может привести к повышению уровня 7-дегидрохолестерина, который, в свою очередь, действует как общий предшественник холестерина и 25(ОН) витамина D [73]. В любом случае результаты исследования важны с клинической точки зрения, поскольку низкие уровни поскольку низкие уровни 25-гидроксикальциферола считаются независимым фактором риска ССЗ.
В настоящее время на российском фармацевтическом рынке фиксированная комбинация фенофибрата (145 мг) и розувастатина (10 мг) представлена в виде препарата Супрозафен®.
ЗАКЛЮЧЕНИЕ
Сочетание повышения ХС ЛНП и ТГ в плазме крови с пониженным уровнем ХС ЛВП – нередкий вариант дислипидемии. Фармакотерапию смешанной дислипидемии такого рода рекомендовано проводить в первую очередь статинами с учетом их клинических преимуществ в отношении профилактики сердечно-сосудистых осложнений. Терапия статинами эффективно снижает уровень ХС ЛНП, однако не всегда достаточна для оптимизации общего липидного профиля, что создает основу для формирования остаточного сердечно-сосудистого риска. Доказано, что комбинация статинов с производными фиброевой кислоты может быть использована для контроля смешанной атерогенной дислипидемии и предотвращения сердечно-сосудистых рисков у больных с уровнем ТГ >2,3 ммоль/л и сниженным содержанием ХС ЛВП на фоне оптимальной статинотерапии. Подтверждена польза фибратов для снижения риска диабетической нейроангиопатии, изучены их антиоксидантные, противовоспалительные и иные дополнительные эффекты. Наиболее безопасной и перспективной с клинической точки зрения является комбинация фенофибрата и розувастатина, тщательно изученная в рандомизированных, сравнительных и наблюдательных исследованиях.



