ВВЕДЕНИЕ
С 2019 г. в России идет реализация национального проекта «Демография», одной из составляющих которого является федеральная программа «Разработка и реализация системной поддержки и повышения качества жизни граждан старшего поколения». Остеопороз (ОП) занимает одно из ведущих мест в структуре заболеваемости лиц старше 50 лет. Так, экстраполяция эпидемиологических данных по распространенности ОП в России, полученных в конце прошлого века, на население этой возрастной категории показала, что ожидаемое число пациентов с этим заболеванием составляет 14 млн, или 10% всего населения. К 2035 г. прогнозируется рост числа случаев ОП, что связано в первую очередь с увеличением продолжительности жизни [1].
Социальная значимость ОП связана с его основными клиническими проявлениями – низкоэнергетическими (произошедшими при минимальной травме) переломами тел позвонков и костей периферического скелета, которые влекут за собой большие материальные затраты в области здравоохранения. Так, усредненная стоимость 1 года лечения ОП, осложненного переломом, в 2014 г. составляла 61 151 руб.; наиболее дорогостоящей была терапия пациентов с переломом проксимального отдела бедренной кости, наименее затратной – при переломе дистального отдела предплечья [2]. По расчетным данным, только прямые расходы на лечение основных остеопоротических переломов в России в 2018 г. могли достигать более 48 млрд руб. [3].
На фоне произошедших остеопоротических переломов наблюдается значимое ухудшение качества жизни пациентов, а его восстановление происходит только через 12–24 мес в зависимости от локализации перелома. При этом выраженные психоэмоциональные нарушения с преобладанием признаков тревожных расстройств сохраняются в течение более длительного периода, особенно у лиц с переломами позвонков [4]. Переломы проксимального отдела бедра не только ухудшают качество жизни, но без проведения оперативного лечения зачастую приводят и к летальному исходу [1].
Для снижения частоты остеопоротических переломов, улучшения качества жизни, а также уменьшения смертности и экономической нагрузки на систему здравоохранения необходимо раннее выявление лиц с ОП и назначение им медикаментозной терапии. Большая роль в диагностике и лечении этого заболевания в настоящее время отводится врачам первичного звена.
ДИАГНОСТИКА ОСТЕОПОРОЗА
К критериям диагностики ОП относятся:
1) наличие патологических переломов крупных костей скелета (бедренной кости, тел позвонков, множественных переломов);
2) высокая индивидуальная 10-летняя вероятность основных остеопоротических переломов, рассчитанная по FRAX;
3) снижение минеральной плотности кости (МПК) на 2,5 и более стандартных отклонений (СО) по Т-критерию в шейке бедренной кости и/ или в проксимальном отделе бедренной кости в целом и/или в поясничных позвонках [5].
Сбор анамнеза, в том числе опрос пациента насчет наличия переломов, имеет первостепенное значение для диагностики ОП. Переломы периферических костей с выраженной клинической картиной, включая боль и нарушение функции, диагностируются рентгенологически. Острый болевой синдром в спине также позволяет заподозрить перелом позвонка и направить больного для подтверждения диагноза на рентгенографию позвоночника в боковой проекции. В то же время большое количество деформаций позвонков при ОП может протекать без острой симптоматики и сопровождаться только чувством усталости в спине, снижением роста и изменением осанки. В таком случае ОП может длительно оставаться не диагностированным, а в качестве возможного источника боли предполагаться иная причина, например, остеохондроз позвоночника или неспецифическая боль в спине. Пациентов, у которых на приеме выявлено снижение роста на 4 см по сравнению с ростом в молодом возрасте или на 2 см за последние 1–3 года, необходимо направлять на рентгенографию позвоночника с последующим морфометрическим анализом и расчетом индекса деформации [6].
Остеопоротические переломы часто возникают у больных, принимающих глюкокортикоиды (ГК) 3 и более мес. Так, в течение первого года после начала такой терапии они происходят у каждого пятого пациента, а при более длительном пероральном приеме ГК доля лиц с переломами увеличивается до 50% [7]. С учетом этого прием ГК является одним из показаний для проведения рентгеноморфометрии позвоночника. Кроме того, рентгенография должна выполняться пациентам c диагностированными переломами другой локализации и лицам с длительно протекающим некомпенсированным сахарным диабетом 2-го типа (СД2) или получающим инсулинотерапию, так как у них риск развития переломов позвонков существенно повышен [8–10]. После выполнения первого исследования показанием для повторной рентгенографии может служить документально подтвержденное дальнейшее снижение роста, а также возникновение или усиление боли в спине, изменение осанки. В качестве альтернативы рентгенологическому исследованию могут выступать компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) позвоночника Th4–L5 [5].
Следует помнить, что повышенная хрупкость костей скелета может быть связана не только с наличием у пациента ОП, поэтому в последующем необходимо исключить все другие возможные причины переломов (например, гиперпаратиреоз, множественную миелому, онкопатологию с метастазами в кости и др.): для этого изучается анамнез, проводятся клинический и биохимический анализ крови, также возможно направление пациента на КТ, МРТ или сцинтиграфию скелета.
В настоящее время не рекомендуется устанавливать диагноз ОП на основании выявления повышенной прозрачности костной ткани на стандартных рентгенограммах различных участков скелета у пациентов без компрессионных переломов тел позвонков.
Другим критерием постановки диагноза ОП у женщин в постменопаузе и мужчин старше 50 лет является наличие высокого риска переломов, оцененный по FRAX (https://www.sheffield.ac.uk/FRAX/tool.aspx?lang=rs). Соответствующая анкета содержит 12 вопросов, при этом последний вопрос – минеральная плотность кости (МПК) в области шейки бедра – является не обязательным (рис. 1). Для конкретного человека рассчитывается индивидуальная 10-летняя вероятность 4 основных патологических переломов (позвонка, бедренной, плечевой и лучевой костей). В последующем полученный результат сравнивается с российским порогом вмешательства, и если он превышает точку терапевтического вмешательства для соответствующего возраста, то у пациента диагностируется высокий риск переломов и ему показано назначение лечения ОП независимо от результата рентгеновской денситометрии (dual-energy X-ray absorptiometry, DXA; рис. 2).
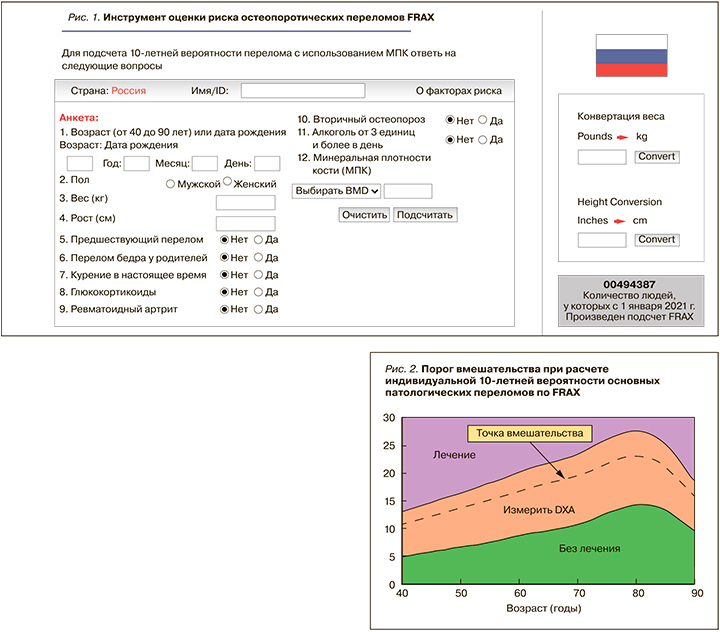
При возможности проведения в поликлинике DXA пациентам с умеренным риском переломов, у которых результат подсчета по алгоритму FRAX попал в оранжевую (среднюю) зону (рис. 2), рекомендованы денситометрия проксимального отдела бедра и последующий перерасчет риска с включением таких параметров, как значение МПК или Т-критерия шейки бедра. Если после этого пациент попал в зону выше точки вмешательства, ему показано назначение терапии, а если ниже или в зеленую зону – меры по профилактике ОП.
Пациентам, принимающим ГК в течение 3 мес в дозе 7,5 мг/сут и более в пересчете на преднизолон, рекомендуется увеличивать индивидуальную 10-летнюю вероятность основных остеопоротических переломов на 15%, после чего сравнивать с порогом терапевтического вмешательства [5].
Следует помнить, что инструмент FRAX имеет ряд ограничений: он не используется у молодых людей и детей; не валидизирован для пациентов, ранее получавших или получающих на момент обращения препараты для лечения ОП. Отметим, однако, что пациенты, прекратившие прием таких препаратов 1 год и более назад (для бисфосфонатов – 2 года), могут считаться нелечеными [11]. FRAX не учитывает МПК позвоночника, наличие в анамнезе множественных переломов, количество выкуриваемых сигарет, влияние СД2 на риск переломов.
Кроме вышеописанных критериев ОП, диагноз можно поставить на основании выявления сниженной МПК при рентгеноденситометрии проксимального отдела бедренной кости и/или поясничного отдела позвоночника в соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ) 1994 г: Т-критерий ≤-2,5 СО хотя бы в одной из областей измерения (поясничный отдел позвоночника, шейка бедра или общий показатель бедра). Диагностировать ОП в поясничном отделе позвоночника при выявлении низкой МПК только в одном позвонке нельзя; таких позвонков должно быть от двух до четырех.
Пациентам с низкоэнергетическими переломами в анамнезе и/или высоким риском переломов по FRAX, которым планируется назначение лечения ОП, денситометрия поясничного отдела позвоночника и проксимального отдела бедра может быть проведена для дальнейшей динамической оценки эффективности терапии.
ЛАБОРАТОРНОЕ ОБСЛЕДОВАНИЕ
Всем пациентам также рекомендуется выполнение лабораторного обследования, включающего общий и биохимический анализ крови (общий кальций, фосфор, щелочная фосфатаза, глюкоза, креатинин с подсчетом скорости клубочковой фильтрации), однако поставить диагноз ОП на основании только лабораторных тестов нельзя.
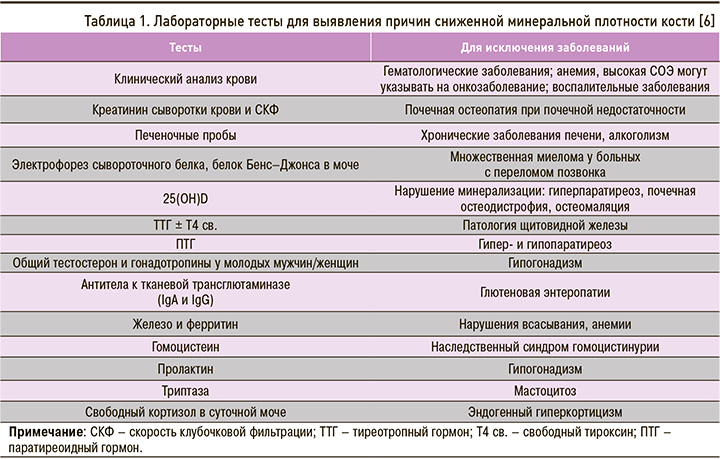
Результаты лабораторного исследования позволяют заподозрить/установить другую причину повышенной хрупкости скелета или уточнить противопоказания к назначению той или иной терапии. При выявлении любых отклонений необходимо более углубленное обследование (табл. 1).
Определение маркеров костного обмена в крови (С-концевого телопептида и/или N-терминального пропептида проколлагена 1-го типа) можно использовать для оценки эффективности лечения и приверженности терапии [12]. Достаточно оценивать только один маркер, но анализ должен быть сделан в одной и той же лаборатории с использованием одинаковых реактивов. Снижение С-концевого телопептида (СТХ) при лечении антирезорбтивными препаратами или увеличение N-терминального пропептида проколлагена 1-го типа (P1NP) на фоне применения терипаратида менее чем на 25% должно быть расценено как отсутствие ответа на терапию или плохая приверженность пациента к лечению [13].
Высокие показатели маркеров костного ремоделирования предсказывают более быструю потерю костной ткани, однако на сегодня не существует порога вмешательства для конкретного пациента, поэтому не рекомендуется их использовать для прогнозирования риска переломов и назначения лечения [5].
Уровень маркеров костеобразования и костеразрушения до начала лечения не может влиять на выбор терапии по механизму действия. Это связано с тем, что, например, не было выявлено зависимости между уровнем маркеров костного ремоделирования перед началом лечения и степенью эффективности алендроновой кислоты для предупреждения переломов или прибавки МПК [14]. А анаболический препарат терипаратид эффективно снижал риск переломов у пациентов с ОП после произошедшего перелома, у которых уровень маркеров костного ремоделирования был повышен [15].
Таким образом, определение маркеров костного ремоделирования служит лишь дополнительным методом обследования при принятии решения о начале терапии ОП для последующей оценки эффективности лечения и приверженности к нему пациента, но не для выбора препарата в зависимости от его влияния на костный обмен.
ОСОБЕННОСТИ ДИАГНОСТИКИ ОСТЕОПОРОЗА У ЖЕНЩИН ДО МЕНОПАУЗЫ И МУЖЧИН МОЛОЖЕ 50 ЛЕТ
В указанной возрастной группе диагностика ОП не должна проводиться лишь на основании денситометрических критериев. Международное общество по клинической денситометрии (ISCD) рекомендует вместо T-критерия использовать Z-критерий: при его значениях -2,0 СО и ниже следует давать определение «низкая МПК для данного хронологического возраста» или «ниже ожидаемых по возрасту значений», а при значениях выше -2,0 СО – «в пределах ожидаемых по возрасту значений». Критерии ВОЗ могут применяться у женщин в перименопаузе [16].
Диагноз ОП может быть поставлен только у лиц с клинически значимыми хрупкими переломами (проксимального отдела бедра или позвонков) или в случае других низкоэнергетических переломов в сочетании с низкой МПК. Измерение МПК рекомендуется лицам с известными вторичными причинами ОП или хрупкими переломами в анамнезе; особое внимание следует уделять репродуктивной дисфункции – аменорее у женщин и гипогонадизму у мужчин. Генетическое обследование следует выполнять при подозрении на наследственное заболевание, основанном как на семейном анамнезе, так и дополнительных клинических признаках, указывающих на моногенетическое заболевание костей [17].
Этиологическое лечение должно быть начато у лиц с вторичной причиной ОП. Всем пациентам показан прием препаратов кальция и витамина D, при этом факторы риска (курение, кофеин, алкоголь) по возможности должны быть скорректированы, а потребление белка, физическая активность, вес и дефицит половых стероидов – нормализованы [18].
ЛЕЧЕНИЕ ОСТЕОПОРОЗА
Для лечения ОП в настоящее время в России применяются препараты как с антирезорбтивным, так и анаболическим действием (табл. 2). Все лекарства доказали свою эффективность в отношении снижения риска переломов в рандомизированных плацебо-контролируемых клинических исследованиях (РКИ). Проведенные в последующем многочисленные метаанализы подтвердили их противопереломное действие.
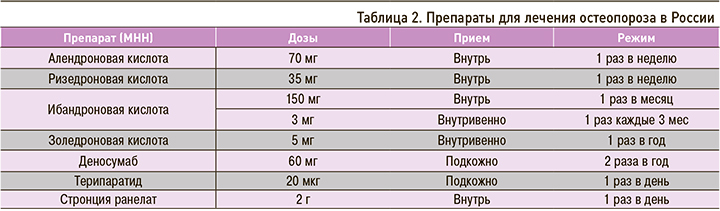
К антирезорбтивным средствам относятся бисфосфонаты и деносумаб. Бисфосфонаты могут использоваться для предупреждения патологических переломов и повышения МПК у пациентов с постменопаузальным ОП (алендроновая, ризедроновая, ибандроновая и золедроновая кислоты), лечения ОП у мужчин (алендроновая и золедроновая кислоты), при глюкокортикоидном ОП (алендроновая и золедроновая кислоты). Золедроновую кислоту в дозе 5 мг 1 раз в год дополнительно рекомендуется назначать после хирургического лечения по поводу патологического перелома проксимального отдела бедра для предупреждения новых переломов и улучшения выживаемости пациентов, что было продемонстрировано в многоцентровом рандомизированном исследовании HORIZON RFT [19].
Терапия ОП может назначаться в любой последовательности на усмотрение врача и с учетом пожеланий пациента по режиму дозирования. Решение о применении таблетированных или парентеральных форм антирезорбтивных препаратов принимается индивидуально исходя из анализа соотношения преимуществ к риску нежелательных реакций [5].
Российские эксперты разработали алгоритм выбора терапии ОП при оказании первичной медико-санитарной помощи и организации льготного лекарственного обеспечения отдельных категорий граждан, имеющих право на получение государственной социальной помощи. Пациентов с ОП эксперты условно разделили на имеющих умеренный или высокий риск переломов (уровень доказательности D – мнение членов Экспертного совета) [20].
К лицам с умеренным риском рекомендовано относить пациентов с ОП без переломов в анамнезе, у которых выявлено снижение МПК больше чем на 2,5 СО по Т-критерию или имеющих 10-летний риск основных остеопоротических переломов по FRAX выше порога вмешательства, а также пациентов с одним низкоэнергетическим переломом (кроме перелома позвонка или проксимального отдела бедренной кости) при МПК в зоне остеопении или в норме (Т-критерий более -2,5 СО) или 10-летнем риске основных переломов по FRAX ниже 30%. У этой категории пациентов эксперты считают целесообразным начинать лечение с пероральных бисфосфонатов (алендроновая или ризедроновая кислоты 1 раз в неделю или ибандроновая кислота 1 раз в месяц), а оптимальная продолжительность терапии должна составлять не менее 5 лет при хорошей переносимости и приверженности пациента к лечению [20].
При достижении клинического эффекта (отсутствие переломов за время приема препарата, прирост или стабилизация МПК на уровне >-2,0 СО по Т-критерию) может быть сделан перерыв в лечении до 2 лет. Однако пациенты должны находиться под ежегодным диспансерным наблюдением для возможности возобновления терапии в случае возникновения перелома при низком уровне травмы или отрицательной динамики при денситометрическом контроле [20]. Максимальный период приема пероральных бисфосфонатов составляет 10 лет [21].
При противопоказаниях к назначению пероральных бисфосфонатов (стриктура пищевода, ахалазия, заболевания верхних отделов желудочно-кишечного тракта в стадии обострения, неспособность больного стоять или сидеть прямо по крайней мере 30 мин после приема препарата) лечение рекомендуется начинать сразу с парентеральных антирезорбтивных средств. Среди бисфосфонатов это ибандроновая кислота, которая выпускается в форме раствора для внутривенного струйного введения (применяется 1 раз в 3 мес), или золедроновая кислота для внутривенного капельного введения (1 раз в год). Противопоказанием к использованию как парентеральных, так и пероральных бисфосфонатов является нарушение функции почек (скорость клубочковой фильтрации <35 мл/ мин), гипокальциемия.
Кроме бисфосфонатов, антирезорбтивным действием обладает генно-инженерный биологический препарат деносумаб, который является полным человеческим моноклональным антителом. В отличие от парентеральных бисфосфонатов он вводится подкожно с режимом дозирования 1 раз в 6 мес. Деносумаб может назначаться для предупреждения патологических переломов и повышения МПК у женщин с постменопаузальным ОП, у мужчин с повышенным риском переломов, при глюкокортикоидном ОП, а также для предупреждения потери МПК и переломов в отсутствие костных метастазов у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и у мужчин с раком предстательной железы, получающим гормон-депривационную терапию [5].
Деносумаб рекомендуется назначать пациентам с большой потерей МПК в кортикальной кости, а также больным, у которых лечение бисфосфонатами было неэффективно или не позволило достичь желаемой прибавки МПК. Это связано с тем, что, в отличие от бисфосфонатов, которые накапливаются в местах активного ремоделирования (трабекулярная кость), деносумаб равномерно распределяется как в трабекулярной, так и кортикальной кости. Деносумаб может применяться у пациентов с нарушенной функцией почек (скорость клубочковой фильтрации <35 мл/мин) [5].
Лечение парентеральными препаратами назначается, как правило, на 3 года, а затем при достижении клинического эффекта после применения золедроновой или ибандроновой кислоты возможны так называемые лекарственные каникулы, подобные тем, что были описаны выше для пероральных бисфосфонатов [20].
По окончании лечения деносумабом описано увеличение риска переломов позвонков, особенно у лиц, уже имевших их в анамнезе. Это связано с тем, что, в отличие от бисфосфонатов, которые связываются с гидроксиапатитом кости и длительно в ней находятся, действие деносумаба обратимо после полной элиминации его из крови. Поэтому для поддержания достигнутого эффекта необходимо перевести пациента на бисфосфонаты: с этой целью может быть назначена алендроновая кислота на один год через 6 мес после последней инъекции деносумаба или золедроновая кислота однократно через 8 мес [22].
К группе высокого риска эксперты рекомендуют относить пациентов, перенесших перелом позвонка, проксимального отдела бедра или два и более периферических переломов при любой величине МПК и независимо от показателя риска переломов по FRAX. Кроме того, в эту группу должны входить лица, перенесшие хотя бы один перелом и имеющие МПК по Т-критерию -2,5 СО и менее в поясничном отделе позвоночника и/или проксимальном отделе бедра. Также сюда следует относить людей с 10-летним риском основных переломов по FRAX 30% и более [19]. У таких пациентов рекомендуется начинать лечение сразу с парентеральных препаратов: бисфосфонатов (золедроновая или ибандроновая кислоты), деносумаба или терипаратида. По сравнению с парентеральными бисфосфонатами деносумаб имеет преимущества при значительном снижении МПК (Т-критерий ниже -3,5 СО).
При множественных компрессионных переломах позвонков и других костей скелета, а также при неэффективности или непереносимости антирезорбтивной терапии следует назначить терипаратид. Этот препарат имеет анаболическое действие на кость при интермиттирующем подкожном введении 20 мкг 1 раз/сут. Проведенные клинические рандомизированные исследования продемонстрировали его эффективность у женщин в постменопаузе с патологическими переломами тел позвонков в анамнезе независимо от исходного снижения МПК, предшествующих переломов и возраста [23], у мужчин с ОП [24] и пациентов с глюкокортикоидным ОП [25]. Перед назначением терипаратида необходимо исключить наличие у пациента гиперкальциемии, повышения уровня щелочной фосфатазы неясного генеза, гиперпаратиреоза и других метаболических заболеваний скелета (кроме самого ОП), а также онкологических заболеваний и метастазов в кости.
Терапия терипаратидом может продолжаться не более 24 мес, при этом перерыв в лечении по различным причинам, в том числе связанный с COVID-19, не должен превышать 3 мес. Для закрепления достигнутого увеличения МПК рекомендуется назначить препараты, обладающие антирезорбтивным действием, – деносумаб для дальнейшего прироста МПК или золедроновую кислоту для сохранения достигнутого эффекта [5].
В настоящее время не рекомендуется использовать стронция ранелат в рутинной практике для лечения ОП ввиду высокого риска сердечно-сосудистых осложнений и тромбоэмболии на фоне его приме. Назначение этого лекарственного средства возможно только пациентам с тяжелым ОП, когда ни один другой препарат не подходит [5]. В качестве меры предосторожности врачу следует проводить оценку сердечно-сосудистого риска перед назначением стронция ранелата и каждые 6 мес на протяжении всего периода лечения этим препаратом [26].
Антиостеопоротическое лечение должно проводиться на фоне приема кальция (500–1000 мг/ сут) и нативного витамина D3 (минимум 800 МЕ/ сут), так как по результатам многочисленных РКИ именно при такой схеме терапии доказана эффективность как антирезорбтивных, так анаболических препаратов [5].
Вместо нативного витамина D (колекальциферола) можно использовать альфакальцидол, который имеет преимущество для назначения у пожилых лиц с высоким риском падений [27]. Прием активных метаболитов витамина D по сравнению с колекальциферолом приводил к большему приросту МПК, а также снижению риска переломов позвонков и периферических костей как при первичном, так и глюкокортикоидном ОП [7]. Альфакальцидол можно использовать как совместно с бисфосфонатами, так и в качестве монотерапии при глюкокортикоидном ОП [7]. При лечении активными метаболитами витамина D (альфакальцидол, кальцитриол) возможно развитие гиперкальциемии и гиперкальциурии, поэтому они должны применяться только под регулярным врачебным контролем [5].
Пациентам с переломами тел позвонков, бедренной кости или множественными переломами в анамнезе, а также с риском основных переломов по FRAX 30% и более рекомендуется продолжать непрерывное длительное лечение ОП золедроновой кислотой или внутривенной формой ибандроновой кислоты не менее 6 лет. После этого при достижении клинического эффекта (стабилизации или повышении МПК и отсутствии новых переломов) можно временно прекратить терапию с последующим динамическим ежегодным наблюдением. В случае снижения МПК или развития нового перелома лечение следует возобновить.
В настоящее время существует мало данных о том, какова должна быть тактика через 6 лет непрерывного лечения, поэтому решение для каждого конкретного больного должно приниматься индивидуально [19]. Лечение деносумабом может продолжаться до 10 лет, поскольку в течение этого времени его применение эффективно и безопасно [28, 29]; после отмены препарата, как говорилось выше, необходимо перевести пациента на бисфосфонаты.
Одним из важных моментов лечения ОП является определение срока после низкоэнергетического перелома, через который можно начинать антиостеопоротическую терапию. Другой существенный вопрос – надо ли при уже проходящем лечении отменять препарат до тех пор, пока не произошла консолидация костей? Исследования, проведенные с использованием антирезорбтивных лекарственных средств, показали отсутствие их негативного эффекта на заживление переломов [28, 29], а применение терипаратида сопровождалось более быстрым образованием костной мозоли по сравнению со сроками естественной регенерации или на фоне приема бисфосфонатов [30].
ЗАКЛЮЧЕНИЕ
В ходе реализации федерального проекта «Старшее поколение» на врача первичного звена возлагаются обязанности по раннему выявлению лиц, имеющих ОП и/или высокий риск переломов, а также своевременному назначению антиостеопоротического лечения. В арсенале врачей имеется достаточный спектр фармакологических средств с доказанной эффективностью в отношении увеличения МПК и снижения риска переломов. Для достижения желаемого результата терапии необходимо сочетание множества факторов, из которых наиболее важными становятся обоснованный выбор лекарственного препарата, длительность и правильность его использования, а также приверженность пациента к лечению. Патогенетическая терапия должна проводиться на фоне приема добавок кальция и нативного витамина D, а в отдельных случаях – его активных метаболитов. Вновь произошедшие переломы не должны рассматриваться как противопоказание или причина для отсроченного начала медикаментозного лечения, а также перерыва в приеме антиостеопоротических препаратов.



