АКТУАЛЬНОСТЬ
Возможности современной хирургической помощи постоянно расширяются. Однако внедрение различных высокотехнологичных методик, позволяющих выполнять оперативные вмешательства, в том числе у коморбидных и пожилых пациентов, могут быть нивелированы недостаточной предоперационной подготовкой.
Подготовка пациента к оперативному вмешательству крайне важна. Мультидисциплинарный подход, включающий сотрудничество хирурга, анестезиолога и терапевта, а также при необходимости врачей других специальностей (например, трансфузиолога), является ключом к предоставлению высококачественной медицинской помощи и ее реализации с хорошими результатами.
Одним из важных факторов, независимо влияющим на развитие неблагоприятных исходов (увеличение продолжительности пребывания в стационаре, послеоперационные осложнения и смертность), считается предоперационная анемия [1].
ВЛИЯНИЕ ПРЕДОПЕРАЦИОННОЙ АНЕМИИ НА ИСХОДЫ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
У пациентов, готовящихся к серьезной операции, распространенность предоперационной анемии может достигать 75% в зависимости от сопутствующей патологии, пола, возраста и заболевания, приведшего к хирургическому вмешательству [2, 3]. В одном из исследований на большой когорте плановых хирургических пациентов (n=3342) общая встречаемость анемии (Hb <130 г/л) составила 36% с различиями в зависимости от пола (53% у женщин, 23% у мужчин; р <0,001) и хирургической специализации (гинекологические вмешательства – 64%; колоректальный рак – 58%; кардиохирургия – 40%; резекция метастазов в печени – 37%; плановая ортопедическая хирургия – 26%; радикальная простатэктомия – 8%) [4, 5].
Анемия в предоперационном периоде оказывает негативное влияние на летальность в послеоперационном периоде. Послеоперационная 30-дневная летальность больных даже с легкой анемией (отношение шансов (OR) 1,41; 95% доверительный интервал (ДИ): 1,30‒1,53) и тем более со среднетяжелой или тяжелой анемией (OR 1,44; 95% ДИ: 1,29‒1,60) выше в сравнении с аналогичным показателем у пациентов без анемии в предоперационном периоде [6]. Снижение уровня гемоглобина на 10 г/л связано с возрастанием периоперационного риска на 40% [4].
Метаанализ 24 исследований с общей численностью 949 445 пациентов показал, что анемия ассоциировалась с повышенным риском смерти во время и после операции, а также с повышенным риском острого повреждения почек, развития инфекций, инсультов и необходимости гемотрансфузий [7].
В настоящее время общепризнана связь переливания аллогенных компонентов крови с увеличением числа инфекционных осложнений на 6,6%, ишемических осложнений на 8,1%, а также смертности [8]. В исследовании, включавшем 8238 пациентов, переливание эритроцитарной взвеси было независимо связано с увеличением смертности при соотношении шансов 1,18 на единицу перелитой крови [9]. Исследования среди пациентов с различными некардиальными операциями показали аналогичные результаты [3, 10–12]. Также переливание крови увеличивает вероятность острого повреждения легких (острого респираторного дистресс-синдрома), гемолитической трансфузионной реакции, сердечной недостаточности, аллергических реакций, реже инфекций, таких как вирусный гепатит С и ВИЧ [1]. В австрийском исследовании частота предоперационной анемии у пациентов, которым переливали кровь, оказалась в среднем в 3 раза выше, чем у пациентов, которые не получали переливаний (29,9 против 9,3%) [13].
КОНЦЕПЦИЯ МЕНЕДЖМЕНТА КРОВИ ПАЦИЕНТОВ
Менеджмент крови пациента (МКП, Patient Blood Management) – это комплекс мер, включающий лечение анемии, предотвращение кровопотери и надлежащую практику переливания крови. Внедрение руководящих принципов МКП позволяет сократить потребность в переливании компонентов крови и улучшить результаты лечения [14]. У пациентов с предоперационной анемией или риском переливания компонентов крови необходимо инициировать МКП.
МКП был впервые предложен в 1988 г. и одобрен Всемирной организацией здравоохранения (ВОЗ) в 2010 г. [15]. В последнее десятилетие наблюдается сокращение переливания крови у хирургических пациентов, в том числе благодаря внедрению малоинвазивных и роботизированных операций. Например, уменьшить частоту переливаний крови позволило внедрение эндоскопических и роботизированных операций [16–18]. Однако факт предоперационной анемии по-прежнему часто игнорируется.
Согласно рекомендациям NICE (National Institute for Health and Care Excellence, Великобритания), всем пациентам, которым планируется оперативное лечение, необходимо определение развернутого анализа крови за 2 нед до даты операции. Тем, у кого до операции выявлена анемия, должна быть проведена консультация специалиста для выявления периоперационных рисков; при необходимости операцию следует отложить, чтобы обеспечить обследование и лечение анемии [16, 19].
Авторами CPOC (Center for Perioperative care, Великобритания) также уделяется большое внимание проблеме периоперационной анемии. Соответствующие рекомендации CPOC включают предоставление возможности медицинским организациям выявлять анемию, обследовать пациента на предмет ее причины, если таковая не связана с планируемым хирургическим вмешательством, а также иметь четкий поэтапный подход к лечению этого заболевания, основанный на клинической картине и времени, доступном до операции. Также СPOC предлагает составление локального алгоритма в медицинской организации, базирующегося на распространенности предоперационной анемии, частоте переливаний крови, продолжительности пребывания в стационаре пациента, оперативных вмешательств, проводимых в конкретной медицинской организации, а также сроках и возможности отсрочки операции [20]. При этом различные авторы подчеркивают, что, как правило, частота встречаемости предоперационной анемии среди молодых здоровых пациентов, у которых планируется оперативное вмешательство с минимальной кровопотерей, крайне мала. Нацеленность на выявление предоперационной анемии в наибольшей степени необходима при обследовании пациентов с риском развития анемии, ранее диагностированной анемией, а также при планируемом оперативном вмешательстве с ожидаемой кровопотерей более 500 мл [21]. В 2015 г. группа из четырех испанских больниц опубликовала результаты кратковременного предоперационного лечения анемии эритропоэтином и внутривенным введением железа у 2547 пациентов, перенесших эндопротезирование тазобедренного или коленного суставов либо операцию по поводу перелома бедра. Предпринятые меры позволили снизить частоту аллогенных переливаний с 37 до 24% (р <0,01), послеоперационных инфекций – с 12 до 8% (р <0,01), а продолжительность пребывания в стационаре – с 12 до 11 дней (р <0,01) [22].
ПРЕДОПЕРАЦИОННАЯ АНЕМИЯ У ЖЕНЩИН
Согласно определению ВОЗ, анемия у взрослых диагностируется при уровне гемоглобина менее 130 г/л у мужчин и менее 120 г/л у женщин [23]. Однако у хирургических пациентов многие авторы предлагают считать нормальным уровень гемоглобина у женщин 130 г/л. Это связано с тем, что объем циркулирующей крови у женщин ниже, чем у мужчин; одни и те же процедуры, выполняемые у обоих полов, часто вызывают сопоставимые объемы кровопотери. Следовательно, при измерении в процентах от объема циркулирующей крови потери крови у женщин выше и могут приводить к более высокой частоте переливаний. По результатам исследования OSTHEO в области ортопедической хирургии, при предоперационной концентрации гемоглобина 130 г/л вероятность переливания крови после эндопротезирования нижних конечностей была выше у женщин, чем у мужчин (34 против 22%) [24]. Более того, у женщин эта вероятность составляла 40% при уровне гемоглобине 120 г/л, снижаясь до 24% при 140 г/л [24]. Эти данные свидетельствуют о том, что «общепринятое» определение анемии может быть ненадежным для классификации хирургических пациенток [25].
ВИДЫ ПРЕДОПЕРАЦИОННОЙ АНЕМИИ
Выявленная анемия в предоперационном периоде может быть обусловлена заболеванием, по поводу которого планируется операция, либо связана с другими причинами. Так, с увеличением возраста увеличивается и количество коморбидных патологий, с которыми может быть ассоциирована анемия [25]. У этой категории пациентов сложнее диагностировать причину анемии, а также ее корректировать. Если причина предоперационной анемии не связана с заболеванием, требующим хирургического вмешательства, скорее всего, она не исчезнет после операции.
Наиболее распространена в предоперационном периоде железодефицитная анемия (ЖДА). Более 70% пациентов с предоперационной анемией имеют абсолютный или функциональный дефицит железа [4, 26].
К признакам ЖДА относятся снижение уровня сывороточного ферритина (СФ) менее <30 нг/мл (считается наиболее специфичным и экономичным тестом [27]), насыщение трансферрина (TSAT) менее 20%. Кроме того, у пациента в предоперационном периоде может выявляться латентный железодефицит без анемии (нормальный уровень гемоглобина, СФ <30 нг/ мл), который также важно корректировать перед операцией [4].
При наличии секвестрации железа в результате воспаления или функционального железодефицита уровень СФ >30 нг/дл не исключает дефицита железа. Для дальнейшей дифференциальной диагностики необходимо определить TSAT и уровень С-реактивного белка (СРБ), если рассматривается воспаление или функциональный железодефицит. Пациенты с дефицитом железа и воспалением имеют уровень СФ 30–100 нг/мл наряду с TSAT <20% и CРБ >5 мг/л. С другой стороны, для пациентов с воспалением без дефицита железа обычно характерны СФ >100 нг/мл, TSAT <20% и СРБ >5 мг/л. Поскольку СФ является белком острой фазы, он может быть повышен у пациентов с воспалением, даже если у них дефицит железа. В случае повышенного уровня СФ и опасения по поводу сопутствующего дефицита железа возможно определение ретикулоцитарного содержания гемоглобина (CHr), поскольку воспаление на этот показатель не влияет [5]. CHr дает косвенную меру железа, доступного для эритропоэза [28]. CHr <28 пг указывает на дефицит железа. У пациентов с функциональным дефицитом железа уровень СФ обычно составляет от 100 до 500 нг/мл наряду с TSAT менее 20% [5].
Кроме того, у пациентов в предоперационном периоде могут быть диагностированы и более редкие виды анемии (В12-дефицитная, фолиеводефицитная, гемолитическая и др.) [29].
ТЕРАПЕВТИЧЕСКИЕ ОПЦИИ КОРРЕКЦИИ ПРЕДОПЕРАЦИОННОЙ АНЕМИИ
Если у пациента доказано наличие железодефицита и до операции остается 6–8 нед, возможно назначение пероральных форм препаратов железа [5]. В России доступны препараты этой группы, содержащие железа сульфат, железа глюконат, железа фумарат, железа (III) гидроксид полимальтозат [30]. Доза лекарства должна быть рассчитана исходя из потребности в 15–30 мг элементарного железа в день [31]. При отсутствии продолжающегося кровотечения требуется 4–8 нед для повышения уровня гемоглобина на 20 г/л при приеме перорального железа [31].
В настоящее время обсуждается снижение суточных дозировок перорального железа в сравнении с предыдущей практикой использования больших доз (200–300 мг/сут) [5]. Это обусловлено двумя фактами: дозозависимым развитием нежелательных побочных реакций (тошноты, запора, диареи и др.), а также появлением данных об ограниченном всасывании железа из желудочно-кишечного тракта (20–25%). Кроме того, разделение суточной дозы железа на два приема не увеличивает его энтеральную абсорбцию [24, 32].
При выявлении ЖДА или дефицита железа без анемии менее чем за 6–8 нед до планируемой операции, а также при непереносимости пероральных форм препаратов железа и мальабсорбции необходимо рассмотреть введение внутривенных форм препаратов этого класса. Внутривенные формы препаратов железа содержат железа (III) гидроксид сахарозный комплекс, железа карбоксимальтозат, железа (III) гидроксид декстран, железа (III) гидроксид олигоизомальтозат (табл.). При внутривенном применении производных железа декстрана существует вероятность развития анафилаксии [1].
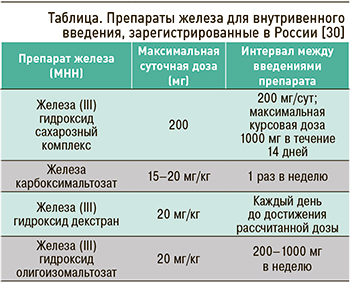
При анемии хронических заболеваний, связанной с воспалением, и, как следствие, повышением синтеза белка гепсидина, необходимо в первую очередь лечить основное заболевание. Также при выявлении этого вида анемии могут быть использованы препараты эритропоэтина и внутривенные препараты железа. Доступные в России препараты эритропоэтина включают эпоэтин альфа, дарбэпоэтин альфа [30, 33]. Американское управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило использование препаратов эритропоэтина для снижения потребности в переливании крови у пациентов с уровнем гемоглобина от 100 до 130 г/л, которым планируется проведение оперативного лечения, исключая операции на сосудах и сердце. В этом плане интересны результаты метаанализа 32 рандомизированных контролируемых исследований, где сравнивались 2482 пациента, получавших эритропоэтин до операции, и 2268 человек, получавших плацебо. Среди больных, у которых применялся эритропоэтин до хирургического вмешательства, было отмечено значительное снижение частоты аллогенного переливания крови по сравнению с пациентами группы плацебо (OR 0,59; 95% ДИ: 0,47–0,73; р <0,001) [34].
Анемия, связанная с недостаточностью витамина В12 или фолиевой кислоты, как правило, макроцитарная. Цианокобаламин можно вводить перорально или парентерально. Применение парентерального витамина В12 предпочтительно у пациентов с плохой абсорбцией пероральных препаратов, тяжелой анемией или при наличии невропатии [29]. Как правило, терапия В12-дефицитной анемии состоит из шести внутримышечных инъекций цианокобаламина по 1000 мкг с интервалом в 3–7 дней [29]. Полное восстановление уровня гемоглобина обычно наблюдается в течение 2 мес после начала терапии [35]. Высокие дозы перорального витамина В12 (2000 мкг/сут) могут быть столь же эффективны, как и парентеральная терапия.
Дефицит фолиевой кислоты встречается редко, его необходимо лечить с помощью фолиевой кислоты в дозировке 1–5 мг/сут перорально [35]. Продолжительность лечения составляет от 1 до 4 мес.
ЗАКЛЮЧЕНИЕ
Предоперационная анемия – независимый фактор риска неблагоприятных исходов оперативного лечения, а также увеличения частоты переливания крови. Несмотря на доказанные риски предоперационной анемии, факт ее наличия зачастую игнорируется специалистами. Своевременная диагностика и лечение предоперационной анемии позволяет снизить количество переливаний крови, а также послеоперационных осложнений. В каждой больнице, выполняющей оперативные вмешательства большого объема, должен быть внедрен протокол или алгоритм лечения предоперационной анемии. При хирургических вмешательствах предоперационный уровень гемоглобина ниже 130 г/л следует считать неоптимальным у мужчин и женщин, что требует его коррекции. Для плановых оперативных вмешательств это может потребовать отсрочки операции с целью лечения анемии. Дефицит железа без анемии также следует выявлять и лечить с целью восстановления депо железа для профилактики послеоперационной анемии.
При анемии, связанной с воспалением, необходимо рассмотреть возможность применения эритропоэтина в сочетании с внутривенным введением препаратов железа.



