ВВЕДЕНИЕ
Скелетно-мышечные заболевания представляют собой одну из главных медико-социальных проблем в современном здравоохранении. В перечне этих нозологий особую роль играют остеоартрит (ОА) и патологии околосуставных мягких тканей разной локализации, которые характеризуются высокой распространенностью в популяции [1].
ОСТЕОАРТРИТ
ОА – самое распространенное заболевание опорно-двигательного аппарата, приводящее к снижению трудоспособности и занимающее лидирующие позиции по частоте инвалидизации [2]. В 2019 г. были представлены эпидемиологические и социально-демографические характеристики ОА в рамках «глобального исследования бремени болезней» (Global Burden of Disease Study, GBD), в котором участвуют ученые из более чем 50 стран. По данным GBD 2019 г., заболеваемость ОА в мире достигает 7%, болезнь верифицирована у более чем 500 млн человек. За почти 30-летний период (с 1990 по 2019 г.) количество пациентов с ОА выросло на 48%. В проекте GBD-2019 ОА занимает 15-е место в рейтинге прожитых лет с инвалидностью, а у 2% респондентов он являлся причиной получения инвалидности [3].
Неутешительные статистические данные по ОА имеют место и в России. Так, по результатам крупного эпидемиологического исследования с участием более 76 тыс. человек, распространенность заболевания в нашей стране составила 13%, что превышает показатели официальной статистики Минздрава более чем в 5 раз [4].
Основа патогенеза ОА заключается во взаимодействии различных механических и биологических факторов, нарушающих существующее в норме равновесие между процессами деградации и синтеза всех компонентов матрикса суставного хряща. При этом к отличительным особенностям пациентов с ОА относится высокий коморбидный фон, что диктует необходимость персонифицированной тактики ведения больных и выбора наиболее безопасных методов лечения этой патологии [5].
Основные цели терапии ОА – уменьшение боли, улучшение функции суставов, предотвращение прогрессирования функциональной недостаточности, улучшение качества жизни, сокращение нежелательных явлений от фармакотерапии. Согласно современным рекомендациям зарубежных обществ по изучению ОА, а также российских экспертов в этой области, лечение этого заболевания включает использование нефармакологических методов, фармакотерапии (парацетамола, нестероидных противовоспалительных препаратов, симптоматических средств замедленного действия) и локальную терапию с применением внутрисуставных форм лекарственных препаратов [6, 7]. Внутрисуставное введение лекарственных средств при этом имеет ряд преимуществ по сравнению с применением пероральных и парентеральных форм препаратов: биодоступность, снижение системного воздействия, уменьшение побочных эффектов, возможность использования у мультиморбидных пациентов [8].
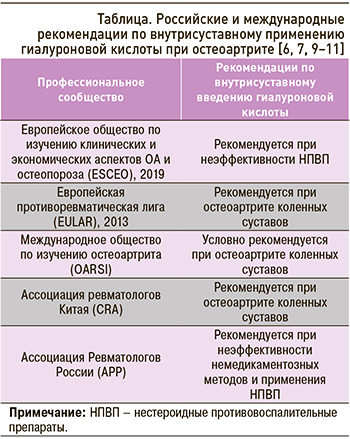
В последние годы обществами по изучению ОА разработаны различные рекомендации по ведению больных, включающие внутрисуставное применение препаратов гиалуроновой кислоты (табл. 1). Так, Европейское общество по изучению клинических и экономических аспектов ОА и остеопороза (ESCEO) разработало пошаговый алгоритм терапии ОА, в котором рекомендует использовать внутрисуставные препараты гиалуроновой кислоты (уровень доказательности 1В) у пациентов с сохраняющимися симптомами ОА [6]. Европейская противоревматическая лига (EULAR) рекомендует такие препараты для лечения ОА на основании их эффективности в отношении уменьшения боли и улучшения функции сустава (уровень доказательности 1В) [9]. Международное общество по изучению ОА (OARSI) условно рекомендует внутрисуставное введение гиалуроновой кислоты для пациентов с ОА коленных суставов в связи с более длительным ее лечебным эффектом по сравнению с глюкокортикоидами и благоприятным профилем безопасности. В «Заявлении о надлежащей клинической практике» OARSI отмечается, что внутрисуставное применение гиалуроновой кислоты может оказывать симптоматическое влияние на боль в течение более чем 12 нед [10]. Китайские эксперты в области ревматологии (Ассоциация ревматологов Китая, CRA) рекомендуют использование внутрисуставной гиалуроновой кислоты при ОА коленных суставов (уровень доказательности 2C) [11]. В нашей стране Ассоциация ревматологов России (АРР) рекомендует внутрисуставные инъекций гиалуроновой кислоты в случае неэффективности предшествующей немедикаментозной терапии и применения нестероидных противовоспалительных препаратов [7].
Кроме того, Приказом Минздрава России от 27.10.2022 № 706н утвержден новый стандарт медицинской помощи взрослым при гонартрозе. В Приложении к этому Приказу в раздел 2.5 «Немедикаментозные методы профилактики, лечения и медицинской реабилитации» включены препараты гиалуроновой кислоты (код медицинской услуги A16.04.051) [12].
Таким образом, большинство экспертов рекомендует использование ГУК в лечении ОА, исходя из принципов персонифицированной медицины.
СКЕЛЕТНО-МЫШЕЧНЫЕ ЗАБОЛЕВАНИЯ ОКОЛОСУСТАВНЫХ МЯГКИХ ТКАНЕЙ
Скелетно-мышечные заболевания околосуставных мягких тканей включают поражения плечевого (синдром сдавления ротаторов плеча, адгезивный капсулит), локтевого (эпикондилиты), коленного суставов (тендинопатия надколенника, сухожилий четырехглавой мышцы бедра и др.), области стоп (тендинопатия пяточного сухожилия) и др. [13].
Боль в плече – частая жалоба пациентов всех возрастов в повседневной клинической практике, от которой страдает примерно треть людей в течение жизни. Одной из самых частых причин такой боли служит синдром сдавления ротаторов плеча (ССРП), характеризующийся сдавлением вращательной манжеты плеча в субакромиальном пространстве. Для этого заболевания типична боль, локализованная в переднелатеральной акромиальной области, которая также может иррадиировать в латеральную среднюю часть плечевой кости. Клиническими особенностями ССРП являются ночной характер болей в области плечевого сустава, боль при подъеме руки на 70–120° («болевая дуга») при форсированных движениях над головой и в положении лежа на пораженной стороне, а также существенное снижение качества жизни пациентов [14, 15].
Адгезивный капсулит представляет собой тяжелое поражение плечевого сустава, сопровождающееся развитием фиброза капсулы, болью и потерей активных и пассивных движений в суставе. Адгезивный капсулит классифицируется как первичный или идиопатический, если возникает спонтанно, при отсутствии специфических причин, и как вторичный при наличии провоцирующего фактора (например, травмы). Известно, что адгезивный капсулит – частый «спутник» сахарного диабета (СД): при этом заболевании его частота колеблется от 10 до 20% [16]. Адгезивный капсулит диагностируется на основании анамнеза и физического осмотра и часто рассматривается как «диагноз исключения». Перед постановкой такого диагноза необходимо исключить другие причины боли и нарушения функции в плечевом суставе, включая септический артрит, неправильное положение ортопедических конструкций, нарушение сращения перелома, патологию вращательной манжеты плеча, импиджмент синдром и дорсопатию шейного отдела позвоночника. К ведущим клиническим признакам адгезивного капсулита относятся боль области плечевого сустава, постепенное ограничение активных и пассивных движений в суставе (в первую очередь внешняя ротация). Инструментальные исследования не являются необходимыми для диагностики адгезивного плечевого капсулита, но могут быть использованы в целях исключения других причин болей в области плечевого сустава [17].
Латеральный эпикондилит, также называемый «теннисный локоть», выступает наиболее распространенной причиной боли и дисфункции локтевого сустава, в основном возникающей в результате повторяющихся захватов или разгибаний запястья. Этиология этого заболевания точно не установлена. Основные его клинические проявления включают боль или жжение в области латерального надмыщелка плечевой кости, иррадиирующие вниз по предплечью, а иногда распространяющиеся проксимально к плечу. Боль в области локтевого сустава при латеральном эпикондилите обычно усугубляется при разгибании запястья с сопротивлением, например, при хватании предметов или скручивании полотенца [18].
В целом патология мягких тканей опорно-двигательного аппарата остается одной из наиболее частых причин обращения к врачу первичного звена [19].
Лечение заболеваний околосуставных мягких тканей строится на использовании широкого спектра терапевтических подходов: среди них прием НПВП, локальная терапия, физиотерапевтические мероприятия и хирургические пособия. Достаточно широко применяются методы локальной терапии с применением периартикулярных инъекций глюкокортикоидов в связи с быстрым анальгетическим эффектом и низкой стоимостью. Однако хорошо известно, что при данном методе лечения возможны дестабилизация сопутствующих заболеваний, а также развитие местных дистрофических реакций, что ограничивает его применение [20].
В настоящее время в связи с отсутствием четких клинических рекомендаций по ведению больных с патологиями сухожильно-связочного аппарата ведется поиск безопасных методов лечения этих часто встречающихся состояний. В частности, растет интерес к использованию при патологии мягких тканей гиалуроновой кислоты, учитывая ее различные физиологические функции и свойства [21]. Ряд клинических испытаний продемонстрировал преимущества инъекций гиалуроновой кислоты в лечении различных околосуставных патологий [22], и применение этого метода рассматривается сегодня как одно из перспективных направлений терапевтического алгоритма скелетно-мышечных заболеваний.
ГИАЛУРОНОВАЯ КИСЛОТА: СВОЙСТВА И ЭФФЕКТЫ
В 1997 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило применение гиалуроновой кислоты в качестве консервативной методики лечения ОА, а в 2000 г. Американская коллегия ревматологов (ACR) впервые представила ее в рекомендациях по ведению пациентов с ОА коленного сустава [23].
Гиалуроновая кислота представляет собой несульфатированное гликозаминогликановое небелковое соединение с отчетливыми физико-химическими свойствами повторяющихся звеньев β-1,4-D-глюкуроновой кислоты и β-1,3-N-ацетилглюкозамина [24]. Основная функция этого вещества состоит в улучшении любрикантных свойств суставных поверхностей, что способствует поглощению вибрации, уменьшению трения и протекции сустава. Известно, что гиалуроновая кислота выполняет не только локальную функцию, но еще и действует как сигнальная молекула. Взаимодействуя с различными рецепторами клеточной поверхности, она способна регулировать пролиферацию клеток и миграцию хондроцитов, которые воздействуют на внеклеточный матрикс, что, в свою очередь, не только создает условия для синтеза эндогенного гиалуроната, но и уменьшает разрушение хряща [25].
Противовоспалительная активность гиалуроновой кислоты является еще одним ее важным свойством. Она реализуется в результате связывания гиалуроновой кислоты с рецепторами CD 44 на поверхности хондроцитов и проявляется снижением секреции провоспалительного цитокина интерлейкина-1β (ИЛ-1β), благодаря чему уменьшается выработка катаболических ферментов (металлопротеиназ) [26]. Гиалуроновая кислота способна подавлять синтез и других провоспалительных медиаторов (фактора некроза опухоли-альфа, ИЛ-17, оксида азота) посредством связывания с толл-подобными рецепторами TLR 2 и 4 [27]. Кроме того, она выступает важным компонентом внеклеточного матрикса суставного хряща, что имеет большое значение для поддержания целостности биомеханики хряща [28]. Таким образом, с учетом многогранности механизма действия гиалуроновой кислоты ее введение при ОА вполне обоснованно (табл. 2).

Гиалуроновая кислота, предназначенная для внутрисуставного введения, может иметь различную молекулярную массу: низкую – от 500 до 1600 кДа, среднюю – от 1600 до 3000 кДа, и высокую – свыше 3500 кДА (при этом 3500 кДа – предел бактериального синтеза гиалуроновой кислоты).
На сегодняшний день выявлено несколько механизмов воздействия гиалуроновой кислоты на околосуставные ткани (сухожильно-связочный аппарат). Она оказывает влияние как на место повреждения сухожилия, так и на синовиальную оболочку, уменьшая периферический воспалительный ответ и способствуя репаративным изменениям вследствие вовлечения в процесс восстановления эпитеноновых и эндотеноновых клеток. Гиалуроновая кислота может оказывать болезнь-модифицирующий эффект, приводя к повышенной регенерации теноцитов, восстановлению соотношения коллагена типа I/типа III и снижению апоптоза. Также в клинических испытаниях показано ее положительное влияние на вязкоэластичность сухожилий. Введение препаратов 1% гиалуроновой кислоты более эффективно при поражении околосуставных мягких тканей и тендинопатиях, чем другие методы локальной терапии (например, применение глюкокортикоидов), за счет предотвращения спаечного процесса и ее противовоспалительного действия [29, 30].
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ГИАЛУРОНОВОЙ КИСЛОТЫ ПРИ СКЕЛЕТНО-МЫШЕЧНЫХ ЗАБОЛЕВАНИЯХ ОКОЛОСУСТАВНЫХ МЯГКИХ ТКАНЕЙ
Совсем недавно (2023) опубликованный метаанализ клинических исследований по изучению эффективности локальной терапии при патологии мягких тканей продемонстрировал эффективность периартикулярного введения гиалуроновой кислоты. Общая выборка включала 1629 пациентов, их средний возраст составил 48,5±9,9 лет. В метаанализ вошли 19 рандомизированных клинических исследований, 11 из которых оценивали эффективность гиалуроновой кислоты у пациентов с патологией мягких тканей плеча (ССРП, тендинопатией и неполными разрывами вращательной манжеты плеча). По результатам метаанализа, применение гиалуроновой кислоты способствовало как быстрому снижению интенсивности болевого синдрома, так и сохранению анальгетического эффекта в долгосрочной перспективе от 6 до 12 нед при сравнении с другими методами терапевтического воздействия, такими как PRP-терапия (1 испытание), введение глюкокортикоидов (3 испытания), плацебо (7 испытаний) [31].
Субакромиальное введение 1% гиалуроновой кислоты пациентам с поражением мышц ротатора плеча способствует уменьшению боли и улучшению функции сустава. В двойном слепом рандомизированном исследовании Blaine T. et al. показали эффективность ее применения у пациентов с болью в плече. В исследование было включено 660 пациентов с постоянной болью в плечевом суставе, разрывом манжеты ротатора и/или адгезивным капсулитом, у которых стандартная терапия оказалась неэффективной; в общей сложности все 26 нед наблюдения прошли 456 участников. Пациенты были рандомизированы на две группы: 1-я – 5-недельный курс терапии гиалуроновой кислотой; 2-я – 3-недельный курс гиалуроновой кислоты, а далее – 2-недельный курс внутрисуставных инъекций физиологического раствора или 5-и недельный курс внутрисуставных инъекций физиологического раствора. Анализ результатов показал эффективность терапии и уменьшение боли по визуальной аналоговой шкале (ВАШ) через 26 нед в обеих группах. Значимых различий между эффектами от 3 и 5 инъекций гиалуроновой кислоты выявлено не было [32].
В работе Russo A. et al. также была продемонстрирована эффективность локального применения гиалуроновой кислоты в комбинации с другими методами лечения у пациентов с адгезивным капсулитом плечевого сустава. В исследовании участвовало 52 человека с идиопатическим адгезивным капсулитом в возрасте от 36 до 52 лет, которым проводилась комплексная медикаментозная терапия: местные инъекции анестетика (ропивакаина), субакромиальные инъекции гиалуроновой кислоты средней молекулярной массы № 3 и реабилитационные мероприятия. Уменьшение болей и медленное и постепенное восстановление движений наблюдалось у всех пациентов с первых сеансов лечения. Почти полное исчезновение симптомов и восстановление объема движений были достигнуты в среднем через 5–7 нед после 15–20 сеансов комбинированного лечения. В целом у 96,1% участников исследования наблюдалось достижение полного клинического эффекта [33].
В исследовании Tack P. et al. была установлена эффективность гиалуроновой кислоты у пациентов с ССРП. В нем приняли участие 72 (средний возраст 66 лет) человека с указанной патологией, которым выполнялись 3 последовательные субакромиальные инъекции гиалуроновой кислоты. Больных наблюдали в течение 5 лет. Согласно полученным результатам, 77% пациентам не требовалось дополнительное лечение – у них значимо снизились показатели боли и улучшилось качество жизни по опроснику SF-36. При этом лишь 11% участников не достигли значимого клинического эффекта и нуждались в других лечебных мероприятиях [34].
Frizziero A. et al. в проспективном исследовании сравнили влияние субакромиальных инъекций низкомолекулярной гиалуроновой кислоты с физиотерапевтическими методами лечения (ударно-волновая терапия) у пациентов с некальцифицирующей тендинопатией надостной мышцы. Применение 1% гиалуроновой кислоты 1 раз/нед в течение 21 дня сопровождалось значимым снижением уровня боли в области плеча с сохранением клинического эффекта в течение 3 мес [35].
Petrella R. et al. оценили эффективность гиалуроновой кислоты при латеральном эпикондилите. Исследователи сравнили результаты терапии у пациентов, получавших инъекции этого препарата, с контрольной группой, которым вводились инъекции 1,2 мл солевого раствора (плацебо). Авторы выявили статистически значимое уменьшение боли в пораженном локтевом суставе по ВАШ в покое и после физической нагрузки в группе терапии гиалуроновой кислотой [36].
В другом проспективном рандомизированном исследовании авторы (Tosun H.B. et al.) сопоставили эффективность комбинированной локальной терапии гиалуроновой кислотой и хондроитина сульфатом с локальными глюкокортикоидами. В результате лечения (одна локальная инъекция в каждой группе медикаментозной терапии) оба метода способствовали быстрому наступлению анальгетического действия, однако при долгосрочной оценке эффективности значимое снижение боли и улучшение функции локтевого сустава определялось только у пациентов, получавших гиалуроновую кислоту [37].
Таким образом, многочисленные клинические исследования подтвердили эффективность применения гиалуроновой кислоты при скелетно-мышечных заболеваниях. Отметим при этом, что особую роль в достижении значимого противоболевого эффекта и улучшения функции суставов при ОА и патологии околосуставных тканях играют препараты гиалуроновой кислоты молекулярной массы 1–1,6 МДа с содержанием 1% гиалуроната натрия.
Одним из новых представителей препаратов гиалуроновой кислоты, показавшим свою эффективность как при ОА, так и заболеваниях околосуставных мягких тканей, является Флексотрон Форте. Он представляет собой 1% гиалуронат натрия с молекулярным весом в районе 1,1 МДа, синтезируемый из японской субстанции (SHISEIDO). Основные показания к применению медицинского средства Флексотрон Форте включают остеоартрит, посттравматические и другие дегенеративные изменения синовиальных суставов; восстановление свойств синовиальной жидкости при ортопедической хирургии суставов, а также у лиц, имеющих повышенные нагрузки на поврежденные суставы. Режим введения этого препарата – одна инъекция в неделю в течение 3–4 нед. К преимуществам Флексотрона Форте можно отнести не только улучшение реологических вязкоупругих свойств синовиальной жидкости, но и противовоспалительный эффект, который проявляется за счет ингибиции ИЛ-1-индуцируемого синтеза оксида азота и простагландина E2.
БЕЗОПАСНОСТЬ ЛОКАЛЬНЫХ ПРЕПАРАТОВ ГИАЛУРОНОВОЙ КИСЛОТЫ
Известно, что инъекции гиалуроновой кислоты относительно безопасны. Так, в метаанализе Miller L.E. et al. статистически значимой разницы в появлении нежелательных явлений у пациентов, получавших препараты гиалуроновой кислоты для лечения ОА коленных суставов, и у лиц контрольной группы обнаружено не было [38].
В небольшом числе случаев сообщалось о псевдосептических реакциях после инъекций гиалуроновой кислоты, чаще встречающихся при использовании кросс-линк препаратов и препаратов с наибольшей молекулярной массой [39].
Еще один метаанализ, посвященный аспектам безопасности терапии ОА коленного сустава, показал, что препараты гиалуроновой кислоты с высокой (>3,5 МДа) молекулярной массой почти в два раза чаще вызывают локальные побочные реакции (отношение шансов 1,91; 95% доверительный интервал: 1,04–3,49) по сравнению с продуктами средней и низкой молекулярной массы [40].
ЗАКЛЮЧЕНИЕ
Скелетно-мышечные заболевания представляют собой серьезную социально-медицинскую проблему. Одним из перспективных направлений в терапии ОА и патологии околосуставных мягких тканей служит применение локальной гиалуроновой кислоты. Этот метод терапии отличается безопасностью по сравнению с другими видами медикаментозной коррекции и доказанной эффективностью действия в отношении основной клинической симптоматики скелетно-мышечных заболеваний.
Гиалуроновая кислота может рассматриваться как перспективное средство для уменьшения симптомов и снижения прогрессирования ОА. Ее эффективность объясняется многими механизмами действия, включая лубрикантные свойства и противовоспалительные эффекты, которые позволяют воздействовать на улучшение функционального статуса, снижение уровня боли в суставе и повышение качества жизни пациентов. Терапия гиалуроновой кислотой рекомендована ведущими отечественными и зарубежными экспертами в области изучения ОА, а также представлена в российских клинических рекомендациях по ведению больных с ОА.
По сей день появляются новые данные об эффективном локальном применении гиалуроновой кислотой при тендинопатиях и патологиях околосуставных тканей. Использование 1% гиалуроната натрия, например медицинского средства Флексотрон Форте, не только эффективно влияет на боль и функцию в суставе, но также обладает репаративным и противовоспалительным действием на пораженные мягкие ткани.
Тем не менее многие аспекты метаболизма гиалуроновой кислоты все еще нуждаются в изучении. Это необходимо, чтобы понять различные биологические действия, которые она оказывает на воспалительный процесс, в том числе в зависимости от ее молекулярной массы. Понимание этих механизмов может открыть новые возможности применения гиалуроновой кислоты в терапии скелетно-мышечных заболеваний.



