АКТУАЛЬНОСТЬ
Фибрилляция предсердий (ФП) – наиболее распространенная аритмия в реальной клинической практике. ФП значительно повышает риск тромбоэмболических осложнений и является причиной более 26% ишемических инсультов. В настоящее время распространенность ФП у взрослых составляет от 2 до 4% с прогнозируемым увеличением в 2,3 раза в связи с ростом продолжительности жизни и активной диагностикой субклинической формы заболевания [1–5].
Поскольку оральные антикоагулянты (ОАК) эффективно предотвращают большинство ишемических инсультов при ФП, простые схемы стратификации индивидуального риска развития инсульта были разработаны уже в 1990-х гг., и шкала CHA2DS2-VASc стала достоверным инструментом прогнозирования тромбоэмболических осложнений.
ПРИНЦИПЫ НАЗНАЧЕНИЯ АНТИКОАГУЛЯНТНОЙ ТЕРАПИИ ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Принципы назначения антикоагулянтной терапии при неклапанной ФП в соответствии с текущими рекомендациями включают следующие пункты:
- постоянный прием ОАК с целью профилактики тромбоэмболических осложнений рекомендован пациентам мужского пола с суммой баллов по шкале CHA2DS2-VASc ≥2 и женского пола с суммой баллов ≥3;
- отказ от ОАК, если показатель CHA2DS2-VASc равен 0 у мужчин или 1 у женщин;
- ОАК следует рассматривать для профилактики инсульта у мужчин с ФП, имеющих показатель CHA2DS2-VASc, равный 1, или у женщин с 2 баллами по этой шкале.
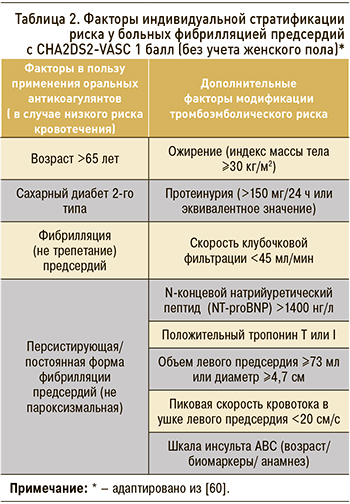
Пациенты с показателями по CHA2DS2-VASc 1 балл (мужчины) или 2 балла (женщины) представляют собой «серую» зону. В клинических рекомендациях указано, что лечение должно быть индивидуальным, основанным на клинической пользе и учете ценностей и предпочтений пациента. При этом ни в одном рандомизированном клиническом исследовании (РКИ) не рассматривалась потребность в приеме ОАК у пациентов с одним фактором риска (не связанным с полом) по шкале CHA2DS2-VASc (для получения высокой частоты событий и своевременного завершения исследований в них основном включались пациенты с высоким риском), но субанализ результатов РКИ и обсервационные исследования указывают на то, что пациенты получают клиническую пользу от применения ОАК в тех ситуациях, когда снижение частоты инсульта превышает потенциальный вред от приема ОАК в виде серьезных кровотечений [7]. Истинная частота инсульта и системных эмболий у пациентов, имеющих 1 балл по шкале CHA2DS2-VASc, значительно варьирует – от 0,5 до 2,8% в год; наряду с оценкой индивидуального риска кровотечений, это необходимо учитывать при принятии решения о назначении антикоагулянтной терапии у данной категории пациентов (табл. 1).
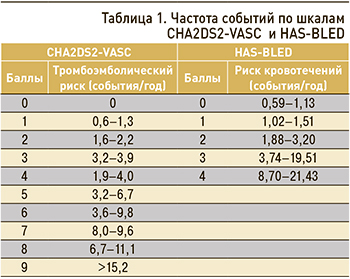
Текущие клинические рекомендации не содержат алгоритма точного клинического выбора при принятии решения о применении ОАК у пациентов среднего риска [6, 7].
Шкала CHA2DS2-VASc основывается исключительно на клинических факторах риска (возраст, артериальная гипертония, диабет, сосудистые заболевания). Однако в настоящее время эксперты высказывают опасения по поводу специфичности показателя CHA2DS2-VASc в прогнозировании инсульта, учитывая следующие факты:
- недавние исследования о значении CHA2DS2-VASc для прогнозирования ишемического инсульта при отсутствии ФП;
- шкала не учитывает несколько ключевых факторов, специфичных для ФП, которые, как известно, влияют на риск ишемического инсульта (тяжесть ФП, размер и функция левого предсердия и ушка левого предсердия, сердечные биомаркеры и т.д.). Также не принимается в расчет наличие конкурирующих факторов риска, таких как сложная бляшка в аорте или стеноз сонной артерии, которые ассоциированы с двойным риском развития инсульта у больных ФП [8–11].
Далее мы рассмотрим дополнительные факторы тромботического риска у пациентов с ФП, которые в настоящее время активно исследуются и обсуждаются.
ХАРАКТЕРИСТИКИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Традиционное патофизиологические объяснение тромбоэмболических рисков при ФП заключается в застое и образовании тромба в условиях отсутствия систолы предсердий и нормального опорожнения ушка левого предсердия (ЛП). Логично предположить, что бόльшая тяжесть ФП приводит к увеличению продолжительности застоя и, следовательно, к повышенному риску образования тромбов и последующего инсульта [12]. При этом в клинических рекомендациях отражено традиционное представление о том, что ФП независимо от типа и тяжести служит фактором риска развития инсульта. Рекомендации рассматривают ФП как бинарный фактор риска (либо присутствует, либо отсутствует, независимо от типа) и используют исключительно клинические факторы риска инсульта (оценка CHA2DS2-VASc) для обоснования решения о назначении антикоагулянтов [6, 7]. Вместе с тем новые данные свидетельствуют, что традиционная бинарная парадигма оценки риска инсульта может быть чрезмерным упрощением [13, 14].
Важно отметить, что исследования, которые легли в основу настоящих рекомендаций, были проведены у пациентов с клинической ФП. Клиническая ФП выявляется либо из-за симптомов, либо в отсутствие симптомов случайно при проведении обследования по иной причине. Однако с появлением носимых устройств и увеличением объема информации о длительном мониторировании сердечного ритма, получаемой от имплантируемых девайсов, частота выявления субклинической и кратковременной ФП возрастает [15, 16].
Клиническая фибрилляция предсердий – пароксизмальная/непароксизмальная
Текущие рекомендации классифицируют ФП по следующему типу: впервые диагностированная, пароксизмальная (ПФП), персистирующая, длительно персистирующая и постоянная. К непароксизмальной (НФП) относят постоянную и персистирующую ФП.
За последнее десятилетие было проведено множество крупномасштабных РКИ новых пероральных антикоагулянтов (НОАК) при ФП. В них не изучалась связь подтипа ФП и риска инсульта, однако эти исследования предоставляют данные о большом количестве больных НФП и ПФП с различными баллами по CHA2DS2-VASc. Анализ исследования ARISTOTLE, оценивавшего эффективность апиксабана в сравнении с варфарином для профилактики инсульта при ФП у 18 201 пациента, показал, что отношение рисков (ОР) при инсульте для ПФП по сравнению с НФП составило 0,70 (95% ДИ: 0,51–0,93; р=0,015) [17]. Аналогичные результаты были получены в исследованиях ENGAGE-AF и ROCKET-AF [18, 19].
Ganesan A.N. et al. исследовали взаимосвязь типа ФП и риска инсульта с помощью систематического обзора исследований, в которых сообщалось о клинических исходах, стратифицированных по типу ФП, что позволило охватить почти 100 000 пациентов. Они установили нескорректированный годовой риск инсульта в 2,17% у пациентов с НФП против 1,50% у пациентов с ПФП (ОР 1,355; 95%ДИ: 1,169–1,571, р <0,001). После корректировки на факторы риска развития инсульта на уровне пациента взаимосвязь сохранялась (ОР 1,384; 95% ДИ: 1,19–1,608; р <0,001) [20]. Таким образом, можно резюмировать, что традиционная парадигма эквивалентности рисков между ПФП и НФП неверна.
Пароксизмальная фибрилляция предсердий: имеет ли значение степень тяжести аритмии (нагрузка ФП)?
ПФП охватывает гетерогенную группу с различной степенью частоты, продолжительности и общей тяжести (нагрузки) ФП. Boriani G. et al. оценили популяцию с известной ПФП, у которой выполнялся непрерывный мониторинг ритма в течение 12 мес с помощью имплантируемого сердечного устройства. Частота тромбоэмболических осложнений при последующем наблюдении увеличивалась с ростом продолжительности ФП: <5 мин – 1,2%, 5 мин – 24 ч – 1,7% и >24 ч – 4,0% [21]. Дальнейшая работа Go A.S. et al. подтвердила концепцию повышенного градиента риска инсульта с увеличением бремени ФП [22]. Botto G.L. et al. также оценили продолжительность ФП и риск инсульта у 568 пациентов с имплантированным кардиостимулятором и ФП в анамнезе. Они обнаружили линейное увеличение риска инсульта с ростом продолжительности ФП [23].
Таким образом, имеются достаточные данные, подтверждающие градиент риска инсульта в пределах ПФП, при этом более высокая продолжительность/нагрузка ассоциирована с увеличением риска инсульта.
Обнаруженная прибором/субклиническая фибрилляция предсердий
Клиническая ФП – это ФП, которая обнаруживается в ходе целенаправленного поиска из-за наличия симптомов или случайно на электрокардиограмме (ЭКГ), выполняемой по другим причинам (скрининг, предоперационное обследование и т.д.). В свою очередь, «субклиническая ФП» определяется как бессимптомная ФП, обнаруживаемая при анализе записей девайса или при длительном мониторировании; это означает, что у пациента может быть выявлен даже низкий уровень тяжести ФП (короткие, редкие эпизоды).
В исследованиях, изучающих тяжесть ФП у пациентов с сердечными имплантируемыми электронными устройствами, преимущественно сообщается о самом длительном эпизоде ФП. Такие факторы, как количество эпизодов и общий процент времени ФП, часто не анализируются, при этом наибольшая продолжительность ФП используется в качестве суррогата нагрузки.
Что касается эпизодов учащенного предсердного ритма, то клинические рекомендации предлагают инициировать назначение ОАК при наличии обнаруженных устройством эпизодов ФП (>180 ударов в минуту в течение >5–6 мин) у пациента с показателем CHA2DS2-VASc, превышающим пороговое значение для приема антикоагулянтов, при условии подтверждения ФП на ЭКГ прибора, на ЭКГ в покое или на амбулаторном регистраторе ЭКГ (IA) [7].
Данные исследований ФП, определяемой с помощью устройств, продемонстрировали стабильно более низкий риск инсульта по сравнению с ожидаемым на основе оценки CHA2DS2-VASc. Это ставит под сомнение постулат эквивалентности риска инсульта при различной тяжести ФП. Исследования подтверждают, что cубклиническая ФП или выявленная с помощью девайса представляет собой фенотип, обычно ассоциированный с меньшим бременем аритмий: в этом случае риск инсульта и тромбоэмболии выше, чем у пациентов без ФП, но частота событий ниже, чем ожидалось у больных клинической формой ФП с аналогичными показателями CHA2DS2-VASc, что подтверждает идею о градиенте нагрузки, определяющей риск инсульта [12].
Кроме того, учитывая, что шкала CHA2DS2-VASc была разработана для клинической ФП, возможно, нецелесообразно использовать одни и те же пороговые значения при оценке риска инсульта и потребности в ОАК. Это было продемонстрировано Kaplan R.M. et al., которые обнаружили градиент риска с увеличением нагрузки и показателей CHA2DS2-VASc, в результате чего пациенты с низким риском по этой шкале и с длительной ФП оставались в группе низкого риска, а пациентам с высокими показателями CHA2DS2-VASc требовалась только кратковременная ФП для увеличения риск инсульта [24].
Популяция, в которой бремя ФП может быть полезным для уточнения риска инсульта, относится к среднему риску; в ней рекомендуется «рассмотреть» антикоагулянтную терапию у мужчин с показателем CHA2DS2-VASc в 1 балл и у женщин с 2 баллами [12]. На рисунке 1 обобщены современные представления о влиянии нагрузки ФП на риск инсульта.
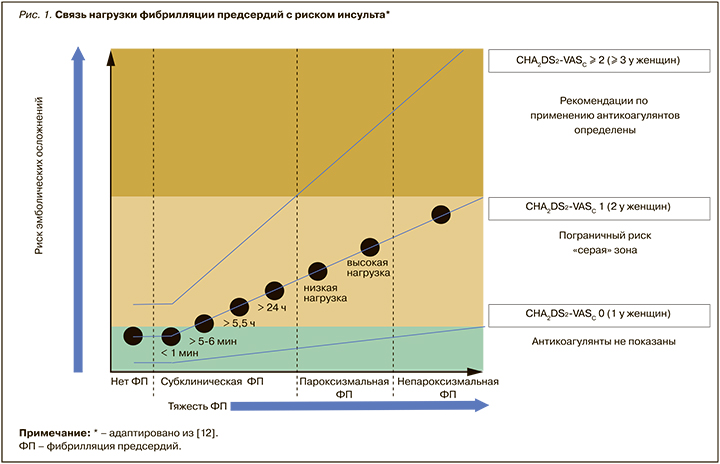
Таким образом, несмотря на наличие четкой взаимосвязи риска инсульта с клиническими системами оценки, такими как оценка CHA2DS2-VASc, для всех фенотипов ФП абсолютный риск различен в зависимости от степени тяжести заболевания. Несмотря на растущее количество свидетельств о связи градиента тяжести ФП и риска инсульта, необходима дальнейшая работа по уточнению взаимосвязи и определению пороговых значений, при которых ОАК имеют оптимальное соотношение риск/польза. Поэтому существует идея создания новой шкалы, сочетающей оценку бремени ФП с оценкой клинического риска, – CHA2DS2VASc-AFBURDEN.
МОРФОЛОГИЯ ЛЕВОГО ПРЕДСЕРДИЯ И ГЕМОДИНАМИКА
Предсердная кардиомиопатия определяется как «любой комплекс структурных, сократительных или электрофизиологических изменений, влияющих на предсердия с потенциалом возникновения клинически значимых проявлений», а левое ЛП можно рассматривать как «орган-мишень», который страдает от повреждений, вызванных системными заболеваниями (например, артериальной гипертонией, ишемической болезнью сердца и диабетом) [25]. Более 90% тромбов у пациентов с ФП образуются в ушке ЛП [26].
Исследования показали, что аномальная морфология ушка ЛП и параметры гемодинамики, на которые она влияет, тесно связаны с образованием тромбов, что может быть использовано для прогнозирования риска, особенно в клинической группе со средним риском (мужчины с показателем CHA2DS2-VASc в 1 балл и женщины с 2 баллами) [27, 28]. С другой стороны, установлено, что существует разница между оценкой CHA2DS2-VASc и фактической частотой тромбоза [29]. Его прогностические значение для тромбоза ЛП при ФП были подвергнуты критике, особенно у пациентов с низким риском тромбоза [30–33].
Качественные морфологические показатели и их прогностическое значение при тромбозе
По своим морфологическим характеристикам ушки ЛП разделяются на четыре классических типа: «куриные крылышки», «кактус», «ветряная мельница» и «цветная капуста» [34]. Морфология ушка ЛП оказывает различное влияние на гемодинамические параметры [35].
Это действительно приводит к различиям в риске образования тромбов, но трудно определить, какой именно тип сопряжен с самым высоким риском. В настоящее время в отношении взаимосвязи между морфологией ушка ЛП и риском тромбообразования сделан только один расплывчатый вывод – более сложная форма связана с более высоким риском образования тромбов. Субъективность критериев классификации существенно ограничивает их прямое клиническое использование при оценке риска [25].
Количественные морфологические и гемодинамические показатели
Увеличение ушка ЛП у пациентов с ФП может препятствовать его опорожнению и в конечном итоге увеличивать риск тромбоза. Следовательно, размер ушка считается фактором риска тромбоза [36]. Показано, что площадь отверстия и конечный диастолический объем ушка ЛП увеличивается с ростом показателей CHA2DS2-VASc [37]. Было обнаружено, что турбулентность кровотока и объем ушка левого предсердия независимо связаны с тромбозом, обеспечивая более точные прогнозы, особенно для пациентов с низкими значениями CHA2DS2-VASc [38,39]. Установлено, что каждое увеличение размера ЛП на 10 мм увеличивает риск инсульта на 40–100%, в то время как большие и/или менее подвижные ушки ЛП ассоциированы с возрастанием скорректированного риска инсульта до 6 раз [40, 41]. Увеличение размера ЛП также выступает предиктором риска повторного кардиоэмболического или криптогенного инсульта у пациентов с НФП [42].
Пиковое продольное напряжение предсердий (ЛП strain) – более чувствительный маркер для выявления раннего функционального ремоделирования, чем явное его структурное изменение. Было опубликовано несколько исследований, касающихся потенциальной роли ЛП strain в стратификации риска инсульта [43, 44].
Аномальная форма и двигательная функция ушка ЛП у пациентов с ФП, несомненно, влияют на кровоток внутри и снаружи, вызывая образование тромбов, и показатели, связанные с кровотоком, могут быть одними из наиболее идеальных методов прогнозирования. В этом контексте обсуждаются следующие показатели – скорость кровотока в ушке ЛП, фракция выброса ЛП [25].
Все эти морфологические и гемодинамические параметры имеют особую клиническую ценность для обоснованной оценки риска тромбообразования при ФП, особенно у пациентов с низкими показателями CHA2DS2-VASc, являясь потенциальным решением дилеммы назначения препаратов с геморрагическими рисками. Недостаток такого подхода заключается в высокой стоимости и лишь относительной доступности необходимых исследований (чреспищеводная эхокардиография, компьютерная томография).
БИОМАРКЕРЫ РИСКА ИНСУЛЬТА ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Система оценки риска инсульта ABC, включающая возраст пациента, биомаркеры (высокочувствительный тропонин и N-концевой натрийуретический пептид) и клинический анамнез предшествующего инсульта/транзиторной ишемической атаки (ТИА), была разработана для прогнозирования инсульта или системной эмболии у 14 701 пациента с ФП, получавшего антикоагулянты, которые были включены в исследование ARISTOTLE; эта шкала прошла внешнюю валидацию у 1400 участников с ФП или трепетанием предсердий в исследовании STABILITY [45, 46].
В исследовании, проведенном в Испании среди 1125 пациентов с ФП, которые получали варфарин и наблюдались в течение медианы 6,5 лет, шкала инсульта ABC не показала преимущества по сравнению с CHA2DS2-VASc [47]. Кроме того, уровни биомаркеров значительно изменяются с течением времени. Так, высокочувствительный тропонин изменялся у 46,9% (динамика ≥2 нг/л), а N-концевой натрийуретический пептид у 51,9% (динамика ≥200 пг/мл) пациентов в течение 12 мес, повторная же оценка риска инсульта АВС через 12 мес реклассифицировала значительную долю пациентов по сравнению с их исходным риском (чистое улучшение при реклассификации на 0,50) [48].
Учитывая затраты на измерение биомаркеров риска инсульта и неопределенность интервалов через которые эти биомаркеры следует перепроверять, шкала CHA2DS2-VASc по-прежнему остается предпочтительным инструментом для оценки риска инсульта [45].
ОПРЕДЕЛЕНИЕ ИНДИВИДУАЛЬНОГО РИСКА CHA2DS2-VASc: ВСЕ ЛИ ФАКТОРЫ РИСКА ОДИНАКОВЫ?
Шкала CHA2DS2-VASc присваивает 1 балл за каждый фактор риска, за исключением перенесенного инсульта/ТИА и возраста старше 75 лет (2 балла). Эта стратификация была выбрана в основном по практическим соображениям, чтобы сделать инструмент оценки риска инсульта и системной тромбоэмболии клинически полезным и простым в применении у постели больного.
Однако проведенные исследования поставили под сомнение эту практическую концепцию оценки риска в подгруппе пациентов с показателем CHA2DS2-VASc 1 балл, показав различное индивидуальное увеличение риска тромбоэмболии в зависимости от конкретного фактора риска [49]. Этот эффект оставался после стратификации у лиц мужского и женского пола. Наиболее значительное увеличение риска наблюдалось для «возраста 65–74 лет», за которым следовал «сахарный диабет 2-го типа». Важно отметить, что возраст пациентов >65 лет свидетельствует о значительном и постоянно увеличивающемся риске тромбоэмболических осложнений у пациентов женского и мужского пола, что усиливает и другие факторы риска, используемые в шкале CHA2DS2-VASc. Самый низкий риск развития инсульта показан для «артериальной гипертонии» у женщин и «сосудистых заболеваний» у пациентов мужского пола [50, 51].
Кроме того, остается неясным влияние на индивидуальный тромбоэмболический риск таких факторов, как контролируемая/неконтролируемая артериальная гипертония, компенсация/декомпенсация сахарного диабета, степень тяжести и компенсация/декомпенсация хронической сердечной недостаточности.
ДОПОЛНИТЕЛЬНЫЕ КЛИНИЧЕСКИЕ ФАКТОРЫ РИСКА ТРОМБОЭМБОЛИИ
Функция почек
Функция почек пациентов имеет первостепенное значение для принятия решений о ведении пациентов, поскольку показано ее прогностическое значение в отношении развития тромбоэмболических осложнений в общей популяции больных ФП [52]. Хроническая болезнь почек связана с повышенным риском инсульта, системной тромбоэмболии, а также кровотечений у пациентов с ФП. Альтернативные шкалы R2CHADS2 и ATRIA (адаптированы для прогнозирования риска тромбоэмболии у пациентов с НФП) включают такие переменные, как «протеинурия», «терминальная стадия почечной недостаточности» или «расчетная скорость клубочковой фильтрации (рСКФ) ниже 45 мл/мин» [53, 54]. Эти показатели полезны для взвешивания индивидуального риска тромбоэмболии у пациентов среднего риска и могут учитываться при принятии решений о ведении пациентов [55].
Фибрилляция предсердий/трепетание предсердий
Согласно действующим рекомендациям, не существует различий в принципах назначения антикоагулянтной терапии пациентам с трепетанием предсердий (ТП) и ФП. В то же время анализ базы данных исследований национального медицинского страхования Тайваня (n=219 416) свидетельствует о значительном отклонении между фактическим риском тромбоэмболии при ФП и ТП. Авторы отметили, что частота случаев ишемического инсульта на 100 человеко-лет (ФП – 3,1% / ТП – 1,5%) и смертность (ФП – 17,8%/ ТП – 13,9%) были значительно выше при ФП. Схожие результаты были получены у пациентов с показателем CHA2DS2-VASc в 1 балл: у пациентов с ФП по сравнению с ТП наблюдалось увеличение риска ишемических осложнений (ОР 2,88; 95%ДИ: 1,73–4,80) и смертности от всех причин (ОР 1,43; 95%ДИ: 1,23–1,66).
Принимая во внимание эти результаты, тип предсердной аритмии может быть рассмотрен для уточнения риска тромбоэмболии у пациентов с промежуточным риском [55].
ПЕРЕОЦЕНКА ТРОМБОЭМБОЛИЧЕСКОГО РИСКА ПРИ Фибрилляции Предсердий
При оценке риска инсульта у пациентов с ФП важно учитывать его динамику [56–58]. Среди пациентов с впервые диагностированной ФП, первоначально получивших оценку по CHA2DS2-VASc 0 (мужчины) или 1 (женщины) балл, которым не было показано лечение ОАК, через год примерно у 16% показатель увеличился на 1 балл, а использование ОАК после увеличения значений CHA2DS2-VASc было связано с лучшим клиническим исходом [58, 59].
До настоящего времени не выполнялось высококачественных проспективных исследований, изучающих оптимальную частоту повторной оценки риска инсульта и последующих изменений стратегии его профилактики. Единственные доступные данные были получены в тайваньской когорте, демонстрирующие, что среди пациентов, которые приобретут новые факторы риска инсульта, у 80% лиц это произойдет в течение 4,2 мес после постановки диагноза ФП. Период от приобретения сопутствующих заболеваний до возникновения ишемического инсульта у 90% пациентов составил более 4,4 мес. Следовательно, 3–4 мес могут быть разумным временным интервалом, в течение которого следует провести переоценку риска инсульта для своевременного назначения терапии ОАК [58].
АЛГОРИТМ ПРИНЯТИЯ РЕШЕНИЯ ОБ ИНИЦИАЦИИ ПРИЕМА ОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ У ПАЦИЕНТОВ С 1 БАЛЛОМ ПО CHA2DS2-VASc (БЕЗ УЧЕТА ПОЛА)
Попытка обобщить все вышеизложенные позиции и сформулировать ясный алгоритмированный подход к назначению ОАК в этой сложной клинической группе пациентов предпринята в документе Европейского общества кардиологов (Рабочая группа по сердечно-сосудистой фармакотерапии и Совет Европейского общества кардиологов по инсульту) от 2021 г. «Персонализированное антитромботическое лечение пациентов с неклапанной фибрилляцией предсердий и оценкой CHA2DS2-VASc-1» [60]. Рабочая группа Европейского общества кардиологов (ESC) пришла к выводу, что основное терапевтическое решение у пациентов с показателем CHA2DS2-VASc 1 балл должно основываться на тщательном балансе риск/польза. Следует отметить, что предпочтения пациентов имеют значение для принятия решений за или против терапии ОАК в плане обеспечения приверженности к лечению. Документ содержит легко применимый алгоритм инициации приема ОАК, который ориентирует врачей в решении вопроса о том, проводить ли антитромботическую терапию в этой «серой» зоне.
Рисунок 2 и таблица 2 иллюстрируют основанный на фактических данных подход как к оценке риска, так и к антитромботической терапии у пациентов с показателем CHA2DS2-VASc 1 балл. Как гласит вышеупомянутый документ ESC, «терапевтические решения должны основываться на индивидуальном балансе между риском тромбоэмболии и кровотечения: терапевтическое предпочтение должно отдаваться тому, чтобы не навредить, а не избежать инсульта. Если было принято решение о начале применения ОАК у пациентов с ФП, имеющих показатель CHA2DS2-VASc 1 балл, следует предпочесть НОАК с более высокой чистой клинической пользой, чем антагонисты витамина К» [60].
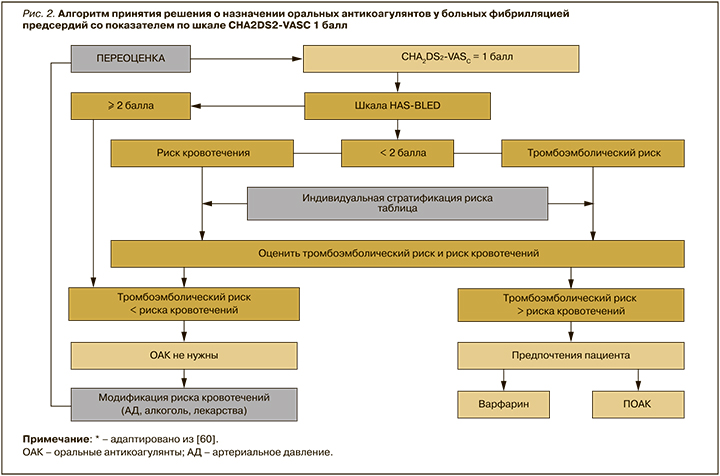
ВЫБОР АНТИКОАГУЛЯНТА У ПАЦИЕНТОВ С 1 БАЛЛОМ ПО CHA2DS2-VASc (БЕЗ УЧЕТА ПОЛА)
При инициации терапии в рассматриваемой клинической группе целесообразно анализировать баланс риск/польза ОАК и выбирать препарат с минимальным риском кровотечений. На основании анализа крупных РКИ только апиксабан продемонстрировал значимое уменьшение риска кровотечений в сравнении с варфарином. Прямое сравнение варфарина и апиксабана у больных НФП было сделано в крупном двойном слепом исследовании ARISTOTLE [61]. По сравнению с варфарином апиксабан обладал преимуществом как по эффективности (обеспечивал более низкую совокупную частоту инсульта и артериальных тромбоэмболий), так и безопасности (меньшая частота крупных кровотечений). В результате было отмечено достоверное снижение общей смертности при лечении этим НОАК. При анализе структуры крупных кровотечений на фоне приема апиксабана реже возникали клинически значимые кровотечения. Сходный баланс эффективности и безопасности наблюдался у разных категорий больных вне зависимости от суммы баллов по шкалам CHA2DS2-VASc и HAS-BLED (включая высокий риск кровотечений), у больных с нарушенной функцией почек, в пожилом и старческом возрасте (старше и 75 лет). Соответственно клиническое преимущество апиксабана перед варфарином по совокупному показателю эффективности и безопасности распространялось и на наиболее «уязвимые» контингенты больных с высоким риском кардиоэмболических осложнений и/или с высоким риском возникновения серьезных кровотечений [61].
Исследование NAXOS (EvaluatioN of ApiXaban in strOke and Systemic embolism prevention) стало крупнейшим в европейской клинической практике анализом эффективности и безопасности ОАК у пациентов с НФП. NAXOS – ретроспективный анализ данных пациентов во Франции (n=321 501) старше 18 лет с диагнозом НФП, которым впервые были назначены ОАК в период с 2014 по 2016 г. В нем было установлено, что применение апиксабана связано с более низким уровнем частоты больших кровотечений по сравнению с антагонистами витамина K (ОР 0,49; 95% ДИ: 0,46–0,52), ривароксабаном (ОР 0,63; 95% ДИ: 0,58–0,67) и дабигатрана этексилатом (ОР 0,85; 95%ДИ: 0,76– 0,95) при сопоставимой частоте развития инсульта и системной тромбоэмболии в сопоставлении с дабигатрана этексилатом и ривароксабаном. Прием апиксабана также был ассоциирован с более низким уровнем общей смертности относительно антагонистов витамина К (ОР 0,56; 95% ДИ: 0,54–0,58) и ривароксабана (ОР 0,89; 95% ДИ: 0,85–0,94) и сравним в этом плане с дабигатрана этексилатом (ОР 0,94; 95% ДИ: 0,87–1,01) [62].
В связи с этим апиксабан представляется убедительным выбором в клинической ситуации, когда риски тромбоэмболических осложнений и кровотечений взвешены и имеются дополнительные факторы тромботического риска.
ЗАКЛЮЧЕНИЕ
Пациенты с ФП, имеющие показатель по шкале CHA2DS2-VASc 1 балл (без учета пола), являются наиболее уязвимыми при рассмотрении вопроса о начале антитромботической терапии. При инициации ОАК в этой группе необходимо взвешивать тромботические и геморрагические риски, анализировать дополнительные риски инсульта и системной эмболии и принимать максимально взвешенное персонифицированное решение о начале терапии. Требуется проведение дополнительных исследований по внедрению новых шкал оценки риска в клинической группе пограничного риска тромбоэмболических осложнений. При выборе ОАК следует выбирать препараты с максимально благоприятным балансом риск/польза.



